原发性肝癌组织中微RNA-543表达与微血管密度的相关性
2021-08-10陈文换杨峰燕张艳华白志超高建芝
陈文换,杨峰燕,张艳华,白志超,高建芝
(1.涿州市医院病理科,河北 涿州 072750;2.涿州市医院肿瘤科,河北 涿州 072750;3.涿州市医院神经内科,河北 涿州 072750)
原发性肝癌(primary liver cancer,PLC)是发病率较高的恶性肿瘤之一,其转移率、复发率及致死率较高,近年来,PLC发病率呈上升趋势,严重影响患者的身心健康和生命质量[1-2]。研究显示,微RNA(microRNA,miR)与PLC的发生和发展密切相关,miR-543可促进肿瘤细胞的增殖、侵袭和转移[3-4]。有研究显示,肿瘤的生长和浸润需要新生血管不断提供充足的营养物质,微血管密度(microvessel density,MVD)可反映肿瘤的血管生成程度,在肿瘤生物学行为演进中起非常重要的作用[5-6]。本研究旨在探讨PLC组织中miR-543表达与MVD的相关性。
1 资料与方法
1.1 一般资料选择2016年6月至2020年6月涿州市医院收治的100例PLC患者作为观察组,所有患者经影像学及病理学检查确诊为PLC,术前未进行放射治疗、化学治疗及动脉栓塞治疗,且无其他严重基础疾病及肿瘤。另选择同期因外伤行部分肝切除的70例患者作为对照组,所有患者为外伤性肝破裂,并伴有失血性休克,且未合并肝癌及其他肿瘤。观察组:男87例,女13例;年龄29~81(62.54±9.36)岁,体质量指数25~42(29.26±4.23)kg·m-2;单发肿瘤56例,多发肿瘤44例;合并肝硬化64例,未合并肝硬化36例;肿瘤直径<5 cm者59例,≥5 cm者41例;TNM临床分期:Ⅰ、Ⅱ期38例,Ⅲ、Ⅳ期62例。对照组:男49例,女21例;年龄23~76(60.49±8.27)岁,体质量指数22~39(28.14±4.04)kg·m-2。2组患者的性别、年龄、体质量指数比较差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审核批准,均有患者及家属签署知情同意书。
1.2 试剂与仪器TRIzol试剂盒购自天根生物科技(北京)有限公司,实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒购自日本TaKaRa公司,CD34单克隆抗体购自福州迈新生物技术开发有限公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记兔鼠通用二抗试剂、抗原修复仪及LINK48自动免疫组织化学染色仪购于丹麦Dako公司。
1.3 qRT-PCR法检测PLC组织和正常肝组织中miR-543的表达按照TRIzol试剂盒说明书裂解、提取PLC和正常肝组织中总RNA,按照qRT-PCR试剂盒说明书反转录合成cDNA。miR-543上游引物序列为5′-GGGGAAACATTCGCGGTGCA-3′,下游引物序列为5′-TGCGTGTCGTGGAGTC-3′。以U6为内参,U6的上游引物序列为5′-CTCGCTTCGGCAGCACA-3′,下游引物序列为5′-AACGCTTCACG-AATTTGCGT-3′。反应条件:预变性95 ℃、5 min;变性95 ℃、25 s;退火60 ℃、50 s;延伸72 ℃、40 s,共40个循环。实验重复3次,取均值。采取2-ΔΔCt法计算miR-543的相对表达量。
1.4 免疫组织化学染色法检测PLC组织和正常肝组织中MVD石蜡组织连续切片(厚约4 μm),65 ℃烤箱烤1 h,二甲苯脱蜡,梯度乙醇水化,抗原修复1.5 h,滴加阻断剂、一抗CD34(滴度1100)、HRP二抗(滴度12 000),二氨基联苯胺显色,苏木精复染、分化、蓝化,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察。以抗CD34单克隆抗体标记的血管内皮细胞计数MVD,按Weidner校正方法计数,先低倍镜(40倍)下寻找癌组织中CD34阳性微血管最密集区域,再于高倍镜(200倍)下选取5个视野,计数每个视野下微血管数量,取均值。

2 结果
2.1 PLC组织和正常肝组织中miR-543相对表达量比较PLC组织和正常肝组织中miR-543相对表达量分别为3.231±0.312、1.021±0.052,PLC组织中miR-543相对表达量显著高于正常肝组织,差异有统计学意义(t=4.216,P<0.05)。
2.2 PLC组织和正常肝组织中MVD比较结果见图1和图2。CD34抗体表达于血管内皮细胞的细胞质中,呈棕黄色颗粒弥漫性分布。PLC组织和正常肝组织中MVD分别为44.79±8.54、9.68±3.27,PLC组织中MVD显著高于正常肝组织,差异有统计学意义(t=3.175,P<0.05)。

图1 PLC组织中CD34蛋白的表达(免疫组织化学染色,×200)Fig.1 Expression of CD34 protein in PLC tissues (immunohistochemical staining,×200)

图2 正常肝组织中CD34蛋白的表达(免疫组织化学染色,×200)Fig.2 Expression of CD34 protein in normal liver tissues (immunohistochemical staining,×200)
2.3 miR-543表达和MVD与PLC病理特征的关系结果见表1。miR-543表达和MVD与肿瘤直径、肿瘤分期有相关性(P<0.05),而与肿瘤数目、是否合并肝硬化无相关性(P>0.05)。
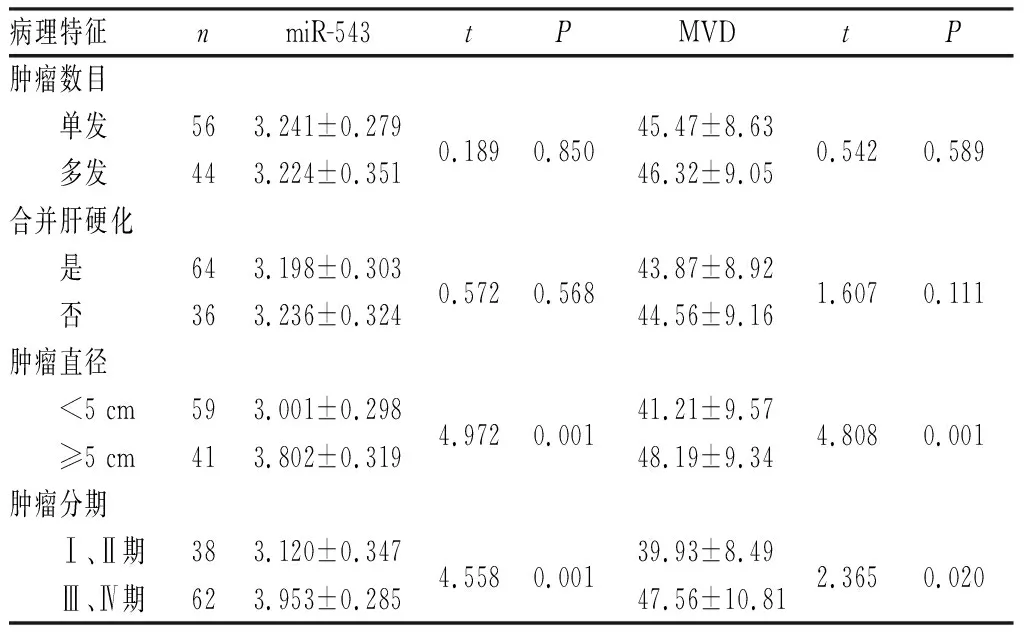
表1 miR-543表达和MVD与PLC病理特征的关系Tab.1 Relationship between miR-543 expression,MVD and pathological features of PLC
2.4 PLC组织中miR-543表达与MVD的相关性PLC组织中miR-543表达与MVD呈正相关(r=0.601,P<0.05)。
3 讨论
PLC常见的组织学类型有肝细胞癌和肝内胆管细胞癌,大体上可分为孤立型、多结节型、弥漫型和巨块型,多数晚期患者可见门静脉癌栓形成。PLC的易感因素有乙肝病毒、乙醇及黄曲霉毒素等,在我国多由肝炎及肝硬化发展而来,目前临床上多依赖病史、影像学及病理学检查等进行诊断[7-8]。PLC患者的预后较差,5 a存活率较低,早期发现并及时给予治疗可提高患者生存率。目前,肝癌最有效的治疗方法为手术完整切除,无法手术或复发性肿瘤可采用肝动脉栓塞等治疗方法。肝癌的发生、发展涉及多种向肿瘤细胞传达增殖和细胞生存表型的遗传学改变,包括染色体扩增、杂合性缺失及突变等,可为临床靶向治疗提供依据。
miR属于非编码单链RNA,广泛存在于真核生物,参与基因表达调控及生物体发育时序等各个阶段,且对恶性肿瘤具有双向调节作用[9-10]。有文献指出,miR-122、miR-26a等表达下调及miR-115、miR-221等表达上调与肝癌的发生和发展密切相关[11]。研究显示,miR-135a、miR-106b、miR-500a为肝细胞癌的致癌基因,miR-199a、miR-125、miR-26a为肝细胞癌的抑癌基因[12];有研究发现,肝细胞癌组织中miR-543表达水平显著高于癌旁组织,表明miR-543作为一种致癌基因参与细胞癌的生长和转移[13]。本研究结果显示,miR-543在PLC组织中的表达显著高于正常肝组织,提示miR-543可能与PLC的发生、发展密切相关;同时,miR-543表达和MVD与肿瘤直径、肿瘤分期有相关性,其在直径≥5 cm及Ⅲ、Ⅳ期肿瘤组织中表达显著升高,提示miR-543可能与肿瘤的增殖、侵袭有关。
肝脏为富血供器官,肝癌的肝内、外转移主要是通过血液,癌细胞可通过门静脉系统在肝内播散或转移至肺,也可经肝静脉达下腔静脉及右心房,少数可通过血行广泛播散,发生肾上腺和骨转移。血源性转移多见于巨块型和弥漫型肝细胞癌,发生转移者临床分期晚、预后差、生存率低,需选择放射治疗、化学治疗、免疫治疗等综合性治疗方案,因此,通过减少微血管形成而阻止肿瘤转移成为医学研究的一个重要方向[14-15]。肿瘤的生长及侵袭等生物学行为依赖于间质丰富的血供系统、新生血管形成及血液中丰富的营养物质和分泌因子,癌组织中微血管形成情况可通过MVD得到反映[16-17]。有研究显示,肝癌组织中MVD与组织分化程度、肿瘤大小、门静脉癌栓及甲胎蛋白水平显著相关[18]。本研究结果显示,PLC组织中MVD显著高于正常肝组织,PLC组织中MVD与肿瘤直径、肿瘤分期有相关性,其在直径≥5 cm及Ⅲ、Ⅳ期肿瘤组织中水平升高,且PLC组织中miR-543表达与MVD呈正相关,表明MVD高可能预示肿瘤生长速度快、转移率高及预后不佳。
综上所述,miR-543在PLC组织中表达上调,且其表达与肿瘤组织中MVD呈正相关,提示miR-543表达上调和肿瘤组织中MVD增加可能与PLC的进展有关。本研究从基因层面和脉管系统为阐明PLC的发病机制提供了必要的前期研究基础,为PLC的早期诊断和靶向治疗提供了一定的实验依据。
猜你喜欢
——涿州市林屯中心学校阅读活动简介
