竹鼠肠道纤维素降解菌的分离鉴定及其产酶特性研究
2021-08-09曾文婷覃绍敏吴健敏梁小莉白安斌刘金凤陈凤莲秦树英
曾文婷 覃绍敏 吴健敏* 梁小莉 白安斌 刘金凤 陈凤莲 秦树英 马 玲
(1.广西大学动物科学技术学院,南宁 530004;2.广西壮族自治区兽医研究所,广西兽医生物技术重点实验室,南宁 530001;3.广西农业职业技术学院动物科学技术学院,南宁 530007)
纤维素是植物中主要的多糖化合物[1],广泛存在于秸秆、稻草、谷物、豆类、麦类及其加工产品等动物饲料中[2]。然而,植物细胞壁的复杂结构严重阻碍了富含纤维素的植物在畜牧业生产中的应用[3],为了解决这一问题,常使用纤维素酶将植物细胞壁等植物纤维降解为葡萄糖,以提高其利用率和转化率。微生物是纤维素酶的主要来源,据不完全统计,迄今为止,国内外共报道了约53个属的几千个菌株可产纤维素酶,包括细菌、真菌、放线菌等[4]。几乎所有哺乳动物,包括草食性哺乳动物,自身不能产生纤维素酶,而是依靠肠道微生物的帮助来消化纤维素,因此,哺乳动物肠道中有丰富的纤维素降解菌资源。此外,动物来源的纤维素降解菌在粗纤维饲料应用上有天然的优势,其大多是肠道固有菌,较容易适应畜禽体内的肠道内环境并发挥作用。因此,从动物肠道中筛选获得有效的纤维素降解菌,对粗纤维饲料的开发利用具有重要意义。
动物源纤维素降解菌的研究主要集中在植食性动物上,其肠道和粪便是纤维素降解菌的重要来源,研究表明,反刍动物瘤胃中存在的白色瘤胃球菌(Ruminococcusalbus)、黄色瘤胃球菌(Ruminococcusflavefaciens)和产琥珀酸丝状杆菌(Fibrobactersuccinogenes)是公认的瘤胃三大优势纤维素降解菌[5];何静等[6]在双峰驼的瘤胃内容物中分离获得1株纤维素降解菌,该菌株能明显分解纤维素。此外,在大熊猫[7-8]、猪[9]等杂食性动物的粪便或肠道中也分离到了产纤维素酶的细菌,这些细菌普遍集中在瘤胃球菌属、梭菌属、拟杆菌属、普雷沃氏菌属、纤维杆菌属、芽孢杆菌属和毛螺旋菌属。
竹鼠(Rhizomys)又称竹鼬、竹根鼠、芒狸等,是一种皮肉兼用且营养和药用价值较高的珍贵特种动物[10]。竹鼠以采食植物性食物为主,对粗纤维和木质素的消化率较高,耐粗饲,是所有饲养动物中粗纤维利用率最高的动物,并且是唯一和大熊猫类似,能在肠道中高效降解纤维素的单胃哺乳动物。研究表明,大熊猫体内并不存在编码纤维素酶的基因,而是依靠肠道内微生物进行食物中纤维素的降解[11]。虽然未见对竹鼠进行全基因组测序的报道,但可以推测,竹鼠肠道内微生物对食物中纤维素的降解应该起到了关键的作用。目前,从竹鼠体内分离纤维素降解菌的研究鲜有报道,仅宁俊平[12]从竹鼠体内分离到7株兼性厌氧的纤维素降解菌以及曹晓燕[13]从竹鼠体内分离到2株具有纤维素酶活性的严格厌氧的细菌,证实竹鼠体内也存在能分解纤维素的细菌。上述研究均集中在对厌氧菌的分离。本试验改进传统的纤维素降解菌初筛方法,旨在从竹鼠肠道内容物中筛选获得具有较高纤维素酶活性的需氧菌,以期为秸秆、象草等高粗纤维含量饲料的开发利用提供候选菌株。
1 材料与方法
1.1 试验材料
1.1.1 样品来源
广西桂林市某竹鼠养殖场成年健康竹鼠肠道内容物。
1.1.2 主要试剂
革兰氏染色液、芽孢染色液、荚膜染色液、普通营养肉汤培养基、普通营养琼脂培养基、LB液体培养基、LB琼脂培养基、MRS液体培养基、MRS琼脂培养基、TSA琼脂培养基、麦康凯琼脂培养基、PDA琼脂培养基为北京陆桥技术股份有限公司产品,细菌微量生化管为杭州滨和微生物试剂有限公司产品,细菌DNA抽提试剂盒为北京康为世纪公司产品,羧甲基纤维素钠(CMC-Na)、CMC-Na琼脂培养基、CMC-Na刚果红培养基为山东拓普生物科技有限公司产品,DNA Ladder Marker、PCR Mix为TaKaRa公司产品,微晶纤维素为COOLABER生物科技有限公司产品,D-水杨苷为源叶生物有限公司产品,3,5-二硝基水杨酸(DNS)为国药集团化学试剂有限公司产品,其他常规试剂均为分析纯。
1.1.3 培养基及主要溶液
鲜血琼脂培养基:将无菌脱纤维羊血按照5%的量加入到冷却至55~60 ℃的普通琼脂培养基中,混合后倒入平板中冷却至室温。
种子培养基:氯化钠5 g,牛肉膏5 g,蛋白胨10 g,蒸馏水1 000 mL,自然pH。
发酵培养基:CMC-Na/微晶纤维素/D-水杨苷10 g,磷酸氢二钾1 g,硫酸镁0.5 g,硫酸铵2 g,氯化钠2.5 g,酵母粉2.5 g,蛋白胨5 g,蒸馏水1 000 mL,自然pH。
滤纸培养基:滤纸条(每条:1.0 cm×3.6 cm,约0.03 g)5 g,酵母粉2 g,磷酸二氢钾 0.5 g,硫酸镁0.5 g,蒸馏水1 000 mL,自然pH。
DNS试剂:称取DNS(10±1) g,置于约600 mL水中,逐渐加入氢氧化钠10 g,在50 ℃水浴中搅拌溶解,再依次加入酒石酸甲钠200 g、苯酚(重蒸)2 g和无水亚硫酸钠5 g,待全部溶解并澄清后,冷却至室温,用水定容至1 L,过滤。滤液贮存于棕色试剂瓶中,于暗处放置7 d后使用。
1.2 样品处理
称取竹鼠肠道内容物1.0 g,转移至盛有100 mL无菌水的三角瓶中,在80 ℃电热恒温振荡水浴锅中振荡30 min,分别取上清液1 mL于LB、MRS和普通营养肉汤液体培养基中,37 ℃、220 r/min振荡培养12 h后,取1 mL发酵液于装有9 mL无菌水的试管中,进行梯度稀释,分别取10-4、10-5、10-6稀释液200 μL,分别涂布到LB、MRS、TSA、普通营养、麦康凯、CMC-Na、PDA和鲜血琼脂平板上,每个稀释梯度3个重复,涂布后的平板置于37 ℃恒温箱培养24 h。
1.3 菌株纯化及纤维素降解菌的初筛
在培养基上,分别挑取单个不同形态的菌在平板上划线纯化,直到平板上只有单菌落生长为止。
将刚果红平板打孔,孔径为0.5 cm,对单个纯化后的菌落进行稀释。用移液枪将其转移到刚果红平板的孔中,单个菌落重复3次,在37 ℃下培养24 h后用游标卡尺测量刚果红平板上透明圈的直径,选取透明圈直径(除去打孔孔径)(D)与菌落直径(d)比值(D/d值)较大的菌株进行复筛。
挑取D/d值较大的菌落培养,在平板上反复划线纯化并培养4~5代后,将纯化培养后的菌种加甘油于-80 ℃保存备用。
1.4 产酶特性研究
1.4.1 发酵液的制备
取纯化培养好的各平板菌种接种于种子培养基,于37 ℃、220 r/min恒温摇床振荡培养14~16 h。取液体菌种,按1%的接种量分别接种于以3种底物(CMC-Na、微晶纤维素、D-水杨苷)为碳源的发酵培养基和滤纸培养基中,于37 ℃、180 r/min恒温摇床振荡培养24 h,在8 000 r/min条件下离心5 min,去除菌体,取上清液,得粗酶液[14]。
1.4.2 标准曲线的绘制
分别吸取不同浓度(0、1.0、1.5、2.0、2.5、3.0、3.5 mg/mL)的葡萄糖标准溶液0.5 mL、缓冲溶液1.5 mL和DNS试剂3 mL于各标准管(每样做3个平行)中,混匀。将标准管同时置于沸水浴中,反应10 min。取出,迅速冷却至室温,用纯水定容至25 mL,盖塞,混匀。用10 mm比色杯,在分光光度计波长540 nm处测量吸光度(OD)值。以葡萄糖量为横坐标,以OD值为纵坐标,绘制标准曲线,获得线性回归方程。线性回归系数在0.999 0以上时方可使用。
1.4.3 纤维素酶活性的测定
内切葡聚糖酶(Cen)、外切葡聚糖酶(Cex)、β-葡萄糖苷酶(BG)和滤纸酶(FPA)活性的测定按李日强等[15]的方法进行。分别吸取各菌株粗酶液、缓冲溶液和DNS试剂于各标准管(每样做3个平行)中,混匀。将标准管同时置于沸水浴中,反应10 min。取出,迅速冷却至室温,用纯水定容至25 mL,盖塞,混匀。用10 mm比色杯,在分光光度计波长540 nm处测量OD值,以灭活后的粗酶液作为空白对照。以(50.0±0.1) ℃、pH为6.0时1 min水解纤维素底物产生出相当于1 μmol葡萄糖的还原糖量为1个酶活性单位,以U/mL表示。
1.4.4 培养条件对菌株产酶能力的影响
1.4.4.1 培养时间对菌株产酶能力的影响
将筛选出的菌株按1%接种量接种于种子培养基,于37 ℃、220 r/min恒温摇床振荡培养14~16 h后,得菌株种子液。取100 μL菌株种子液接入20 mL发酵培养基(pH为7.0)中,于37 ℃、185 r/min恒温摇床振荡发酵培养6、12、24、36、48、60、72 h,测定其OD600 nm值和FPA活性。
1.4.4.2 pH对菌株产酶能力的影响
将发酵培养基pH分别调至3、4、5、6、7、8、9和10,取菌株种子液100 μL接入20 mL发酵培养基中,于37 ℃、185 r/min恒温摇床振荡发酵培养24 h,测定其OD600 nm值和FPA活性。
1.4.4.3 温度对菌株产酶能力的影响
取菌株种子液100 μL接入20 mL发酵培养基(pH为7.0)中,分别于30、37、43、50、57、65 ℃,185 r/min恒温摇床振荡发酵培养24 h,测定其OD600 nm值和FPA活性。
1.5 产纤维素酶菌株的种属鉴定
1.5.1 生理生化鉴定
取菌液于普通琼脂培养基上划线培养,37 ℃下培养24 h观察菌落形态;采用革兰氏染色、芽孢染色和荚膜染色法,显微镜下观察菌株形态;参考《常见细菌系统鉴定手册》[16]和《伯杰氏细菌鉴定手册》[17]进行生化试验,挑取纯化培养的单菌落分别接种于生化管中,根据颜色的变化,判定试验结果。
1.5.2 分子生物学鉴定
使用细菌DNA抽提试剂盒提取细菌DNA,采用16S rDNA通用引物16sRp1(5′-AGAGTTTGATCATGGCTCAG-3′)和16sRp2(5′-GTGTGACGGGCGGTGTGTAC-3′),预计扩增长度1 380 bp,PCR反应体系(25 μL)为:上、下游引物(10 μmol/L)各0.5 μL,细菌基因组(208 ng/μL)3 μL,2×Taq PCR Master Mix 12.5 μL,ddH2O 8.5 μL。反应条件为:94 ℃ 5 min,94 ℃ 30 s,57 ℃ 30 s,72 ℃ 2 min,35个循环,72 ℃ 10 min。PCR产物送至生工生物工程(上海)股份有限公司测序,在NCBI数据库中进行BLAST比对。
1.6 数据处理与分析
利用 Excel 2010对试验数据进行初步整理,采用SPSS 23.0和GraphPad Prism 7软件对试验数据进行统计分析和图表绘制。
2 结果与分析
2.1 产纤维素酶菌株的筛选
采用LB、MRS、TSA、普通营养、麦康凯、CMC-Na、PDA和鲜血琼脂平板分离获得10株菌,依此命名为GL1~10。通过刚果红培养基上产生透明圈的大小,筛选能降解纤维素的菌株,如图1所示,GL-4、GL-5、GL-6和GL-8具有一定的产纤维素酶活性,其中GL-4的透明圈最大,直径为23.54 mm;GL-6的透明圈最小,直径为12.49 mm。
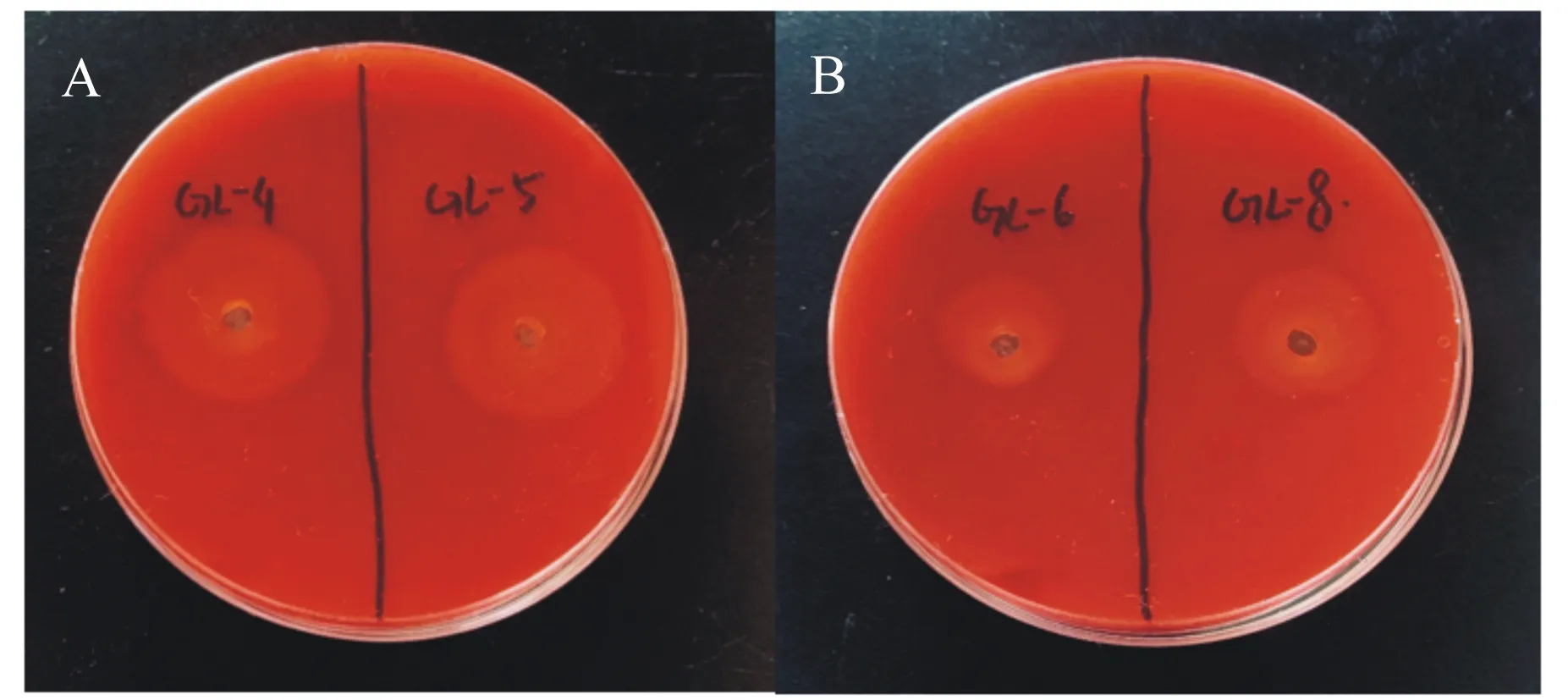
图1 刚果红培养基上形成的透明圈
通过测量透明圈直径和菌落直径,计算得出D/d值,详见表1。由表中数据可知GL-4的D/d值最大,为3.45±0.05;GL-6的D/d值最小,为1.85±0.06。
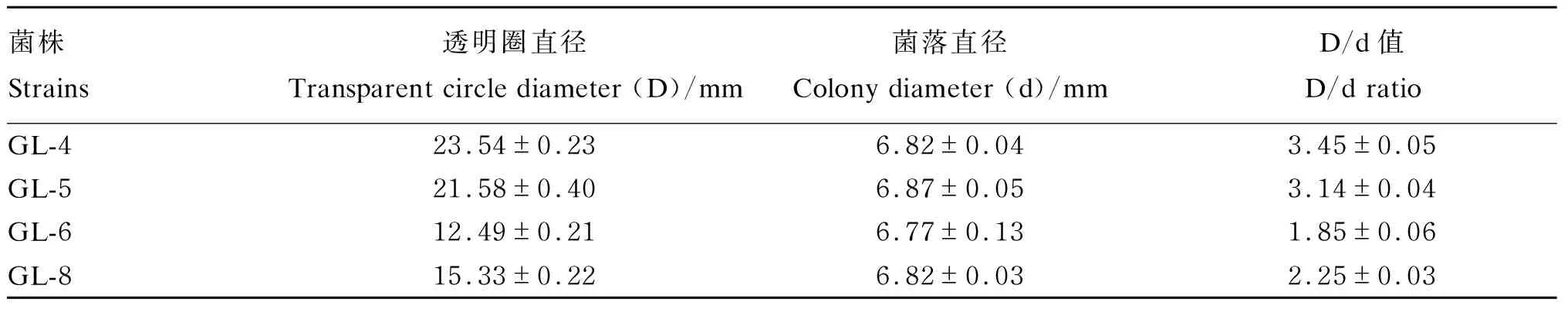
表1 D/d值结果
2.2 纤维素酶活性
在筛选出的4株纤维素降解菌GL-4、GL-5、GL-6和GL-8中,GL-4的Cen和FPA活性最高,分别为49.32和25.13 U/mL;GL-8的Cex活性最高,为30.59 U/mL;GL-5的BG活性最高,为35.08 U/mL(图2)。
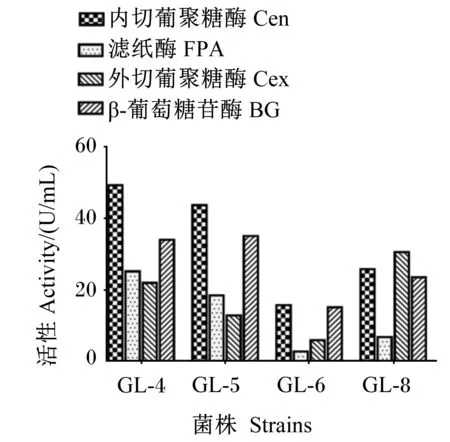
图2 纤维素酶活性测定结果
2.3 培养条件对菌株产酶能力的影响
选择产CMC和FPA活性最高的菌株GL-4进行最佳培养条件筛选。
温度对产酶能力的影响见图3-a。GL-4的生长性能(OD600 nm)和产酶能力(FPA活性)在30~37 ℃时随温度升高而升高,在37~57 ℃时随温度升高而急剧降低,在57 ℃时菌株不再生长和产酶。上述结果说明菌株GL-4产纤维素酶的最适温度为37 ℃。
培养时间对产酶能力的影响见图3-b。对于GL-4,0~6 h是生长调整期,6~36 h是对数生长期,36~48 h是稳定期,48 h后进入衰亡期。发酵时间在0~24 h时,GL-4的产酶能力随发酵时间的延长而升高,并在24 h时达到顶峰,之后产酶能力随发酵时间的延长逐步降低,所以菌株GL-4的最佳培养时间为24 h。培养时间在0~24 h时,生长曲线与FPA活性活性曲线的变化呈正相关,培养24 h之后,2个曲线的变化没有明显的相关性。

图3 不同培养条件对菌株生长和产酶能力的影响
pH对产酶能力的影响见图3-c。当发酵培养基的pH为3~4时,GL-4的生长性能和产酶能力随着pH的升高而升高;在pH为4~6时,随pH的升高稍微有所降低;之后又随着pH的升高而升高,在pH为8时达到峰值;当pH达到9时,菌株失活而无法产生纤维素酶。结果显示,菌株GL-4在弱碱性的环境下能很好的生长和产酶,其产纤维素酶的最适pH为8。
2.4 产纤维素酶菌株的鉴定
选择D/d值较大,且产纤维素酶活性较高的菌株GL-4、GL-5和GL-8进行鉴定。
2.4.1 形态学鉴定
3株菌在普通琼脂培养基平板上的形态学鉴定结果(表2)显示,GL-4和GL-8菌落形态相似,呈边缘整齐、表面光滑凸起的圆形菌落;镜检结果(表2、图4)显示,3株菌均为革兰氏阳性短杆菌。

表2 菌株的形态结构

图4 GL-4的显微形态
2.4.2 生化鉴定
生化鉴定结果见表3。3株菌的生化试验结果大致相似,均能利用明胶、葡萄糖、蔗糖、淀粉和过氧化氢,分解糖类产生乙酰基甲醇,不能利用木糖、阿拉伯糖、吲哚、硝酸盐和枸橼酸盐,不能分解糖类产酸。另外,3株菌中仅GL-8可利用甘露醇。生化试验结果符合芽孢杆菌的生化特性,初步确定3株菌均为枯草芽孢杆菌。
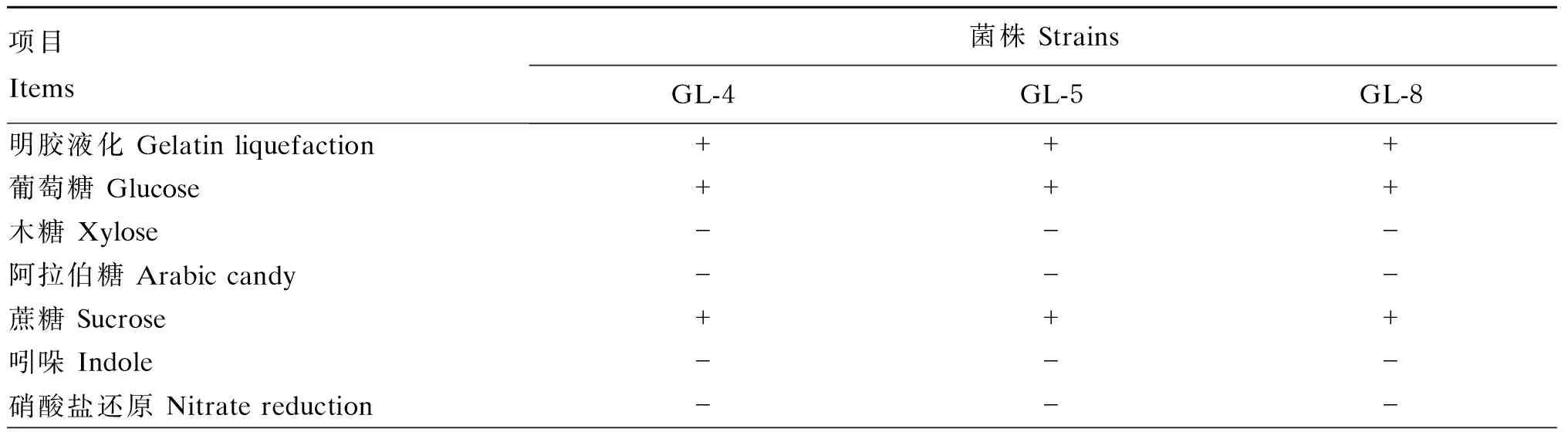
表3 生化鉴定结果
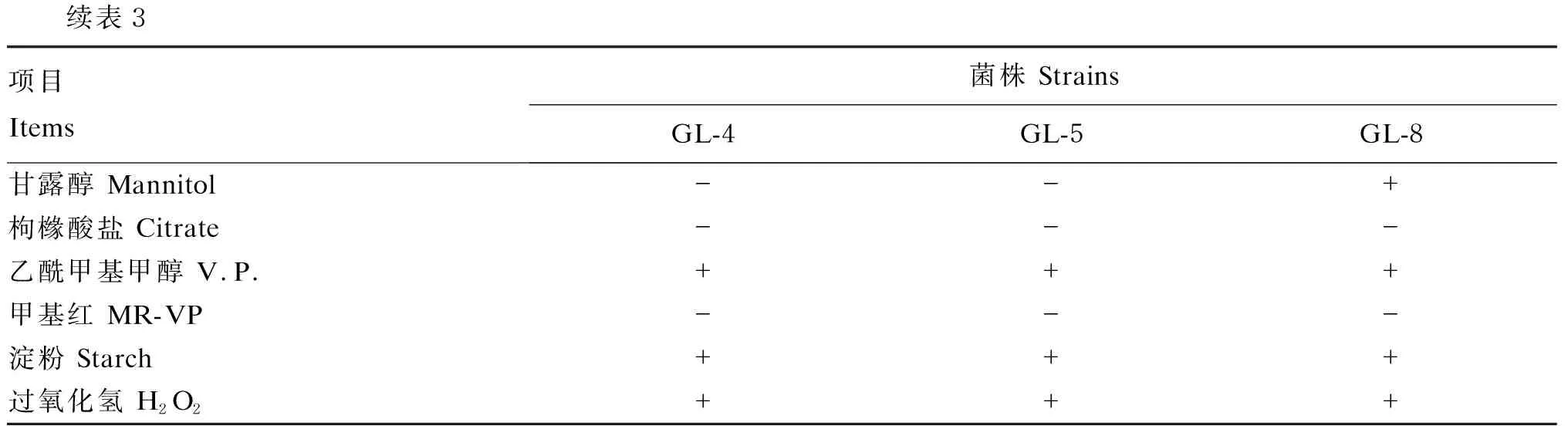
续表3项目 Items菌株 StrainsGL-4GL-5GL-8甘露醇 Mannitol--+枸橼酸盐 Citrate---乙酰甲基甲醇 V.P. +++甲基红 MR-VP---淀粉 Starch+++过氧化氢 H2O2+++
2.4.3 16S rDNA鉴定
采用PCR方法扩增菌株GL-4、GL-5和GL-8的16S rDNA序列,将克隆测序后序列进行BLAST比对,并用MEGA 7.0软件构建16S rDNA的系统进化树。BLAST比对结果显示,GL-4、GL-5和GL-8的16S rDNA基因与枯草芽孢杆菌的基因序列一致性均大于98%。使用MEGA 7.0软件进行遗传进化分析,结果显示,GL-4、GL-5和GL-8分别位于3个不同的枯草芽孢杆菌分支(图5),表明这3株菌均为枯草芽孢杆菌,与生理生化鉴定结果一致。

Bacillus sp.:芽孢杆菌属;Bacteria:细菌;Uncultured Bacillus sp. clone RB-77:不可培养芽孢杆菌克隆 RB-77;Bacillus subtilis:枯草芽孢杆菌;Bacillus subtilis subsp.:枯草芽孢杆菌亚种;Bacillus cereus:蜡样芽孢杆菌;Bacillus tequilensis:特基拉芽孢杆菌;Bacillus licheniformis:地衣芽孢杆菌;Bacillus pumilus:短小芽孢杆菌;Bacillus anthracis:炭疽芽孢杆菌;strain:菌株。
3 讨 论
3.1 纤维素降解菌的分离筛选
刚果红染色法是用于纤维素降解菌初筛的经典方法,Ghezelbash等[18]采用的传统刚果红染色法是先在平板上培养细菌,再用刚果红进行染色,这个方法在用氯化钠进行清洗的过程中容易产生菌落脱落现象,造成菌落之间发生混杂,导致无法获得准确结果,且该方法操作繁琐,不利于细菌的大量筛选。本研究对该方法进行了部分改进,在制备平板时即加入刚果红,并在平板上进行打孔,然后将菌落稀释后加入孔内,继续培养24 h即可测量透明圈直径。整个过程不需要对平板进行清洗,克服了传统方法的不足,试验结果更加准确,且操作简便。本研究通过改进的刚果红染色法从竹鼠肠道内容物中初步筛选获得4株纤维素降解菌,通过测定纤维素酶活性,最终获得3株产纤维素酶活性较强的菌株GL-4、GL-5和GL-8,经鉴定均为枯草芽孢杆菌。GL-4的纤维素酶总活性高于宁俊平[12]和曹晓燕[13]在竹鼠肠道内分离出的酪酸梭状芽孢杆菌、沙雷氏菌、肺炎克伯雷氏菌等厌氧菌,其中最高的Cen活性为0.502 9 U/mL;也高于沈琦等[19]和樊程等[8]分别在猪和大熊猫的粪便中分离的解淀粉芽胞杆菌,前者Cen活性为7.64 U/mL,后者FPA活性为0.228 3 U/mL。
3.2 纤维素酶活性测定
纤维素酶降解纤维素的过程被认为是3种酶协同作用的结果,有观点认为,纤维素酶发挥作用首先由Cen在纤维素分子内部的无定形区进行酶切产生新的末端,然后由Cex以纤维二糖为单位从末端进行水解,每次切下1个纤维二糖分子,最后由BG将纤维二糖以及短链的纤维寡糖水解为葡萄糖。纤维素酶的3种组分作用的底物不同,Cen的水解底物包括羧甲基纤维素和磷酸溶胀纤维素等无定形纤维素;Cex的水解底物包括棉纤维和微晶纤维素等结晶度较高的纤维素;BG的水解底物是纤维寡糖和纤维二糖[20]。本试验对初筛菌株的3种纤维素酶和总酶(FPA)的活性均进行了测定,能全面评估菌株的纤维素降解能力,结果显示GL-4的FPA和Cen活性最高,说明该菌株对于多种成分的纤维素底物和无定形纤维素底物有较强的降解解能力;GL-8的Cex活性最高,说明该菌株对葡聚糖和纤维二糖有较强的降解解能力;GL-5的BG活性最高,说明该菌株对纤维寡糖和纤维二糖的降解能力较强。因此,在后续的应用研究中,可根据不同的发酵原料,选择其中的1个或多个菌株混合使用,达到最佳的纤维素降解效果。
根据本试验中纤维素酶活性测定结果可知,不同菌株所产纤维素酶活性存在差异,同一株菌所产纤维素酶活性在不同碳源存在时也存在差异,本研究获得的菌株GL-4是目前竹鼠源分离菌中产纤维素酶活性最强的细菌,对常见的4种纤维素底物均有较好的降解能力。
3.3 不同培养条件对菌株产酶能力的影响
纤维素降解菌的产酶能力受到培养条件的影响,培养基的pH和培养温度的改变均影响菌株的生长,从而间接影响产酶能力,在强酸强碱和高温条件下,菌株无法生长及产酶。根据本研究结果,培养时间在0~24 h时,菌株GL-4的生长与产酶能力呈正相关,即随着菌量的增加,产酶量也随之增加,并且在培养24 h时达到最高,24 h后,菌株依然处于对数生长期,但产酶能力却不再升高,直到48 h后,两者又重新呈正相关。出现这种现象的可能原因如下:1)GL-4的生长曲线与殷晓敏等[21]的研究大致相同,但其对数生长期持续时间较长,达30 h,在24 h后随着菌株生长代谢的增强,培养基中的营养物质不断被消耗,菌株死亡率上升,产酶量下降;2)GL-4对温度的变化较敏感,除37 ℃培养外,在其他温度培养24 h后,其产酶能力均不高,在细菌发酵培养过程中的温度升高可能也会导致纤维素酶活性的降低,这与菌株的热稳定性有关[22];3)GL-4在pH为4~8时,其所产纤维素酶活性一直保持较高状态,但当培养基pH离开这个区间后,纤维素酶活性急剧下降,根据刘阳等[23]的研究,枯草芽孢杆菌在发酵时会产生乳酸,从发酵开始分泌直至48 h到达峰值,乳酸的生成导致培养基的pH发生改变,从而使纤维素酶活性发生改变。本研究中,GL-4在培养基pH为4~8时,纤维素酶活性均较高,这与Irfan等[24]的研究结果一致,说明芽孢杆菌的产酶能力在一定pH范围内保持稳定。本试验中GL-4的最适pH为8,与崔海洋等[25]的研究结果一致。
本研究仅改变单一条件来分析培养条件对GL-4产酶能力的影响,未考虑各培养条件间相互影响的情况,有一定的局限性。柴秀娟等[26]采用响应曲面回归分析法对菌株进行产酶条件优化,优化效果明显。响应曲面回归分析法是一种通过对影响过程的因子及其交互作用进行评价来优化过程的有效方法[27],可以弥补传统单因素变量优化试验的不足。下一步,我们将使用响应曲面法进一步优化产酶条件,使分离菌株更好的在饲料发酵中发挥作用。
4 结 论
① 本试验从竹鼠肠道内容物中获得了3株纤维素降解菌——GL-4、GL-5和GL-8,经形态特征、生化特性和分子生物学鉴定,确定均为枯草芽孢杆菌。
② 3株纤维素降解菌所产纤维素酶的活性有一定差异,GL-4的D/d值最大,为3.45±0.05,其Cen和FPA活性最高,分别为49.32和25.13 U/mL;GL-8的Cex活性最高,为30.59 U/mL;GL-5的BG活性最高,为35.08 U/mL。
③ 对GL-4进行培养条件优化,该菌株具有培养pH范围广和耐高温的特点,在培养基pH为3~8、温度为50 ℃时仍具有产酶能力。该菌株产酶的最适条件为发酵时间24 h、发酵培养基pH 8和发酵温度37 ℃,是一株可用作粗纤维饲料添加剂的优良候选菌株。
