奶牛乳腺退化及其营养调控研究进展
2021-08-09黄国灏陈俊材董国忠
黄国灏 陈俊材,2,3* 董国忠,3
(1.西南大学动物科学技术学院,重庆 400715;2.西南大学生物饲料与分子营养实验室,重庆 400715;3.重庆市草食动物资源保护与利用工程技术研究中心,重庆 400715)
奶牛通常在分娩前大约60 d进行干奶,这2个月左右的非泌乳期被称作干奶期。干奶期可使奶牛乳腺在长期泌乳后进行修复和更新,为下一个泌乳周期做好准备。奶牛干奶期的第1阶段,也是最重要的阶段之一是乳腺的退化。奶牛乳腺退化是指乳腺腺体由泌乳状态恢复到非泌乳状态的过程。乳腺退化可以分为3种类型:渐进性退化、衰老性退化和主动性退化。渐进性退化是指正常泌乳过程中泌乳功能的倒退,衰老性退化发生在泌乳动物生命的末期,而主动性退化是指在停止挤奶后乳腺中发生退化的过程[1]。奶牛乳腺在干奶后发生的退化属于典型的主动性退化[2]。长久以来,奶牛乳腺的相关研究主要集中于泌乳期,而对干奶期奶牛乳腺的研究相对较少。近几年,越来越多的学者开始关注于奶牛干奶期乳腺退化的调控,这主要是因为促进奶牛干奶期乳腺的退化一方面可以提高干奶初期乳腺对细菌感染的抵抗力,另一方面可能提高短干奶期(30 d左右)奶牛在下一个泌乳周期的泌乳量。本文旨在对奶牛乳腺退化的相关机制和乳腺退化营养调控最新研究进展进行综述,以期为现代高产奶牛健康养殖提供新的思路,为未来进一步研究奶牛乳腺退化提供参考。
1 奶牛乳腺退化概述
奶牛乳腺退化是一个涉及到细胞和组织形态学变化的复杂过程。在奶牛停止挤奶后的24 h内,乳腺上皮细胞内囊泡和脂滴开始累积,细胞器发生退化,如内质网开始缩小,高尔基体变的不可辨认,乳汁的合成和分泌能力显著降低,不过部分细胞依然保持着分泌乳铁蛋白的能力[3]。随着乳汁的累积,乳腺内相关促凋亡因子[如转化生长因子-β(TGF-β)]的浓度和乳腺上皮细胞所承受的物理张力开始上升,启动乳腺上皮细胞的凋亡过程[4]。细胞凋亡率在干奶后72 h左右达到最大值,凋亡的细胞和乳腺内残留的乳汁主要由巨噬细胞和部分乳腺上皮细胞通过吞噬作用,在溶酶体中进行分解[5]。随后细胞增殖率逐渐上升,并且在干奶后期达到最大值,完成乳腺组织的更新。在整个乳腺退化期间,奶牛乳腺上皮细胞的总数变化不大,因此又被称为“再生退化”[2]。奶牛乳腺退化的另一个特征是乳腺细胞间通透性增加,所以乳腺分泌物中血液来源成分[如牛血清白蛋白(bovine serum albumin,BSA)]的浓度升高[6]。综上所述,乳腺退化初期主要以乳腺上皮细胞乳成分合成能力下降、细胞凋亡增加、细胞间通透性增加为主要特征。
奶牛在干奶后的1周内,乳腺的上皮组织和基质组织的比例出现显著变化。尽管其小叶腺泡结构在退化期间基本保持完整,但是管腔部分开始萎缩、间质部分所占比例升高。在干奶开始后21 d左右,大部分乳腺上皮细胞进入非分泌状态[7]。奶牛的乳腺组织退化后不会恢复到妊娠之前的状态,因为奶牛的干奶期通常处于妊娠末期,促进乳腺发育及泌乳的激素和信号抑制了乳腺的完全退化。Murney等[8]选择泌乳中期的放牧奶牛模拟奶牛泌乳末期的干奶过程,发现在干奶7 d后重新恢复挤奶,奶牛的产奶量几乎不受影响;但是在干奶14或21 d后重新恢复挤奶,奶牛的产奶量不能恢复到干奶之前。因此,奶牛的乳腺退化具有条件性可逆的特点。
奶牛的乳腺退化和更新十分重要,若乳腺退化和更新受到影响,下一个泌乳周期的产奶性能就会受到影响。Van Knegsel等[9]研究发现,与传统60 d干奶期奶牛相比,缩短干奶期至30 d会抑制奶牛乳腺退化和更新,导致下一泌乳周期泌乳量显著降低。这可能有2个方面的原因:一是干奶时的产奶量更低,乳腺内积累的乳汁对乳腺细胞造成的物理张力更低;二是干奶时间更接近分娩,乳腺受到妊娠末期激素的影响更大[10]。Annen等[11]发现未进行干奶的奶牛不能够有效的对乳腺衰老细胞进行更新和修复,在下一个泌乳周期中,乳腺组织中会含有大量休眠的乳腺腺泡,产奶量显著下降。
2 奶牛乳腺退化标志物
在奶牛乳腺退化的研究中,如何衡量奶牛乳腺退化程度是研究的关键点之一。常用的乳腺退化标志物也和乳腺退化的主要特征密切相关。在干奶前,乳汁中含有大量的乳脂、酪蛋白、α-乳清蛋白、β-乳球蛋白和很少量的乳铁蛋白,随着乳腺终末导管网络的解体,乳腺上皮细胞合成乳糖、乳脂、酪蛋白、α-乳清蛋白和β-乳球蛋白的能力下降,乳腺分泌物中的乳铁蛋白浓度显著升高[1,12]。此外,柠檬酸盐浓度在泌乳期间相对较高,在干奶后的2周内大幅降低[6,13],柠檬酸盐浓度的变化能够反映乳腺上皮细胞的活动水平。因此,乳腺分泌物中乳铁蛋白和柠檬酸盐的浓度可以用来较好地衡量奶牛乳腺退化程度[13]。
研究发现,在干奶后3 d内,乳腺分泌物中的白细胞数量快速升高,随后巨噬细胞浸润增加,二者主要功能是清除乳腺中酪蛋白胶粒、乳脂滴和细胞碎片等[3,13]。同时,乳腺上皮细胞凋亡率上升,更多的乳腺上皮细胞凋亡脱落。所以乳腺退化最常用的标记物之一就是乳腺分泌物中的体细胞数(somatic cell count,SCC),SCC的升高至少持续到干奶后10~14 d[13-14]。但是与泌乳期不同,干奶期SCC的升高主要是由于乳腺退化造成的,并不一定意味着乳腺炎的发生。
在泌乳期间,乳腺紧密连接在乳汁和间质液之间,形成高度不渗透的屏障,乳腺上皮可以维持其离子梯度。在干奶后,乳腺紧密连接通透性增加,导致乳铁蛋白、血清蛋白和免疫球蛋白等血源性蛋白进入管腔,其在乳腺分泌物中的浓度迅速增加[15]。间质液中高浓度的钠离子(Na+)和氯离子(Cl-)也随着紧密连接通透性的增加而进入乳腺分泌物中,同时乳腺分泌物中的钾离子(K+)浓度降低[16]。通过分析乳腺分泌物中的乳铁蛋白、血清蛋白浓度和Na+/K+比值都可以很好地反映奶牛乳腺的退化程度。
除此之外,基质金属蛋白酶(matrix metalloproteinases,MMP)主要负责降解胞外基质和基膜[17],其活性在乳腺退化过程中显著升高,多篇研究也通过检测乳腺分泌物中的MMP活性来反映乳腺的退化程度[6,18]。
3 奶牛乳腺退化机理
奶牛的乳腺退化是一个多阶段多因素的复杂生理过程,涉及到多条不同的信号通路及其之间的相互作用,目前有研究表明转化生长因子-β1(TGF-β1)/Smad和酪氨酸激酶(JAK)/信号传导与转录激活因子3(STAT3)2条信号通路在乳腺退化中扮演着重要角色(图1)。
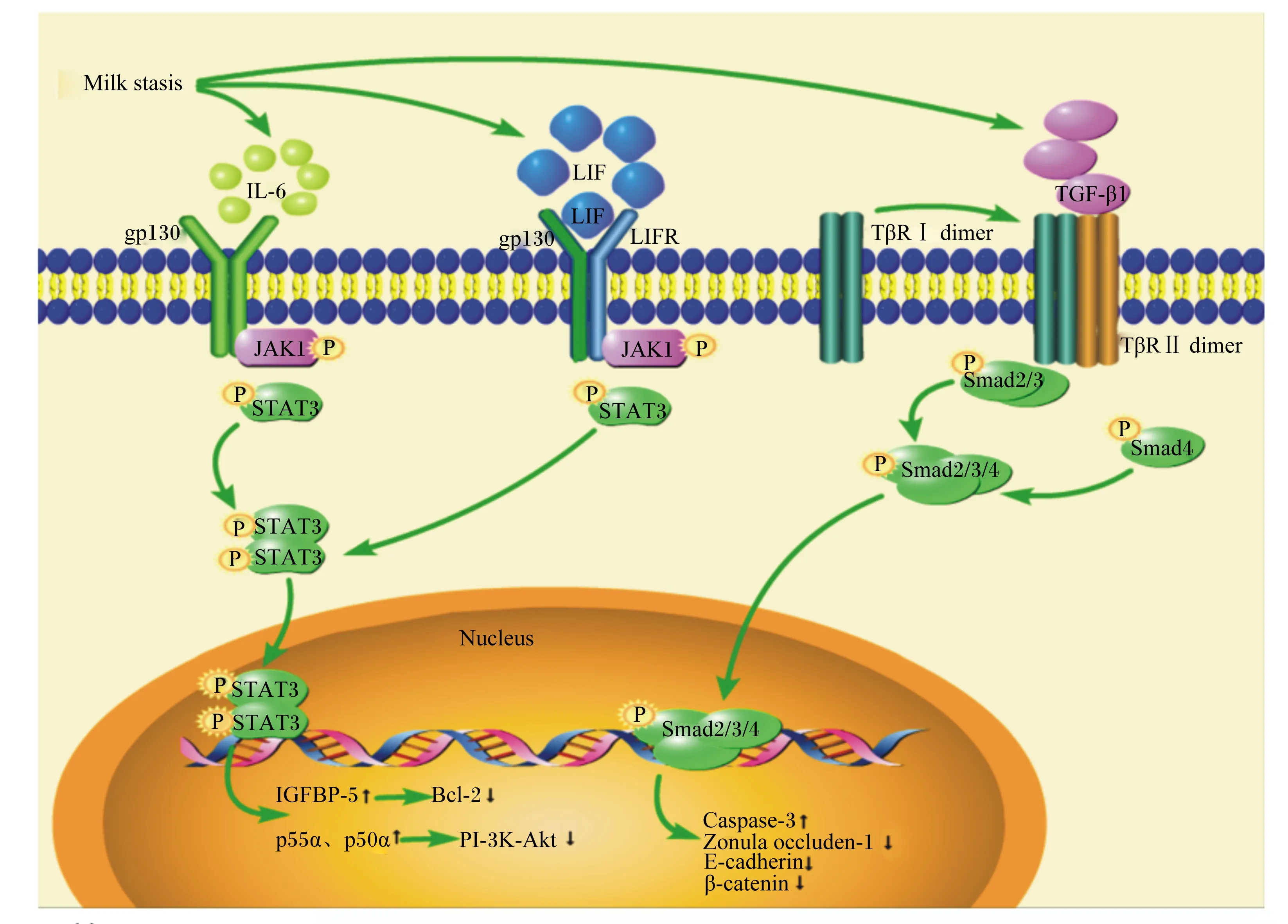
Milk stasis:乳汁淤积;IL-6:白细胞介素-6 interleukin-6;LIF:白血病抑制因子 leukemia inhibitory factor;gp130:IL-6家族细胞因子受体共同的信号传导亚单位 common signal transduction subunit of IL-6 family cytokine receptor;LIFR:白血病抑制因子受体 leukemia inhibitory factor receptor;TGF-β1:转化生长因子-β1 transforming growth factor-β1;TβRⅠ dimer:TGF-β受体Ⅰ transforming growth factor-β receptor Ⅰ;TβRⅡ dimer:TGF-β受体Ⅱ transforming growth factor-β receptor Ⅱ;JAK1:酪氨酸激酶1 Janus kinase 1;P:磷酸基团 phosphate group;STAT3:信号传导与转录激活因子3 signal transducer and activator of transcription 3;Smad2/3:Smad蛋白2/3复合物 Smad protein 2/3 compound;Smad4:Smad蛋白4 Smad protein 4;Smad2/3/4:Smad蛋白2/3/4复合物 Smad protein 2/3/4 compound;Nucleus:细胞核;Caspase-3:半胱氨酸蛋白酶-3 cysteine aspirate protease-3;Zonula occluden-1:紧密连接蛋白-1;E-cadherin:上皮钙黏蛋白 epithelial cadherin;β-catenin:β-连环蛋白;IGFBP-5:胰岛素样生长因子结合蛋白-5 insulin like growth factor binding protein-5;Bcl-2:B淋巴细胞瘤-2基因 B-cell lymphoma-2;PI-3K-Akt:磷酸肌醇-3激酶-蛋白激酶B phosphatidylin-ositol-3-kinase-protein kinase B;p55α、p50α:磷酸肌醇-3激酶调节亚单位 phosphatidylin-ositol-3-kinase regulatory subunit。↑:表达量增高 expression level increased;↓:表达量降低 expression level decreased。
3.1 TGF-β1/Smad信号通路
TGF-β1诱导的奶牛乳腺上皮细胞凋亡和自噬在牛乳腺退化中发挥关键作用[20]。Mitz等[19]发现TGF-β1通过丝氨酸/苏氨酸激酶受体异四聚体传递信号,该异四聚体由转化生长因子-β受体Ⅰ(transforming growth factor-β receptor Ⅰ,TβRⅠ)和转化生长因子-β受体Ⅱ(transforming growth factor-β receptor Ⅱ,TβRⅡ)组成。TGF-β1配体对TβRⅡ具有较高的亲和力,它们结合后活化TβRⅡ,活化的TβRⅡ募集并结合TβRⅠ,组成四聚体受体复合物。该复合物进而活化下游的R-Smads,包括Smad2和Smad3。这些R-Smads与Co-Smads中的Smad4结合形成复合物,进入细胞核与其他转录元件结合调节基因转录[19]。只有在Ⅰ型和Ⅱ型受体在细胞膜共同表达的情况下,才能使细胞外信号转导至细胞内,进而与相关转录因子发生作用。
Kolek等[21]发现,在牛乳腺上皮细胞中TGF-β1通过激活Smad途径诱导细胞生长停滞和凋亡。Zarzyńska等[22]通过体外培养试验发现,TGF-β1的表达与奶牛乳腺上皮细胞凋亡呈正相关。Heshuang等[23]在TGF-β1处理奶牛乳腺上皮细胞后0.5~2.0 h内,Smad2/3磷酸化水平升高,细胞内游离钙离子(Ca2+)浓度显著升高,半胱氨酸蛋白酶-3(Caspase-3)被激活,DNA被裂解,进而引起细胞凋亡。同样,Zarzyńska等[24]通过比较干奶期和泌乳期乳腺组织,发现干奶期奶牛乳腺组织中的细胞凋亡指标Caspase-3表达量显著升高,TGF-β1和TβRⅡ表达量也显著升高。
目前在啮齿类动物上的研究表明,TGF-β1还可以使乳腺上皮细胞间紧密连接通透性增加,降低上皮细胞的紧密连接蛋白-1(zonula occluden-1,ZO-1)和上皮钙黏蛋白(epithelial cadherin,E-cadherin)的表达量[25-26],引起乳腺上皮细胞凋亡[27-28]。不过,在奶牛乳腺退化过程中,TGF-β1的功能以及其是否通过使紧密连接通透性上升而促进乳腺退化仍有待进一步研究。
3.2 JAK/STAT3信号通路
介导乳腺退化的另一个重要信号通路是JAK/STAT3信号通路。JAK是一类非受体酪氨酸激酶,JAK的底物为信号传导与转录激活因子(signal transducer and activator of transcription,STATs)。STAT3是STATs家族的成员之一,该蛋白通过响应相应的细胞因子和生长因子的磷酸化而被激活。
乳腺内乳汁积累会诱导乳腺内白细胞介素-6(interleukin-6,IL-6)[29]和白血病抑制因子(leukemia inhibitory factor,LIF)[30]浓度上升。IL-6可直接与细胞表面的gp130受体结合形成二聚体,而LIF与白血病抑制因子受体(LIFR)蛋白先结合形成二聚体,然后再与gp130受体结合形成三聚体[14,31]。形成的二聚体和三聚体激活并磷酸化JAK,这些磷酸化的位点成为带有SH2功能域(src homology 2,SH2)结构的STAT蛋白和接头蛋白的结合位置。STAT3在C末端附近有由JAK磷酸化的保守酪氨酸残基。该磷酸酪氨酸通过与保守的SH2结构相互作用导致STAT3的二聚化。磷酸化的STAT3二聚物通过依赖核蛋白相互作用蛋白进入细胞核[32]。
在细胞核中,二聚化的STAT3结合特定的序列调节靶基因的转录[33],调控分化的乳腺上皮细胞凋亡和乳腺组织更新[14,34]。Abell等[35]研究发现,该通路可通过诱导磷酸肌醇-3激酶(phosphatidylin-ositol-3-kinase,PI-3K)调节亚基p55α和p50α的表达量升高,进而降低PI-3K-蛋白激酶B(protein kinase B,Akt)介导的生存信号,从而调节细胞凋亡。JAK/STAT3信号通路的激活还会引起乳腺组织中胰岛素样生长因子结合蛋白-5(insulin like growth factor binding protein-5,IGFBP-5)的表达量升高。IGFBP-5表达量的升高引起抗凋亡蛋白B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)表达量下降,促进细胞凋亡。
4 奶牛乳腺退化的营养调控
近年来,越来越多的研究尝试促进干奶期奶牛乳腺的退化。现代高产奶牛在干奶时通常有超过20 kg/d的产奶量,在停止挤奶后乳汁容易渗出,病原菌更容易侵入乳腺,发生乳腺内感染(intramammary infections,IMI)[36]。Gott等[37]报道,初产奶牛在干奶时发生IMI的概率为19.3%,经产奶牛在干奶时发生IMI的概率为7.7%。但乳腺退化完成后,乳腺抵抗IMI的能力会快速上升[3]。此外,一些发达国家尝试将传统的60 d干奶期缩短至30 d以改善高产奶牛的健康状况,延长生产寿命,节约饲养成本,提高生产效益[38-40]。但是缩短干奶期会抑制干奶初期乳腺退化,降低奶牛在下一个泌乳周期产奶量,阻碍其推广和应用。所以降低干奶时的泌乳量和促进干奶初期乳腺退化对于降低干奶期IMI及短干奶期的应用推广都有积极的意义。
4.1 营养限制
在干奶前期降低奶牛营养水平可促进乳腺退化,降低产奶量。Ollier等[41]对干奶前5 d的奶牛只饲喂干草,发现其产奶量和BSA浓度降低,乳腺分泌物中Na+/K+比值升高,柠檬酸盐和乳铁蛋白的浓度降低,说明营养限制加速了乳腺退化。Wang等[42]通过饲喂泌乳中期奶牛稻草或者苜蓿,发现饲喂稻草降低了闭合蛋白的表达量,同时增加了细胞凋亡相关基因的表达量,增加了牛奶中的Na+/K+比值、BSA浓度和血纤维蛋白溶酶活性,以上结果表明营养限制增加了奶牛乳腺紧密连接的通透性,增加了乳腺上皮细胞凋亡率。不过,干奶期降低营养供给虽然能够降低产奶量、促进乳腺退化,但会导致能量负平衡的发生。Ollier等[41]和Odensten等[43]发现,与对照组相比,干奶前5 d饲喂稻草显著提高了奶牛血液中的游离脂肪酸(free fatty acids,FFA)和β-羟丁酸浓度,降低了血液中胰岛素和葡萄糖浓度。FFA浓度过高会抑制外周血单核细胞的增殖和抗炎因子白细胞介素-4(interleukin-4,IL-4)的分泌[44-45],引起免疫抑制。Olller等[46]通过细菌试验测试奶牛干奶前5 d饲喂干草是否影响乳腺内感染的敏感性,并没有发现干草组和对照组在细菌计数和感染率有所差异。所以在干奶期通过营养限制促进乳腺退化所产生的正面效应可能会因为能量负平衡的发生而消失。
4.2 乳腺局部营养调控
多项研究表明,在奶牛干奶时,可直接向奶牛乳腺中灌注促乳腺退化物质,调控乳腺局部营养供给,加速奶牛乳腺的退化[3, 47]。酪蛋白水解物(casein hydrolysate,CNH)是酪蛋白在特异性内切酶及其他类似的条件下被水解后具有生物活性的酪蛋白生物活性肽以及小分子肽和游离氨基酸[48]。Ponchon等[18]将CNH注入奶牛乳腺发现,奶牛产奶量下降,乳中Na+和BSA的浓度增加,K+和乳糖的浓度降低,表明乳腺灌注CNH可以增加乳腺紧密连接通透性,加速乳腺退化。CNH促进奶牛乳腺退化的机理可能是因为CNH中含有右磷丝氨酸残基,可阻断位于奶牛乳腺上皮细胞中K+通道或者降低细胞外的Ca2+浓度[16],改变上皮细胞紧密连接的通透性,影响乳腺上皮细胞的分泌活性[49]。
乳糖是牛奶中主要的渗透分子,可维持牛奶的渗透压及内环境的稳定。Chedly等[50]发现,将乳糖溶液通过乳腺导管注入乳腺,发现乳中Na+/K+比值和BSA浓度增加。用120 mmo/L乳糖溶液处理乳腺上皮细胞,跨上皮电阻降低,说明乳糖使乳腺上皮细胞间紧密连接通透性增大,推测可能与乳糖的Ca2+螯合作用有关,造成紧密连接蛋白表达降低,影响紧密连接通透性。
5-羟色胺(5-hydroxytryptamine,5-HT)是色氨酸羟化后脱羧形成的一种抑制性神经递质,广泛存在于哺乳动物组织中。乳腺内的5-HT被认为具有调节乳腺动态平衡和加速乳腺退化过程的作用[51-54]。Hernandez等[55]利用选择性5-HT再摄取抑制剂(selective serotonin reuptake inhibitor,SSRI)提高乳腺内5-HT浓度,增加了乳腺紧密连接通透性,抑制了乳蛋白基因的表达,提高了细胞凋亡相关基因的表达,降低了产奶量,表明5-HT能够加速乳腺退化[56]。
壳聚糖是一种从甲壳素中提取的天然多糖,在自然界储量仅次于纤维素,为第二大天然高分子多糖[57]。Lanctot等[58]通过奶牛乳腺导管灌注壳聚糖水凝胶,发现与对照组相比乳腺分泌物中SCC、BSA和乳铁蛋白浓度以及乳酸脱氢酶活性显著升高,表明乳腺灌注壳聚糖水凝胶可以加速乳腺退化,破坏了乳腺内紧密连接的完整性,改变了细胞的分泌状态,从而加速乳腺退化过程。除此之外,Yeh等[59]也报道表明壳聚糖具有改变动物体内组织紧密连接的作用。
4.3 其他营养调控
还有一些其他的营养因素也可调控乳腺上皮细胞的凋亡,具有促进奶牛乳腺退化的潜力。Puvogel等[60]研究发现,奶牛补充大量维生素A降低了围产期血浆中视黄醇浓度,增加初乳中视黄醇浓度,提高了乳腺上皮细胞凋亡率。另外,环甘氨酸脯氨酸二肽(cyclic-glycine-proline,cGP)是胰岛素样生长因子-1(insulin like growth factor-1,IGF-1)的代谢物,通过调节IGF-1的生物利用度,维持IGF-1的正常功能。Singh-Mallah等[61]采用大鼠模型,研究灌服3 mg/kg的cGP对其哺乳期后乳腺生理变化的影响,发现乳腺退化早期灌服cGP可促进乳腺退化,使完整的分泌腺泡能够更早被清除。因此,是否可以通过提高饲粮中维生素A含量或饲粮中添加cGP来促进奶牛干奶初期乳腺的退化值得进一步研究。
5 小 结
乳腺退化是奶牛干奶期的第1阶段,也是其最重要阶段之一。促进奶牛乳腺退化可提高干奶初期乳腺对细菌感染的抵抗力,还可能促进短干奶期奶牛的乳腺更新。在乳腺退化中TGF-β1/Smad和JAK/STAT3 2条信号通路在调控乳腺退化过程中起着关键作用,但其他相关信号通路是否也参与其中仍值得进一步研究。研究表明,营养限制可促进奶牛乳腺退化,降低干奶前产奶量。除此之外,其他的营养调控手段也具有促进奶牛乳腺退化的潜在的可行性,但还需要未来在大规模的动物试验中进行验证。在未来的研究中还可以进一步发掘其他有效的乳腺退化调控方式,并进一步探究乳腺退化调控的相关机制,从而为现代高产奶牛干奶期管理策略的制定提供参考和依据。
