巴氏杀菌、微滤及紫外处理对羊乳中菌落数与活性蛋白的影响
2021-08-09徐姝刘大松李志宾张文锦赵磊周鹏
徐姝,刘大松,李志宾,张文锦,赵磊,周鹏
(食品科学与技术国家重点实验室(江南大学),江苏 无锡,214122)
山羊乳组成较牛乳更接近人乳,同时具有低致敏性和易消化吸收的特点[1-2],市场占比逐年扩大。羊乳除含有蛋白、脂肪、乳糖、矿物质等基本营养组分外,还含有免疫球蛋白(IgG、IgA、IgM)、乳铁蛋白(lactoferrin,Lf)、乳过氧化物酶(lactoperoxidase,LPO)、黄嘌呤氧化酶(xanthine oxidase,XO)等生物活性物质,这些生物活性蛋白和酶通常具有热敏性[3-4]。
在生鲜乳的加工过程中,通常会采用热杀菌处理,如高温短时杀菌(high temperature short time,HTST),以确保产品的微生物安全性,然而这往往会导致乳中生物活性物质的失活。XIONG等[5]研究了不同温度处理牛乳30 min对乳清抗菌组分和抗菌活性的影响,发现在温度≥75 ℃时抗菌组分和活性都显著降低。近年来,非热或低热处理技术在生鲜乳除菌中的应用日益受到关注。微滤(micro filter,MF)是一种基于组分尺寸差异而实现分离的非热加工技术,可用于脱脂乳中细菌和体细胞的选择性去除,同时保持乳的营养和生物活性成分[6]。ELWELL等[7]在50 ℃下采用1.4 μm孔径陶瓷膜MF处理脱脂牛乳,发现菌落总数降低了3.8 lg CFU/mL,高于HTST处理所降低的1.7 lg CFU/mL。WANG等[8]在6 ℃下采用1.4 μm孔径陶瓷膜MF处理脱脂牛乳,发现体细胞数降低了2.8 lg CFU/mL,HTST处理则不能使体细胞数减少。紫外辐射(UV-C)是另一种新兴的非热除菌技术,可诱导嘧啶二聚体的形成,阻断DNA转录和翻译,阻止微生物增殖。UV-C处理在饮用水、蛋液、果蔬、海鲜等食品的除菌中表现出较好的效果[9-10]。关于生鲜乳MF和UV-C处理的前期研究,主要是针对牛乳,且主要集中在乳中微生物和体细胞去除方面,较少关注活性组分的保留。
本实验以莎能奶山羊脱脂乳为原料,分别进行HTST、1.4和0.8 μm孔径 MF、UV-C处理,比较4种不同处理方法对乳中微生物和体细胞去除、活性蛋白和天然乳清蛋白保留及蛋白氧化的影响,并比较了2种不同孔径膜的分离效率。UV-C在乳中的穿透力较弱,本实验采用绕流式UV-C装置,使羊乳在管路中因离心力而产生二次涡流,增强混合程度和杀菌效率。本实验旨在为高活性羊乳及其制品的加工提供参考。
1 材料与方法
1.1 材料与试剂
山羊乳,杭州云泉约牧业有限公司;微生物测试片6406、6416,美国3M PertrifilmTM公司;Amplex Red试剂(AR)、辣根过氧化物酶、5,5′-二硫代双(2-硝基苯甲酸)(5,5′-dithio bis-(2-nitrobenzoic acid),DTNB)、邻甲苯甲醛(2,4-dinitrophenylhydrazone,DNPH)、溶壁微球菌,美国Sigma公司;羊乳IgG、IgA、IgM ELISA试剂盒,美国Alpha Diagnostic公司;羊乳Lf ELISA试剂盒,美国MyBioSource公司。
1.2 主要仪器
GH036T5L/4*紫外灯,德国Heraeus公司;CLARA 20LFCO乳脂分离器,瑞典Alfa Laval公司;GCM-C-03陶瓷膜分离设备,国初(厦门)科技有限公司;1.4和0.8 μm孔径陶瓷膜,法国Tami公司;PT-20C-R 管板式组合式超高温杀菌机,日本Powerpoint International 公司;Waters Alliance e2695高效液相色谱仪,美国Waters公司;C8色谱柱,美国Agilent公司;Multiskan Sky全波长酶标仪、LYNX4000离心机,美国Thermo Fisher 公司;Cytation5 荧光酶标仪,美国 BioTek 仪器有限公司;UV-2700紫外分光光度计,日本Shimadzu公司;SKD-200凯氏定氮仪,上海沛欧分析仪器有限公司;FossomaticTM7 DC体细胞分析仪,丹麦Fossomatic公司。
1.3 实验方法
1.3.1 脱脂羊乳的除菌处理
羊乳经乳脂分离器去除奶油,收集生鲜脱脂羊乳。使用管板式组合式超高温杀菌机进行HTST处理,杀菌条件为72 ℃、15 s;使用 1.4、0.8 μm孔径陶瓷膜进行MF处理,温度50 ℃,跨膜压力差75 kPa,膜通量根据透过液体积、膜面积和处理时间计算;使用绕流式UV-C装置(图1)进行除菌,石英套管外径23 mm,全氟烷氧基管长度6 m、内径1.5 mm,流速150 mL/min,UV-C处理时间16.7 s。
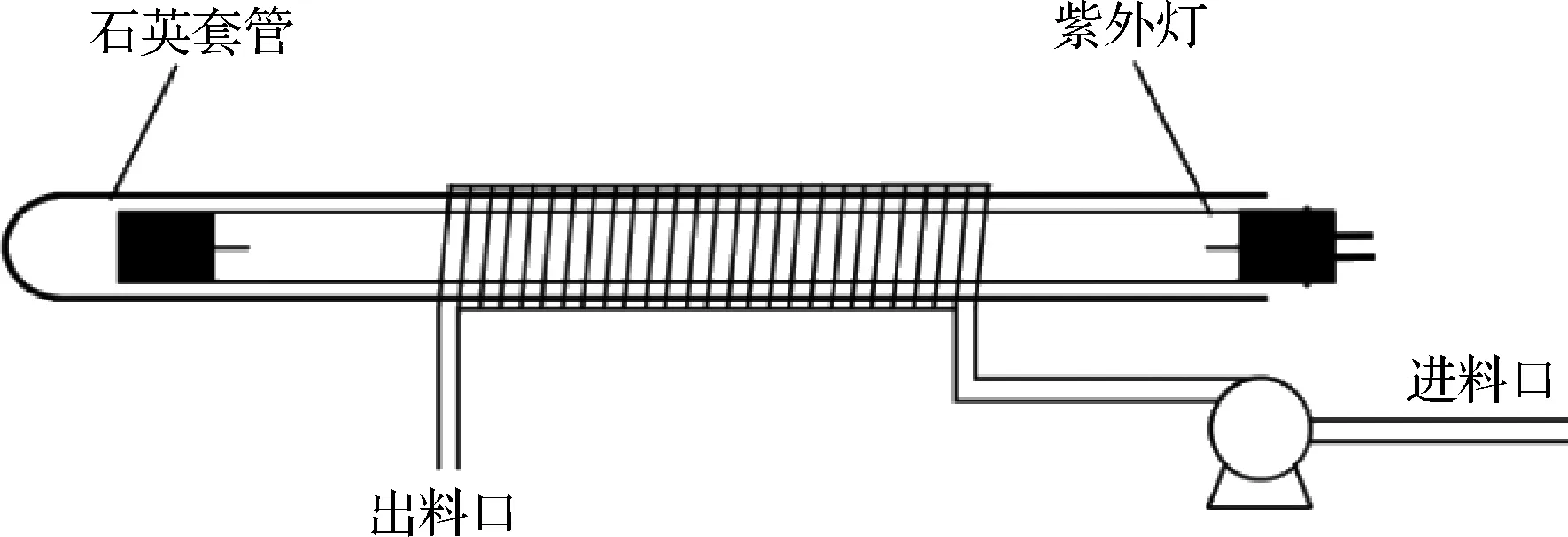
图1 绕流式UV-C装置示意图
1.3.2 微生物和体细胞数的测定
菌落总数、大肠杆菌数测定:取1 mL稀释样,滴加在3M测试片中央,压紧上层薄膜,静置1 min,待培养基凝固后,置于32 ℃培养箱中培养24 h,取菌落数为25~250的测试片计数。
芽孢数测定:参考孔凡丕的方法[11]。取处理后的脱脂羊乳于无菌离心管中,水浴锅内80 ℃保持10 min,冰水浴冷却,稀释后按照菌落总数测定方法进行测定。
体细胞数检测:取处理后的脱脂羊乳,采用体细胞分析仪进行测定。
1.3.3 活性蛋白含量的测定
活性蛋白IgG、IgA、IgM、Lf含量的测定:根据ELISA试剂盒所提供的方法进行测定,采用稀释2 000~5 000倍的脱脂羊乳测定IgG、IgA、IgM含量,采用脱脂羊乳直接测定Lf含量。
1.3.4 抗菌酶酶活力的测定
LPO酶活力的测定参考ZOU等[12]的方法。取30 μL稀释100倍的脱脂羊乳与195 μL反应试剂(0.23 mmol/L AR、4.6 mmol/L硫氰酸钾)混合,取50 μL混合液加入96孔板中,37 ℃保持20 min,用酶标仪自动加样系统加50 μL 110 μmol/L H2O2溶液,空白用50 μL去离子水代替H2O2溶液,在激发/发射波长544/590 nm处每隔10 s测定荧光强度。用不同浓度梯度的H2O2溶液(0~8 μmol/L)制备标准曲线。
XO酶活力的测定参考ZOU等[13]的方法。取50 μL 稀释100倍的脱脂羊乳加入96孔板中,加入50 μL反应试剂(0.1 mmol/L AR、0.4 mmol/L次黄嘌呤、0.8 U/mL辣根过氧化物酶)混合,用酶标仪在激发/发射波长544/590 nm处每隔10 s测定荧光强度。用不同浓度梯度的H2O2溶液(0~8 μmol/L)制备标准曲线。
1.3.5 天然乳清蛋白含量的测定
乳清蛋白含量通过考马斯亮蓝法测定[14]。取脱脂羊乳样品50 mL,用盐酸调pH至4.3,静置1 h后,在25 ℃、8 000×g下离心15 min,收集上清液。用超纯水将上清液稀释400倍后测定,以牛血清白蛋白作为标品。
1.3.6 蛋白羰基和总巯基含量的测定
参考ELLMAN等[15]的方法测定蛋白羰基含量。取0.35 mL的脱脂羊乳加入0.5 mL 10 mmol/L DNPH溶液,室温静置反应1 h,加入1 mL 20% TCA溶液,混匀10 000×g离心5 min,收集沉淀并用乙酸乙酯-乙醇(1∶1,体积比)洗涤3次,加入1.5 mL 6 mol/L盐酸胍溶液,在37 ℃保持至沉淀全部溶解,在370 nm波长处测定吸光度,羰基含量单位为nmol/(L·mg Pro),采用分子消光系数为22 000 L/(mol·cm),蛋白质浓度由凯氏定氮法测得。
参考ELWELL等[7,15]的方法测定总巯基含量。取0.5 mL脱脂羊乳与4 mL反应试剂(80 mmol/L Tris-HCl、pH 8.0、100 mmol/L甘氨酸、5 mmol/L EDTA、8 mol/L尿素)混合,加入0.5 mL 10 mmol/L DTNB试剂反应30 min,在412 nm波长处测定吸光度。巯基含量单位为nmol/(L·mg Pro),分子消光系数为13 600 L/(mol·cm)。
1.3.7 总蛋白、酪蛋白和乳清蛋白含量的测定
脱脂羊乳中总蛋白含量采用凯氏定氮方法[16]进行测定。取5 mL脱脂羊乳于消化管中,加入0.2 g CuSO4、4 g K2SO4和20 mL浓硫酸,将消化管放入消化炉中消化至溶液澄清透明,放入定氮仪中加70 mL 40% NaOH溶液后开始蒸馏,接收瓶里加入30 mL 4%硼酸,滴加2~3滴混合指示剂,蒸馏时间为6 min,用0.1 mmol/L的盐酸标准溶液进行滴定,计算总氮含量。另取10 mL脱脂羊乳,加入40 mL三氯乙酸,滤纸过滤,取25 mL 滤液按上述条件消化、蒸馏、滴定,计算非蛋白氮含量。总蛋白含量=(总氮含量-非蛋白氮含量)×6.38。
脱脂羊乳中酪蛋白和乳清蛋白含量采用反相高效液相色谱法[17]测定。取0.9 mL脱脂羊乳与0.9 mL缓冲液1(0.1 mol/L Bis-Tris丙烷、pH 7、8 mol/L尿素、20 mmol/L DTT,1.3% 柠檬酸钠)混合,在室温下振荡1 h后10 000×g离心5 min,取0.45 mL上清液与1.35 mL缓冲液2[V(乙腈)∶V(水)∶V(三氟乙酸)=100∶900∶1,6 mol/L Urea]混合,过0.45 μm有机膜。采用C8色谱柱,上样量40 μL,梯度洗脱所用的流动相A和B中V(乙腈)∶V(水)∶V(三氟乙酸)分别为 100∶900∶1和900∶100∶0.7,流速 0.8 mL/min,检测波长为220 nm。采用 Empower 软件对各个色谱峰的面积进行积分。
1.4 数据分析
采用SPSS 20.0对试验结果进行统计分析,用One-Way ANOVA方法进行方差分析,采用Duncan’s test比较均值之间的差异,P<0.05时表明结果间存在显著差异。
2 结果与讨论
2.1 不同除菌方式对脱脂羊乳中微生物和体细胞去除的影响
国标GB 19645—2010《食品安全国家标准 巴氏杀菌乳》[18]规定:生乳菌落总数不得超过6.3 lg CFU/mL,巴氏杀菌乳菌落总数不得超过4.7 lg CFU/mL、大肠菌群数不得超过0.7 lg CFU/mL。此外,芽孢杆菌在自然界中普遍存在,能形成耐受HTST处理的芽孢,难以去除[19]。体细胞数与奶牛乳房炎症相关,是反应牛乳品质的一个重要指标,较高的体细胞数会导致蛋白和脂肪水解增加,产生异味,缩短乳制品的保质期[8,20-21]。我国国标没有限定生乳中体细胞的含量,但欧盟规定生乳中体细胞数不得超过5.6 lg CFU/mL,美国农业部规定不得超过5.9 lg CFU/mL[21]。
表1显示了不同除菌方式对脱脂羊乳中菌落总数、大肠杆菌数、芽孢数和体细胞数的影响。生鲜脱脂羊乳的菌落总数低于国标对生乳要求的上限。经HTST处理,菌落总数降低至3.5 lg CFU/mL,即降低了2.0 lg,菌落总数低于国标对巴氏杀菌乳要求的上限。菌落总数在经MF-1.4、MF-0.8和UV-C处理后均达到了与HTST处理相同的降低率,其中UV-C的降低率在统计上略低于MF-1.4和MF-0.8。大肠菌群数在经HTST、MF-1.4和MF-0.8处理后降低到未检出水平,在经UV-C处理后则降低1.6 lg,残留的大肠菌群数低于国标对巴氏杀菌乳要求的上限。芽孢数在经HTST和UV-C处理后仅降低了0.3和0.2 lg,在经MF-1.4和MF-0.8处理后则降低到未检出水平。体细胞数在经HTST和UV-C处理后无显著降低,在经MF-1.4和MF-0.8处理后则降低到未检出水平。细菌及其芽孢粒径在0.2~6 μm,体细胞粒径在6~15 μm,均可通过0.8~1.4 μm孔径的微滤处理有效地被去除[11,22]。

表1 不同除菌方式处理脱脂羊乳的菌落总数、大肠菌群数、芽孢数和体细胞数(lg CFU/mL)
2.2 不同除菌方式对脱脂羊乳中活性蛋白保留的影响
IgG、IgA、IgM和Lf是乳中重要的活性蛋白,具有免疫调节、过敏保护、抑菌等生理功能,但也具有热敏性[23]。LIU等[24]报道牛乳经60 ℃处理30 min,活性Lf含量降低约40%。图2显示了不同除菌方式对脱脂羊乳中活性IgG、IgA、IgM和Lf保留率的影响。HTST处理使活性Lf、IgA、IgG、IgM的保留率降低至86%、68%、51%、28%,说明四者的热稳定性依次递减。活性Lf、IgA、IgG、IgM的保留率在经MF-1.4处理后达90%、88%、87%、94%,在经MF-0.8处理后则达82%、82%、80%、88%,MF-1.4对Lf和IgG的保留率在统计上高于MF-0.8,对IgA和IgM的保留率在数值上高于MF-0.8,但无显著差异,说明较大的膜孔径更有利于活性蛋白的透过。MF-1.4对4种活性蛋白的保留率都高于HTST,MF-0.8对IgG、IgM的保留率都高于HTST,对IgA、Lf的保留率与HTST无显著差异。UV-C处理使活性Lf、IgA、IgG、IgM的保留率达94%、91%、75%、97%,均高于HTST。UV-C对Lf、IgA、IgM的保留率与MF-1.4无显著差异,对IgG的保留率低于MF-1.4。UV-C对IgG、IgA、IgM的保留率与MF-0.8无显著差异,对Lf的保留率高于MF-0.8。
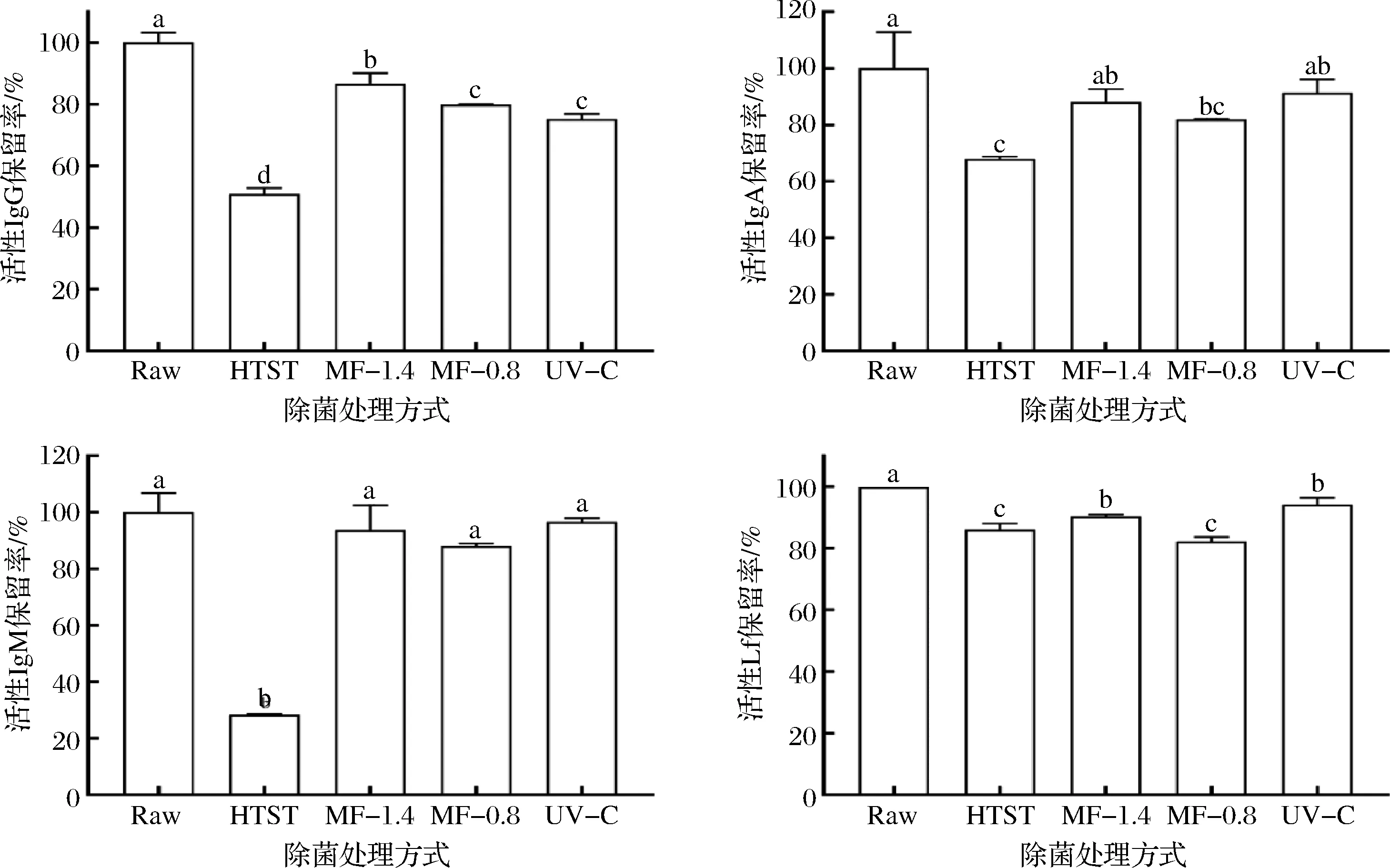
图2 不同除菌方式处理脱脂羊乳的活性IgG、IgA、IgM和Lf保留率
2.3 不同除菌方式对脱脂羊乳中抗菌酶酶活力保留的影响
LPO和XO是乳中重要的抗菌酶,两者具有协同增效作用[13]。LPO酶活力还常用于表征乳所受热处理的强度[12]。乳中XO主要结合在乳脂肪球膜[13]上,生鲜羊乳经脱脂后,XO酶活力由9.0 U/L降低至3.8 U/L。图3显示了不同除菌方式对脱脂羊乳中LPO和XO酶活力保留率的影响。HTST处理使LPO和XO酶活力的保留率降低至47%和49%。LORENZEN等[25]报道了牛乳中LPO的酶活力在经HTST处理后保留率降至40%~50%,与本文研究结果相一致。LPO和XO酶活力的保留率在经MF-1.4处理后达97%和72%,在经MF-0.8处理后达85%和70%,在经UV-C处理后达93%和86%。MF-1.4、MF-0.8、UV-C对2种抗菌酶酶活力的保留率都高于HTST。对LPO酶活力的保留率,MF-1.4与UV-C无显著差异,两者都高于MF-0.8。MF-1.4、MF-0.8、UV-C对XO酶活力的保留率相互间无显著差异。
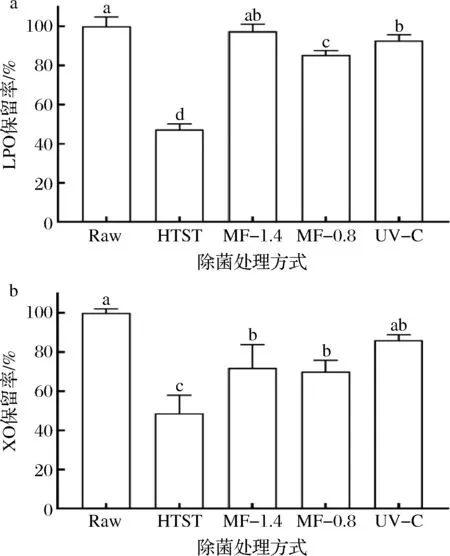
a-LPO酶活力保留率;b-XO酶活力保留率
2.4 不同除菌方式对脱脂羊乳中天然乳清蛋白保留率的影响
乳中天然的乳清蛋白主要包括β-乳球蛋白、α-乳白蛋白以及一些低丰度的活性蛋白和抗菌酶类等[26]。图4显示了不同除菌方式对脱脂羊乳中天然乳清蛋白保留率的影响。经HTST处理,天然乳清蛋白的保留率降低至84%,这与活性蛋白和抗菌酶的保留率相对应。LIU等[27]报道了牛乳中的天然乳清蛋白在经HTST处理后保留率达92%,高于羊乳中天然乳清蛋白的保留率,这可能是因为羊乳乳清蛋白的热稳定性较低。在热处理过程中,部分天然乳清蛋白变性,并暴露分子内部的疏水区域和巯基基团,产生分子间自聚集或者与酪蛋白形成复合物,在酸性条件下经离心与酪蛋白产生共沉淀[24,28]。与生鲜脱脂羊乳相比,天然乳清蛋白的保留率在经MF-1.4、MF-0.8、UV-C处理后无显著降低。

图4 不同除菌方式处理脱脂羊乳的天然乳清蛋白保留率
2.5 不同除菌方式对脱脂羊乳中蛋白氧化的影响
乳蛋白分子在加工中易发生氧化修饰,如碱性氨基酸残基的羰基化、半胱氨酸残基脱氢形成二硫键,降低蛋白质的消化率和营养价值[28-30]。图5显示了不同除菌方式对脱脂羊乳中蛋白羰基和总巯基含量的影响。蛋白羰基含量在经HTST处理后增加了18%,说明蛋白分子发生了热诱导氧化[31]。蛋白羰基含量在经UV-C处理后增加了19%,说明蛋白分子发生了光诱导氧化[31]。蛋白羰基含量在经MF-1.4和MF-0.8处理后无显著增加。蛋白总巯基含量在经HTST处理后降低了7%,在经MF-1.4、MF-0.8、UV-C处理后无显著降低。上述结果与不同除菌方式对天然乳清蛋白保留率的影响相对应,两者都说明微滤除菌处理对蛋白分子天然结构的保持效果较好。
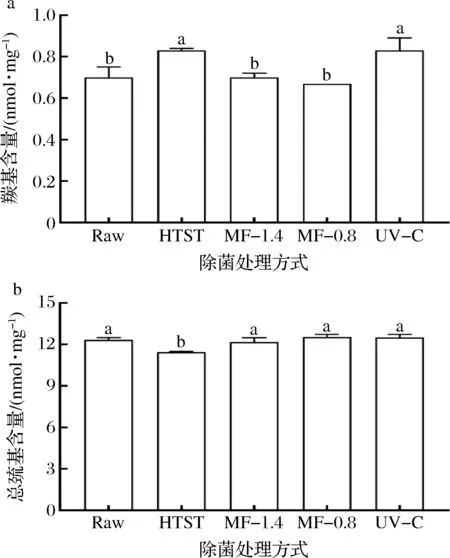
a-羰基含量;b-总巯基含量
2.6 不同膜孔径MF处理脱脂羊乳对膜通量及蛋白透过率的影响
在膜过滤分离过程中,膜表面逐渐发生浓差极化、滤饼层沉积等现象,导致膜通量和蛋白透过率的降低[23]。图6显示了不同膜孔径微滤处理脱脂羊乳对膜通量及蛋白透过率的影响。
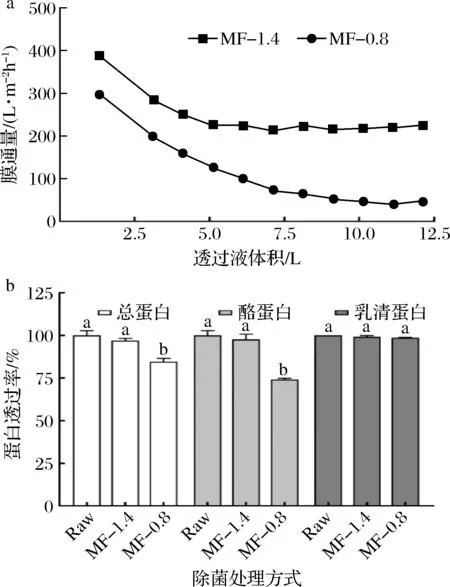
a-膜通量;b-蛋白透过率
在整个膜过滤过程中,MF-1.4处理的膜通量均高于MF-0.8处理。对于MF-1.4处理,膜通量在最初的透过液体积1~5 L时降低了41%,随后保持稳定;对于MF-0.8处理,膜通量在最初的透过液体积1~7 L时降低了75%,在随后的7~12 L时保持较低水平,降低了10%。这说明MF-1.4更适用于工业上连续式的生鲜乳除菌处理。MF-1.4处理使总蛋白完全透过,MF-0.8处理则使总蛋白的透过率降低到85%,该结果与不同膜孔径微滤处理脱脂羊乳对膜通量的影响相对应。酪蛋白在经MF-1.4处理后完全透过,在经MF-0.8处理后透过率降低到74%,乳清蛋白在经MF-1.4和MF-0.8处理后都完全透过。这说明MF-0.8处理后总蛋白透过率的降低主要是由酪蛋白的截留所导致。羊乳酪蛋白主要以胶束结构形式存在,其粒径约为50~150 nm,乳清蛋白粒径约为1~6 nm,因此酪蛋白更易于被小孔径的微滤膜所截留[32]。
3 结论
HTST、1.4和0.8 μm孔径MF、UV-C处理对脱脂羊乳中微生物和体细胞去除、活性蛋白和天然乳清蛋白保留有显著影响。在微生物方面,总菌落经MF-1.4、MF-0.8和UV-C处理均达到与HTST相同的去除率,大肠菌群均符合国标巴杀乳要求;且相较于HTST、UV-C处理,MF处理能有效的截留芽孢和体细胞。在活性成分保留方面,经MF-1.4处理后,其活性成分的保留显著高于HTST处理,活性乳铁蛋白、IgA、IgG、黄嘌呤氧化酶、乳过氧化物酶、IgM保留率分别为90%、88%、87%、72%、97%、94%;在乳清蛋白变性和蛋白氧化方面,HTST处理的样品变性显著,且HTST和UV-C处理蛋白氧化较MF处理明显。在MF处理过程中,MF-1.4较MF-0.8处理,有更高的膜通量和蛋白透过率。上述结果为高微生物安全性、高生物活性羊乳及其制品的生产提供了参考。
