从胚胎学与膜解剖理解完整结肠系膜切除手术
2021-08-09牛敏娟厉琳杰郗欢刘海滨郑宏群孙凌宇
牛敏娟,厉琳杰,郗欢,刘海滨,郑宏群,孙凌宇
哈尔滨医科大学附属第四医院肿瘤外科 黑龙江哈尔滨150000
结肠癌的标准化手术包括完整结肠系膜切除术(complete mesocolic excision,CME)和中央血管结扎(central vascular ligation,CVL)[1-2]。日本的D3淋巴结清 扫 (D3lymphadenectomy, LND3) 与 CME、CVL手术类似,有研究报道CME/LND3具有更好的肿瘤学结果[3]。近年来,随着腹腔镜手术的广泛开展及高清腹腔镜设备的普及,以往开腹手术中无法辨识的膜结构及精细解剖层面逐渐被认识,膜解剖理论越来越受到重视。系膜解剖(mesenteric anatomy)、筋膜解剖(fascial anatomy)以及膜解剖(membrane anatomy)等理论学说逐渐被接受和传播[4]。但不同膜解剖理论之间的相互交织使得“如何正确进行CME手术”这一看似已有定论的话题又变得混沌起来。关于CME手术正确的层面、血管结扎部位和清扫边界等问题又成为学者们争议的话题。在人类胚胎的生长发育过程中,由于前、中、后肠的旋转以及大网膜的伸展,使肠系膜逐渐从单一平面变成螺旋状排列,形成了复杂的三维结构[5-7]。肠系膜与后腹膜、肠系膜与肠系膜发生“接触”和“融合”,形成各种融合筋膜[8],见图1。理解胚胎时期胃肠道发育过程中各种融合筋膜的形成以及血管空间位置的变化,有助于在CME中精细分离融合筋膜、高位结扎血管、切除足够长度的肠管和彻底清扫淋巴结。

图1 融合筋膜示意图(基于参考文献[8]进行修改)
1 消化系统胚胎发育与融合筋膜的形成
(1)原肠的发育:胚胎生长至第3~4周时,随着圆柱状胚体的形成,卵黄囊顶部的内胚层被卷入胚体内,形成原肠(primitive gut),其头段称前肠(foregut),尾段称后肠(hindgut),与卵黄囊相连的中段称中肠(midgut)[6]。前肠有腹侧系膜和背侧系膜,中肠和后肠只有背侧系膜[5],见图2A。
(2)前肠的发育:胚胎生长至第6周,胃及系膜沿长轴顺时针旋转90°(头侧向尾侧观)。胃背侧系膜向左、向尾侧突出及旋转,在其内部生成脾和背胰。胃的背侧缘生长较快形成胃大弯,腹侧缘生长较慢形成胃小弯,胃由最初的垂直方位变成由左上至右下的斜位。胃腹侧系膜向右、向头侧翻起,助力胃的旋转,胃腹侧系膜的内部生成肝和腹胰。膨胀的胃背侧系膜形成大网膜,胃腹侧系膜形成小网膜[5],见图2B。十二指肠腹侧系膜包裹着门静脉、肝固有动脉、胆总管,形成所谓的“肝十二指肠韧带”与小网膜右侧缘毗邻。胃旋转的同时,十二指肠环发育、旋转至右侧形成“C”形。十二指肠背侧系膜内的背胰延伸到胃背侧系膜内,腹胰向背侧旋转,移动至背胰后下方形成钩突,腹胰与背胰融合。十二指肠倒伏在腹后壁,十二指肠背侧系膜与后腹膜融合为胰后Treitz筋膜(Treitz fascia),胃背侧系膜与后腹膜发生融合,形成胰后Toldt筋膜(Toldt fascia)[8-9],见图1。注意,胰后Treitz筋膜与胰后Toldt筋膜均为融合筋膜,融合筋膜的两侧都是腹膜下筋膜,后腹膜侧的Gerota筋膜与肠系膜侧的腹膜下筋膜相连续。
(3)中肠的发育:原肠快速生长,向腹部弯曲形成“U”形中肠袢(midgut loop),其顶端连于卵黄蒂。中肠袢以卵黄蒂为界,分为头支和尾支。在胚胎生长的第6周,由于肝肾的发育,腹腔容积相对较小,致使肠袢突入脐腔(umbilical coelom),形成生理性脐疝[6]。肠袢在脐腔中生长的同时,以肠系膜上动脉(superior mesenteric artery,SMA)为轴作第一次逆时针旋转90°(从腹面观),中肠袢由矢状位转为水平位,头支从上方旋转到右侧,尾支从下方旋转到左侧,见图2C。胚胎生长至第10周,腹腔容积增大,肠袢陆续从脐腔返回腹腔,中肠发生第二次逆时针旋转90°,Treitz韧带将十二指肠空肠移行部向横膈方向悬吊。头支位于尾侧,空回肠形成多个螺旋肠袢;尾支位于头侧,发出盲肠芽,见图2D。胚胎生长至第10周末,中肠袢退回到腹腔,发生第三次逆时针旋转90°。近端空肠到达左侧,横结肠位于十二指肠前面,盲肠位于右髂窝,升结肠和结肠肝曲位于右侧,见图2E。
升结肠的脏腹膜与后腹膜融合固定,形成右侧Toldt筋膜。右侧Toldt筋膜的外界为升结肠外侧Toldt白线,内界为肠系膜上静脉(superior mesenteric vein,SMV)右侧缘,下界为小肠系膜根,上界为十二指肠水平部下缘[5],见图1、图2F。横结肠系膜与升结肠系膜相连续并“镶嵌”于胰腺下缘背侧,再向腹侧折返。横结肠系膜右侧部分与十二指肠水平部及胰头表面的腹膜融合,构成胰前Fredet筋膜(Fredet fascia),见图1、图2F。Fredet筋膜亦是融合筋膜,其两侧分别是胰腺脏层筋膜与横结肠的脏层筋膜,内界是SMV和Henle干[10]。右侧Toldt筋膜向上在十二指肠水平部前方与胰前Fredet筋膜相延续,在十二指肠水平部后方与胰后Treitz筋膜相延续[8],见图1。大网膜由胃大弯发出,与横结肠附着、延伸、折返,继续包绕胰腺,形成网膜囊(omental bursa)。横结肠系膜左侧部分与延展的大网膜相接触,形成融合筋膜[11]。此处的大网膜称为外科学意义上的“横结肠系膜前叶”,而真正的横结肠系膜称为“横结肠系膜后叶”,见图2G。网膜囊的前壁由胃结肠韧带后叶、胃脾韧带后叶、胃后壁的浆膜和小网膜后叶的腹膜所构成;后壁由左侧横结肠系膜前叶、胰体尾部前被膜和胰腺上缘的后腹膜构成;左界为脾门,右界为横结肠系膜前叶到大网膜的折返线[12],见图2G。
(4)后肠的发育:中肠旋转带动后肠头侧随之移动,使降结肠位于腹部左侧,降结肠的脏腹膜与后腹膜融合固定,形成左侧Toldt筋膜,见图1、图2F、图3A[5]。左侧Toldt筋膜外界为降结肠外侧Toldt白线,内界为腹主动脉,下界为左侧髂动脉外侧,上界为胰体尾下缘,左侧Toldt筋膜向上与胰后Toldt筋膜相延续,见图1。左侧Toldt筋膜中间偏下部分存在缺损,称为乙状结肠陷凹,陷凹顶点的后方有左侧输尿管通过,见图3B。

图2 消化系统胚胎发育示意图(基于参考文献[5]进行修改)
后肠末段的膨大部分为泄殖腔(cloaca)。胚胎生长至第4~7周时,尿囊与后肠之间形成尿直肠隔(urorectal septum),向尾端生长,将泄殖腔分隔为腹侧的尿生殖窦(urogenital sinus)与背侧的原始直肠。尿生殖窦形成泌尿生殖系统,原始直肠分化为直肠和肛管上段。外方为外胚层向内凹陷形成的肛凹(anal pit)。第8周末,肛膜破裂,直肠与肛凹相通,二者之间以齿状线分界[6]。在胚胎发育过程中直肠无明显旋转,直肠后方在胚胎早期无腹膜覆盖,因此其后方不存在Toldt融合筋膜,见图3C。这可以解释为何直肠癌手术内侧入路的第一刀容易走深层面,且在分离直肠固有筋膜时需不断将“天花板”上的神经、生殖血管、输尿管游离下来。直肠后方无融合筋膜,但存在一个直肠后间隙,是由肠系膜下动脉与左右髂动脉形成了一个底朝盆腔的“三棱锥”结构,由疏松结缔组织填充形成一个“空间”。在自然状态下,直肠后间隙呈前后两层筋膜并行的扁鱼口形,腹侧的筋膜是直肠固有筋膜,背侧的筋膜是腹下神经前筋膜,见图3D[5]。我们在手术中也发现Toldt筋膜止于髂动脉外侧,而在直肠后方缺如,见图3E。在腹下神经前筋膜前方游离,能避免神经、生殖血管、输尿管的损伤,是直肠后方游离的正确层面。
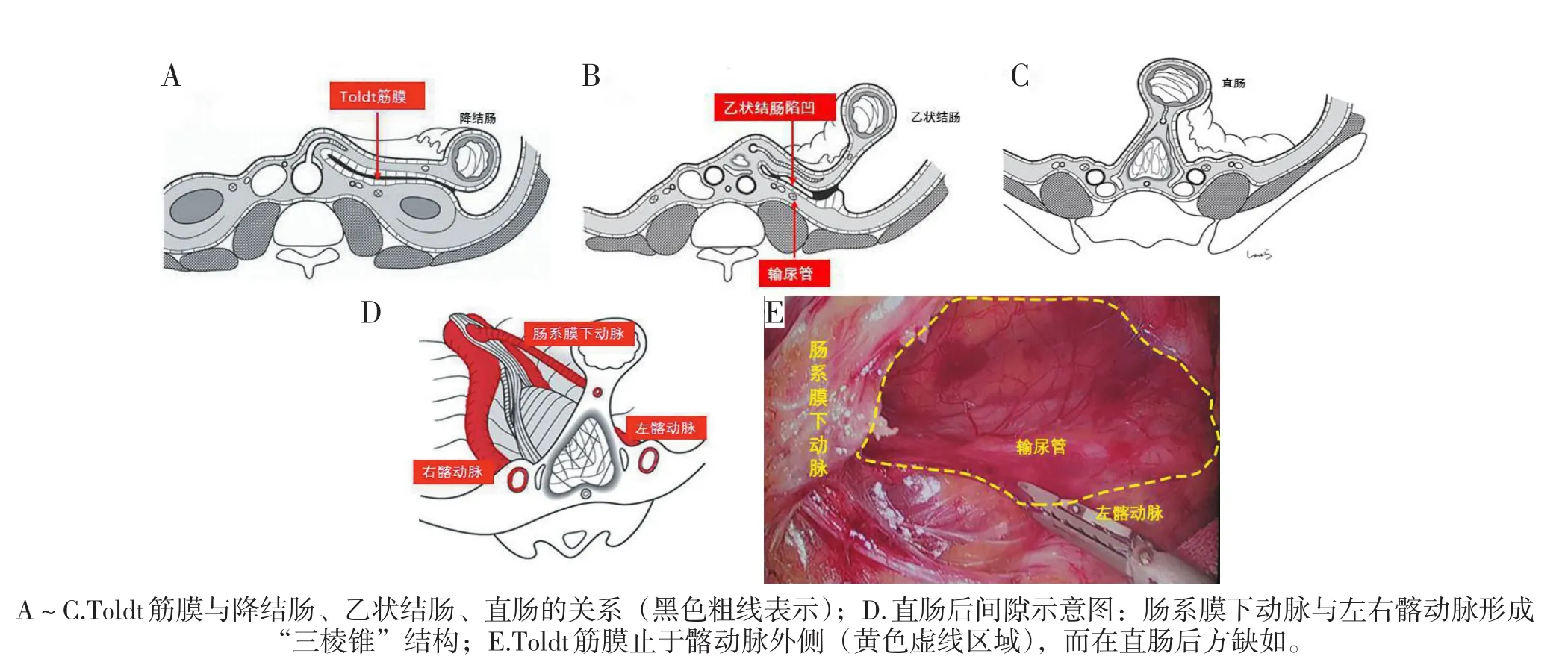
图3 后肠的Toldt筋膜示意图(A~D基于参考文献[5]进行修改,E为笔者团队手术图片)
2 胚胎发育与胃肠道血管的空间位置变化
胃肠道血管走行于肠系膜中间的脂肪层,了解从原肠时期开始胃肠道主干血管的空间位置变化,有助于在进行CME时准确游离、高位结扎血管并减少出血。前肠、中肠和后肠分别由腹腔动脉(celiac artery,CA)、肠系膜上动脉(superior mesenteric artery,SMA)和肠系膜下动脉(inferior mesenteric artery,IMA)供血。腹腔动脉是胃背侧系膜的主干动脉,主要分支为胃左动脉(left gastric artery,LGA)、脾动脉 (splenic artery,SPA)、肝总动脉(common hepatic artery,CHA),见图2A。在胃发育旋转的过程当中,LGA、SPA、CHA随着胃背侧系膜的膨胀,从之前的二维构象伸展为三维构象[13]。SPA的终末分支是胃网膜左动脉(left gastroepiploic artery,LGEA),肝总动脉 (common hepatic artery,CHA)分支为胃十二指肠动脉(Gastroduodenal artery,GDA)和肝固有动脉(proper hepatic artery,PHA),GDA发出胃网膜右动脉(right gastroepiploic artery,RGEA),见图2B。结肠脾曲癌和肝曲癌CME涉及到LGEA与RGEA的解剖。SMA的分支胰十二指肠下动脉(inferior pancreaticoduodenal artery,IPDA)和第1空肠动脉(J1A)在中肠第二次旋转90°后由平面分布变为直角分布,见图2C、图2D。中肠第三次旋转90°后,由于十二指肠空肠交界部受Treitz韧带的牵拉位于旋转轴的左侧,J1A向SMA的左方移动。IPDA、J1A、中结肠动脉(middle colon artery,MCA)进一步形成三维构象,见图2E。
门静脉(portal vein,PV)有3条属支:脾静脉(splenic vein,SPV)、肠系膜上静脉(superior mesenteric vein,SMV)、肠系膜下静脉(inferior mesenteric vein,IMV),这三条静脉在中肠旋转前位于SMA的左侧,伴随中肠第一次旋转90°绕到SMA上方,见图2C,中肠第二次旋转90°时,三支静脉绕到SMA右侧,见图2D。胃网膜右静脉(right gastroepiploic vein,RGEV)、副右结肠静脉 (accessory right colic vein,ARCV)与中结肠静脉(middle colon vein,MCV)也随着肠系膜的旋转而向三维的汇合形态变化[14],见图4。RGEV和ARCV经常汇合形成胃结肠干(gastro-colic trunk),最早由Henle报告,所以多命名为Henle干。胃和结肠在空间上并不连续,RGEV和ARCV为什么能够共干呢?从图4可见原肠时期的十二指肠和结肠都位于中肠袢的根部,两者的肠系膜相邻,RGEV和ARCV距离较近,故而容易形成共干。胰十二指肠上前静脉(anterior superior pancreaticoduodenal vein,ASPDV)大多也一起汇入称之为胃胰结肠干(gastro-pancreato-colic trunk),此外还有胃胰干(gastro-pancreatic trunk)、胰结肠干(pancreato-colic trunk)等少见类型[15]。CME手术的本质是恢复肠管的旋转使其回到胚胎时期的状态,Henle干在SMV的汇入点是肠管旋转的中心,是手术风险最大的地方[14]。Henle干的几个属支分属于三个系膜结构:ARCV属于横结肠系膜、RGEV属于胃网膜右系膜、ASPDV属于十二指肠腹侧系膜,对Henle干进行解剖就是这几个系膜的分离,是提高CME手术安全性和彻底性的关键步骤之一。
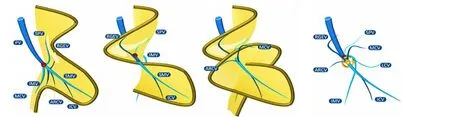
图4 中肠旋转的中心(基于参考文献[14]进行修改)
3 从胚胎发育看CME手术的质量控制
CME的要点包括:(1)在脏层筋膜与壁层筋膜平面之间分离,完整切除结肠系膜;(2)中央血管高位结扎,以完全切除垂直方向上的所有淋巴结;(3)切除足够长度的肠管,以切除水平方向的肠周淋巴结[16]。黄胜辉[17]认为CME的病理学报告除了要评价系膜层面的完整性以外,还要评价系膜边界包括内侧、头侧和尾侧边界的完整性。结肠CME手术的本质是将肠管解螺旋恢复到胚胎时期的原肠形态,我们结合胚胎发育对CME的手术范围和质量控制进行了一些思考:
(1)肠管切除长度与肠周淋巴结清扫范围。日本《大肠癌规约》根据肿瘤支配动脉的位置,规定了肠旁淋巴结范围的“10+5”原则[18]。观察小肠或者乙状结肠的切除标本,肠管与肠系膜呈扇形,而中肠旋转与后腹膜相贴合后,失去同小肠系膜一样的扇形形态。从图2A原肠的形态可见,近似于“直肠子”的每段结肠其实也有其相应扇形分布的系膜和主要支配血管。CME的游离过程可以理解为旋转与融合的逆向工程,这个过程结束后结肠系膜也能恢复到近似扇形或者梯形的形态,这就容易理解“10+5”原则了。
(2)中央血管结扎部位与垂直方向淋巴结清扫范围。中央淋巴结是分布于动脉起点周围的淋巴结[19]。为什么左半结肠CME要清扫到IMA根部而右半结肠CME不必清扫到SMA根部?如图2A所示,后肠(降结肠、乙状结肠)肠系膜“信封”的边界在腹主动脉,所以乙状结肠D3手术需在IMA根部结扎切断,清扫NO.253淋巴结。而中肠(升结肠、横结肠)肠系膜“信封”边界在SMA表面,所以要相应地在回结肠动脉(ileocolic artery,ICA)、右结肠动脉(right colon artery,RCA)、MCA的根部结扎切断,以清扫NO.203、NO.213、NO.223淋巴结。在SMA根部结扎切断,小肠将失去血运,这是不可行的。
(3)内侧清扫边界。左半结肠CME内侧清扫边界在腹主动脉表面,空肠起始部和小肠系膜根经常遮挡在腹主动脉的表面,手术时应注意掀起小肠系膜根,在空肠起始部左侧甚至是后方沿腹主动脉表面切开降结肠系膜根。关于右半结肠CME的内侧清扫边界,众说纷纭,有SMV右侧、SMV左侧、SMA左侧之争[20]。一项研究显示以SMA的中线为分水岭,在SMA表面也有淋巴结[21]。图5显示了肠管、SMA、SMV的旋转以便于理解右半结肠CME的内侧清扫边界,原肠时期SMA和SMV的表面是升结肠系膜“信封”的边界,若此时行右半结肠CME手术就很简单,只需在SMA与SMV的表面离断肠系膜即可。随着中肠三次90°逆时针旋转,SMV也围绕SMA旋转,升结肠倒伏到后腹膜,其肠系膜也倒卧在SMV、SMA表面(SMA也参加了旋转),故而旋转后肠系膜清扫边界最远只需达到SMA表面而不超过其左侧缘,做SMA的环周清扫更是大可不必。

图5 SMV与SMA旋转示意图(基于参考文献[14]进行修改)
(4)头侧边界涉及网膜囊、胰腺下缘的解剖。横结肠系膜在胰腺下缘由背侧向腹侧折返。横结肠系膜根位于胰腺下缘,内侧较为明显且坚韧,而在胰体尾部该结构逐渐消失,代之以光滑的相互移行的横结肠系膜和降结肠系膜背侧叶[22]。行左半结肠CME时笔者认为横结肠系膜根应以十二指肠空肠曲外侧、胰腺下缘处的IMV根部为标志。Garcia-Granero等[23]将SMV比作桅杆,回结肠血管比为帆桁,两者之间为结肠系膜帆,当右半结肠系膜帆和SRCV两者均完整时定义为完整D3清扫,笔者认同将SRCV作为右半头侧边界的标志。Benz等[24]提出在真正的CME标本中,回结肠血管蒂和中结肠血管蒂通过覆盖外科干的淋巴脂肪组织连接,结肠系膜窗需具有完整的内侧框架,见图6。

图6 CME完整病理标本示意图(右半结肠)(A引用自参考文献[24],B为笔者团队手术标本)
(5)后方游离(Toldt筋膜游离层面)。评价系膜层面的完整性的West标准分级为结肠系膜平面、系膜内平面和肌层平面[25]。如果要准确达到结肠系膜平面,应该在结肠后方哪个层面游离?Culligan等[26]认为在Toldt筋膜浅面和深面分别有系膜—融合筋膜平面(mesofascial interface)和融合筋膜后平面(retrofascial interface),在系膜—融合筋膜平面游离可以避免输尿管和血管的损伤,见图7。篠原尚等[5]认为,在Toldt筋膜两侧均有“可剥离层”,于深层游离更加容易,并可以将融合筋膜放在标本切除侧,见图8。笔者认为应结合肿瘤分期及术者习惯和技术水平具体决定在哪个平面进行分离,如果肿瘤是T3及以下分期,可以在系膜—融合筋膜平面进行分离,如果是T4期的结肠癌,应在融合筋膜后平面(T4a)分离,甚至在肾前筋膜后方游离以切除肾脂肪囊后壁(T4b)。初学者至少应知晓游离层面的深浅并把握好游离层面的深度,在浅层游离要注意避免肠系膜破损,在深层游离应注意避免输尿管和神经损伤。
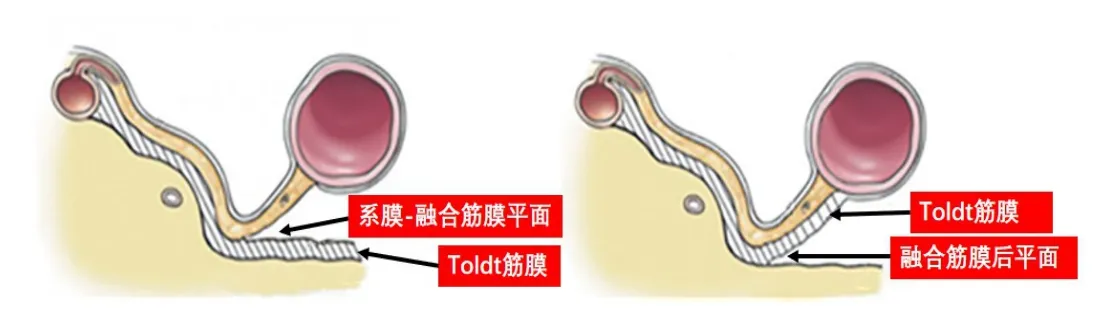
图7 Toldt筋膜游离层面示意图(基于参考文献[26]进行修改)

图8 Toldt筋膜游离层面示意图(基于参考文献[5]进行修改)
4 腹腔镜右半结肠CME技术路线(以回盲部癌为例)
腹腔镜右半结肠CME经历了外侧入路、中间入路并逐渐演变出头侧入路和尾侧入路[27]。各种入路各有优劣,应结合术者习惯、肿瘤所在部位、分期等合理选择手术入路。笔者基于胚胎发育和膜解剖的原理,优化了完全腹腔镜CME的技术路线,形成了先头侧、再中间、后尾(外)侧的混合入路手术流程,见图9、图10。

图9 右半结肠CME技术路线图(基于参考文献[28]进行修改)
(1)头侧入路。①在胃网膜血管弓外离断胃结肠韧带,进入网膜囊,见图10A。②分离横结肠系膜与胃网膜右系膜,见图10B。于胰腺下缘切开横结肠系膜前叶及融合筋膜,显露SMV和Henle干,切断结肠支,保留胰腺支和胃支,见图10C、10D。继续在系膜—融合筋膜平面游离升结肠及结肠肝曲,见图10E。③将大网膜和横结肠向头侧翻起,切开大网膜与横结肠中份的附着部,见图10F。④由大网膜悬垂部开始中间切断大网膜,见图10G。
(2)中间入路。⑤于SMV左侧缘切开腹膜向头侧游离,见图10H。⑥再沿SMV尾侧游离肠系膜,见图10I。于该切开线右侧逐一解剖出ICA、回结肠静脉(ileocolic vein,ICV)、RCA(若有)、右结肠静脉(right colon vein,RCV)(若有),并做相应的离断,见图10J。笔者不做回结肠血管蒂的切开,以尽可能保证结肠系膜的完整性。于SMV右侧缘向外侧拓展,可见右侧可见Fredet筋膜与右侧Toldt筋膜相延续,见图10K。继续结扎切断MCA右支和MCV,见图10L。剪裁横结肠系膜,见图10M。向尾侧切开回肠系膜至回肠预定切开线,见图10N。离断回肠,图10O。
(3)外(尾)侧入路。⑦将回盲部向头侧掀起,切开Toldt线,进入升结肠后间隙,与头侧、中间入路会师,见图10P。腔内吻合。

图10 右半结肠CME手术步骤(笔者团队手术图片)
5 腹腔镜左半结肠CME技术路线(以结肠脾曲癌为例)
左半结肠CME的核心是脾曲游离,主要有外侧入路、中间入路、前方入路及横向入路等,池畔[29]提出的“三路包抄”法降低了脾曲游离的难度。笔者采用先中间、再头侧、后外侧的“三路包抄”法,见图11、图12。

图11 左半结肠CME技术路线图(基于参考文献[28]进行修改)
(1)中间入路。①于上段直肠系膜与右侧盆壁腹膜的凹陷处切开,在直肠固有筋膜与腹下神经前筋膜之间的直肠后间隙游离,向尾侧拓展直至降结肠外侧,见图12A。于IMA根部切开腹主动脉腹侧的肠系膜,向头侧拓展,见图12B。显露IMA、左结肠动脉(left colic artery,LCA)、乙状结肠动脉(sigmoid colic artery,SCA)、IMV,切断 LCA和IMV,裁剪乙状结肠系膜,见图12C。②于降结肠系膜背侧叶与左侧Toldt筋膜之间游离,见图12D。沿十二指肠外侧缘切开游离降结肠系膜,于胰腺下缘IMV发出的部位结扎切断IMV,见图12E。分离出MCA的左支和右支,切断MCA左支,见图12F。
(2)头侧入路。③于网膜血管弓内切断大网膜,进入网膜囊,见图12G。④于胰腺下缘切开横结肠系膜前叶,见其延续为胰腺前背膜和后背膜,见图12H。然后顺势转向胰腺背侧游离,可见结肠后方的Toldt筋膜延续为胰后Toldt筋膜,见图12I。转向胰尾表面于胃网膜左血管根部结扎切断,保留脾下极的血管,分离左侧大网膜,见图12J。游离横结肠系膜后叶与中间入路会师,见图12K。⑤将大网膜和横结肠向头侧翻起,切开大网膜与横结肠中份的附着部。⑥由大网膜悬垂部开始中间切断大网膜。
(3)外侧入路。⑦从降乙结肠外侧向头侧游离至脾下极,与头侧、中间入路会师,见图12L。切断肠管,腔内吻合。
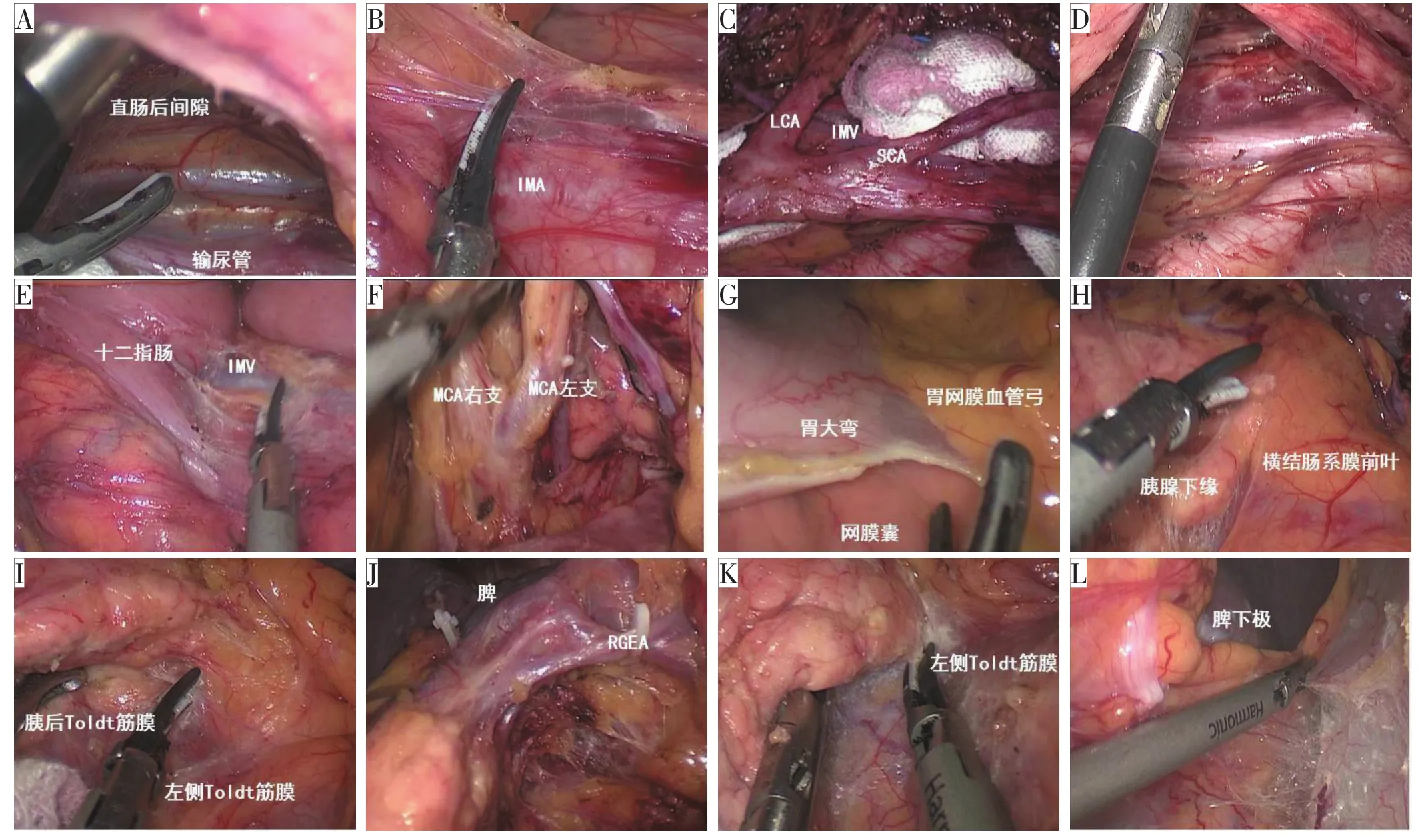
图12 左半结肠CME手术步骤(笔者团队手术图片)
6 小结与展望
本文描述了前肠、中肠、后肠的发育与旋转,融合筋膜的形成及血管空间位置的变化过程,目的是帮助初学者“知其然,知其所以然”,充分理解胚胎学和膜解剖指导下的CME手术,以尽快度过学习曲线。本文描述的胃网膜血管弓离断部位、大网膜切除范围的内容属笔者团队经验,与各位同道进行交流探讨,若有不妥,请各位同道批评指正。横结肠癌CME、联合脏器切除术的膜解剖理论和应用等本文未及的问题,将另行撰文探讨。
致谢:感谢许燕常教授和符炜教授对本文的指导。
