OGG1与Smad7蛋白相互作用的具体区域鉴定
2021-08-07方耀威许志亮王亚红高胜兰
方耀威,许志亮,王亚红,高胜兰,吴 铿,刘 刚*
(1广东医科大学附属医院临床研究中心,湛江 524000;2广东医科大学附属医院心内科;*通讯作者,E-mail:gangliu11@gdmc.edu.cn)
肺纤维化是一种预后极差的慢性肺部疾病,其发病机制尚未清楚。近年来,肺纤维化的发病率和病死率也逐渐升高。虽然已上市的吡非尼酮和尼达尼布能延缓肺纤维化的进程,但作用有限,因此仍迫切需要更有效的药物来满足临床的治疗[1]。
转化生长因子1(transforming growth factor-beta 1,TGF-β1)具有促进组织纤维化的重要功能[2],TGF-β1通过激活Smad依赖性和非依赖性途径发挥其生物学活性[3]。其中,Smad2和Smad3是促进TGF-β1介导的组织纤维化的两个主要下游调节因子,而Smad7作为TGF-β1/Smad通路的负反馈调节因子,阻断了TGF-β1介导的促纤维化信号[4]。
8-氧鸟嘌呤DNA糖化酶1(8-oxoguanine DNA glycosylase-1,OGG1)是一种DNA修复酶,在氧化应激的情况下,它通过与DNA链上的8-oxoG结合从而启动碱基切除修复(BER)过程[5]。本课题组前期研究[6]发现,OGG1在博来霉素诱导的小鼠肺组织中表达上调,对小鼠肺部组织进行病理切片后,苏木素-伊红(HE)染色发现肺泡结构紊乱并有实变,Masson染色观察发现肺泡间隙有大量蓝色胶原沉积,而敲除OGG1能缓解博来霉素诱导的小鼠肺纤维化,通过进一步探讨OGG1影响肺纤维化的机制,证实了OGG1与Smad7存在相互作用,但其相互作用的具体区域不明。本实验在前期研究的基础上,通过原核表达系统获得OGG1和Smad7不同截段体蛋白,并在体外进行pull-down检测,进而发现OGG1与Smad7相互作用的具体区域。
1 材料与方法
1.1 仪器
蛋白电泳槽(货号:1658000)、半干转印系统转印槽(货号:1703849)以及化学成像系统(货号:17001395)均购于美国Bio-Rad公司、脱色摇床(货号:G004408-0001,中国生工)、试管旋转摇床(货号:E0039,中国碧云天)、小型磁力架(货号:B518800,中国生工)。
1.2 试剂
Protein G免疫磁珠(货号:D110561,中国生工)、甲醇(货号:A601617,中国生工)、30%丙烯酰胺(货号:1610157,美国Bio-Rad公司)、APS(货号:A3678,美国Sigma公司)、Tris base(货号:V900483,美国Sigma公司)、TEMED(货号:T7024,美国Sigma公司)、10% SDS(货号:151-21-3,美国Sigma公司)、BCA蛋白浓度测定试剂盒(货号:P0012,中国碧云天公司)、5xLoading Buffer(货号:C506032-0005,中国生工)、蛋白预染Marker(货号:26620,美国ThermoFisher公司)、PVDF膜(货号:ISEQ00010,美国Sigma公司)、Tween 20(货号:ST828-500ml,中国碧云天公司)、兔抗GST-Tag多克隆抗体(货号:D110271-0100,中国生工)、小鼠抗S-Tag单克隆抗体(货号:D191105-0100,中国生工)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(货号:A0216,中国碧云天公司)、辣根过氧化物酶标记山羊抗兔IgG(H+L)(货号:A0208,中国碧云天公司)、发光液A+B(货号:34577,美国ThermoFisher公司)。
1.3 Pull-down实验
按照实验需求设置3种不同的分组进行实验,谷胱苷肽羧基转移酶(glutathione-S-transferase,GST)和S标签肽(S tag peptide,S-tag)为标签蛋白,与被检测目的蛋白如OGG1和Smad7,及它们各自截断体蛋白结合成为融合蛋白,各种融合蛋白已提前制备完毕。
分组一:为检测OGG1与Smad7存在相互作用,设置GST标签蛋白对照组、GST+S-tag-Smad7组、GST-OGG1组以及GST-OGG1+S-tag-Smad7组,每组的蛋白量为50 μg,并用1 ml反应液与每组蛋白混合,反应液的具体成分为20 mmol/L Tris盐酸盐(Tris-HCl)、100 mmol/L氯化钠(NaCl)、50 mmol/L氯化钾(KCl)、0.5 mmol/L乙二胺四乙酸(EDTA)、1 mmol/L氯化镁(MgCl2)和5%(V/V)甘油(glycerol),在4 ℃中用试管旋转摇床孵育12 h,使GST-OGG1融合蛋白与S-tag-Smad7充分结合,提前留取40 μl反应液作为输入对照组(Input,IP),加入5×Loading Buffer混匀后沸水加热5 min制备样品。在剩下的10 μl反应液中加入GST抗体1 μg,室温孵育1 h,再加入50 μl protein G磁珠室温孵育15 min,使用小型磁力架吸附附有结合蛋白的磁珠,使用PBS-T在4 ℃下洗涤5次,每次10 min,去除上清后,使用40 μl洗脱液(pH=2.8,0.2 mol/L glycerol)室温洗脱3 min,此时磁珠与蛋白发生解离,再用磁力架子吸附磁珠,上清液即为纯化后的每组融合蛋白(IP:GST),如果OGG1和Smad7融合蛋白之间有结合,则蛋白在洗脱过程中不容易解离,用BCA蛋白浓度测定试剂盒进行蛋白定量,取上清液加入5×Loading Buffer混匀后沸水加热5 min制备样品。
分组二:为了检测不同的OGG1截段体与Samd7的相互作用,将GST-OGG1+S-tag-Smad7融合蛋白混合后作为对照组、GST-OGG1(1-242 aa)+S-tag-Smad7、GST-OGG1(1-138 aa)+S-tag-Smad7、GST-OGG1(1-63 aa)+S-tag-Smad7和GST-OGG1(34-346 aa)+S-tag-Smad7作为实验组,每组的蛋白量为50 μg,加入反应液4℃孵育12 h使蛋白充分结合,每组取40 μl反应液作为Input对照组,制样。在剩下10 μl反应液中每组加入S-Tag抗体1 μg(IP:S-tag),室温孵育1 h,其余的磁珠纯化与蛋白制样步骤同分组一。
分组三:为了检测OGG1(34-346 aa)与不同的Smad7截段体间的相互作用,将S-tag-Smad7+GST-OGG1(34-346 aa)融合蛋白混合后作为对照组、S-tag-Smad7(1-308 aa)+GST-OGG1(34-346 aa)、S-tag-Smad7(1-240 aa)+GST-OGG1(34-346 aa)和S-tag-Smad7(1-128 aa)+GST-OGG1(34-346 aa)作为实验组,每组的蛋白量为50 μg,加入反应液4 ℃孵育12 h使蛋白充分结合,每组取40 μl反应液作为Input对照组,制样。在剩下10 μl反应液每组加入GST抗体1 μg(IP:GST),室温孵育1 h,其余的磁珠纯化与蛋白制样步骤同分组一。
1.4 Western blot实验检测GST标签蛋白和S-tag标签蛋白表达
制备10%SDS-PAGE胶,取20 μl已经制备好的蛋白样本加入各孔,以80 V使蛋白下降至分离胶,然后转为110 V继续电泳,使蛋白跑到底以后,通过预染的Marker对胶块进行修正切小。按照顺序将滤纸、胶块、膜、滤纸平铺在半干转仪上,铺膜上去以后用玻璃棒轻轻滚动,赶走气泡,然后夹成“三文治”状。套上转膜盖板,以23 V进行半干转,总长为40 min。将半干转后的膜用TBST进行漂洗后,以TBST配制的5%的脱脂牛奶进行常温封闭,封闭时间为2 h。TBST漂洗3次,每次5 min,随后根据实验需求孵育兔抗GST-Tag抗体(稀释比1 ∶1 000)或小鼠抗S-Tag抗体(稀释比1 ∶1 000)抗体,根据膜的大小适量调整孵育抗体的量,4 ℃孵育18 h,去除一抗后,TBST漂洗3次,每次5 min,然后使用辣根过氧化物酶标记山羊抗兔/小鼠IgG(H+L)(稀释比1 ∶5 000)抗体常温孵育1 h,去除二抗后,TBST漂洗5次,每次5 min。加入发光液A+B后用化学成像系统机器进行显影。
2 结果
2.1 OGG1与Smad7体外相互作用
将GST-OGG1与S-tag-Smad7在反应液共孵育处理后,预留一部分反应液将作为输入对照组,在未进行pull-down实验前,进行免疫印迹检测GST或S-tag标签蛋白,结果发现GST标签约在25 kD,S-tag-Smad7标签约在58 kD,GST-OGG1标签约在66 kD,GST-OGG1+S-tag-Smad7标签分别约在66 kD和58 kD(见图1)。剩下的一部分反应液加入GST抗体蛋白与其融合蛋白充分结合后,磁珠纯化后免疫印迹检测S-tag标签蛋白,发现单独的GST标签组、GST+S-tag-Smad7和GST-OGG1组均未发现相互作用,在GST-OGG1+S-tag-Smad7组则发现在58 kD处发生相互作用(见图1)。

Input:输入组;IB:免疫印迹;IP:免疫沉淀图1 OGG1和Smad7体外pull-down实验分析Figure 1 Interaction between OGG1 and Smad7 by pull-down assay
2.2 OGG1截段体与Smad7体外相互作用
OGG1各截段体氨基酸分区:66 kD(1-346 aa),57 kD(1-242 aa),43 kD(1-138 aa),35 kD(1-63 aa),62 kD(34-346 aa)(见图2)。

图2 OGG1各截段体分区Figure 2 Partition of truncated OGG1
将GST-OGG1不同截段体1-346 aa、1-242 aa、1-138 aa、1-63 aa和34-346 aa,与S-tag-Smad7在反应液共孵育处理后,将其反应液与洗脱液分别进行Western blot,结果发现OGG1(1-346 aa)和Smad7约在66 kD处有相互作用,OGG1(34-346 aa)与Smad7约在62 kD处有相互作用,1-242 aa、1-138 aa、1-63 aa均未与Smad7发生相互作用(见图3)。
2.3 Smad7截段体与OGG1体外相互作用
Smad7各截段体氨基酸分区:58 kD(1-428 aa),46 kD(1-308 aa),38 kD(1-240 aa),25 kD(1-128 aa)(见图4)。

图4 Smad7各截段体分区Figure 4 Partition of truncated Smad7
将S-tag-Smad7不同截段体1-428 aa、1-308 aa、1-240 aa和1-128 aa分别与GST-OGG1(34-346 aa)在反应液共孵育处理后,将其反应液与洗脱液分别进行Western blot,结果发现1-428 aa、1-308 aa、1-240 aa都可以与GST-OGG1(34-346 aa)相互作用,它们分别的相互作用位置约为58 kD、46 kD和38 kD,但1-128 aa并不与GST-OGG1(34-346 aa)发生相互作用(见图5)。
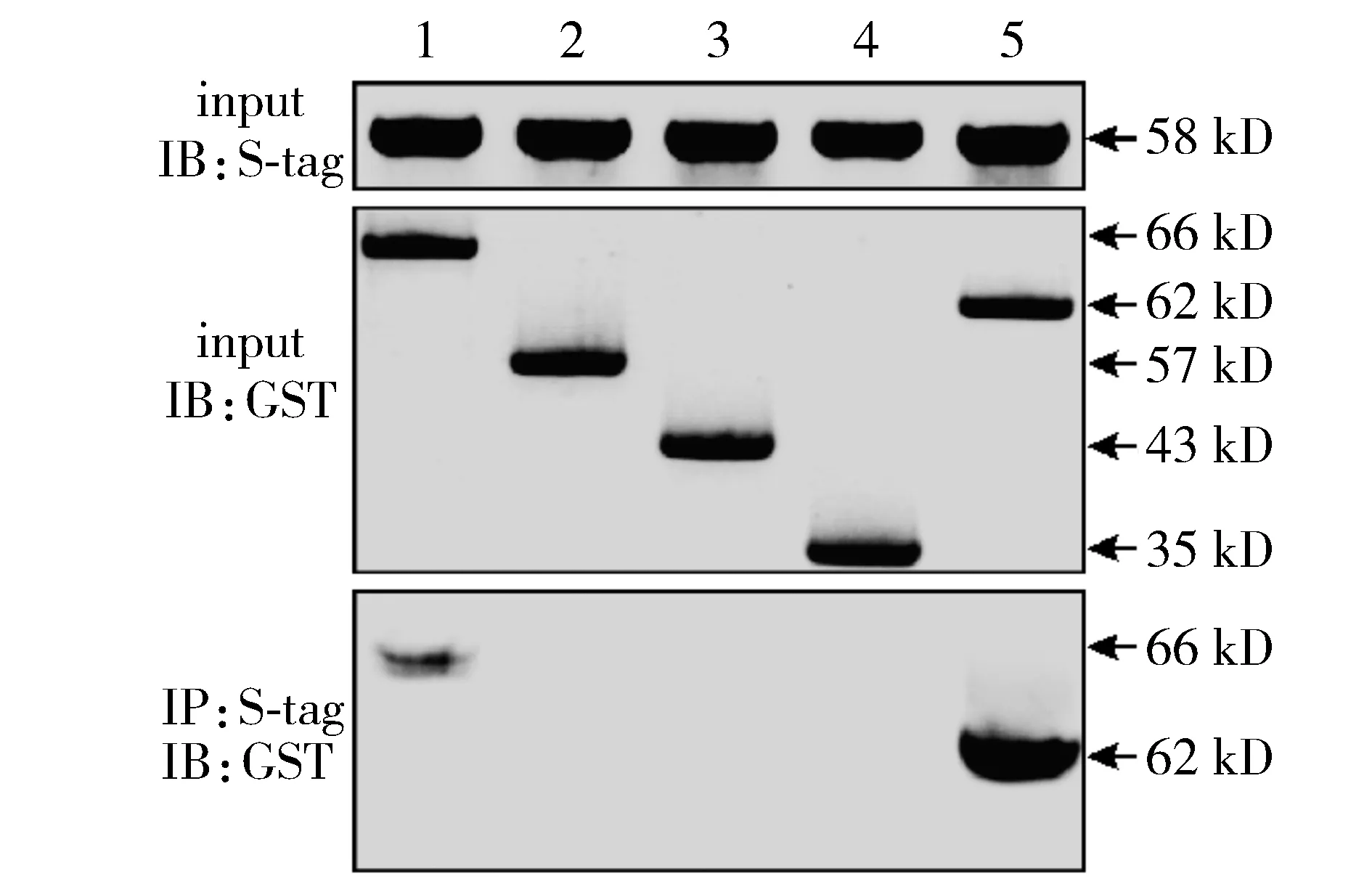
1.GST-OGG1(1-346 aa)+S-tag-Smad7;2.GST-OGG1(1-242 aa)+S-tag-Smad7;3.GST-OGG1(1-138 aa)+S-tag-Smad7;4.GST-OGG1(1-63 aa)+S-tag-Smad7;5.GST-OGG1(34-346 aa)+S-tag-Smad7图3 不同OGG1截段体和Smad7体外pull-down实验分析Figure 3 Interaction between different truncated OGG1 and Smad7 by pull-down assay

1.S-tag-Smad7(1-428 aa)+GST-OGG1(34-346 aa);2.S-tag-Smad7(1-308 aa)+GST-OGG1(34-346 aa);3.S-tag-Smad7(1-240 aa)+GST-OGG1(34-346 aa);4.S-tag-Smad7(1-128 aa)+GST-OGG1(34-346 aa)图5 不同Smad7截段体和OGG1(34-346 aa)体外pull-down实验分析Figure 5 Interaction between different truncated Smad7 and OGG1(34-346 aa) by pull-down assay
3 讨论
有研究表明,OGG1能防止石棉诱导的线粒体氧化应激所导致的肺泡上皮细胞(AEC)凋亡,改善石棉引起的小鼠肺纤维化[7]。同时,OGG1通过调节NF-κB信号通路,促进肺泡2型上皮细胞(AEC2)的增殖和自我更新,从而缓解小鼠肺纤维化进程[8]。本项目的前期研究结果表明,OGG1分别促进了肺泡上皮细胞和肺成纤维细胞的转分化和激活过程,并且OGG1的缺失能够显著缓解博来霉素诱导的小鼠肺纤维化程度[6]。由此可见,OGG1参与调控肺纤维化的进程,但其具体作用机制尚不明确。
本次实验证实了OGG1全长蛋白与Smad7全长蛋白存在相互作用(见图1),为了进一步验证OGG1全长与Smad7全长发生相互作用的具体区域,我们构建了OGG1的5段截段体(见图2),实验证实,OGG1的1-242 aa区间截段体与Smad7全长无相互作用,而34-346 aa和1-346 aa截段体与Smad7全长存在有相互作用(见图3),提示OGG1的242-346 aa区域与Smad7全长存在相互作用。研究发现,OGG1的半胱氨酸残基在氧化应激下起不同的功能性作用,按其功能作用可分为四类:糖基化酶活性位点(C146和C255);裂解酶活性位点(C140S,C163,C241和C253);结构稳定性位点(C253)和未知功能位点(C28和C75)。其中当结构稳定性位点(C253)突变为亮氨酸或者异亮氨酸时,会严重降低OGG1的催化活性,其次,糖基化酶活性位点C255突变比C146突变更加影响OGG1的糖基化酶活性[9,10]。本实验发现,OGG1的242-346 aa区域与Smad7全长存在相互作用,且该区域包含有C253和C255位点,提示该位点除维持结构稳定活性和糖基化酶活性外,还可以通过与Smad7发生相互作用,从而发挥新的病理生理功能,但其具体作用机制仍需进一步研究。
已知OGG1(242-346 aa)与Smad7全长发生相互作用,但Smad7与OGG1相互作用区域仍未知,因此,我们进一步构建Smad7的4段截段体(见图4),结果发现,除了1-128 aa不与GST-OGG1(34-346 aa)相互作用外,其他区域都与其有相互作用(见图5),侧面提示Smad7(128-240 aa)与OGG1(242-346 aa)存在相互作用。研究表明,Smad蛋白是TGF-β/Smad信号通路中的关键蛋白,在哺乳动物细胞中已经鉴定出8种Smad蛋白,并将其分类为3种亚家族:受体调控的Smads(R-Smads:Smad1、Smad2、Smad3、Smad5、Smad8)、伴侣Smads(Co-Smad:Smad4)和抑制性Smads(I-Smads:Smad6和Smad7)[11,12]。Smad7是TGF-β/Smad信号的负性调控因子,它通过与TGF-β的I型受体(TβRI)结合,从而抑制TGF-β信号通路;其次,它还能通过其MH2结构域阻断Smad2/3的激活[13]。另外,TGF-β通过结合它的Ⅱ型受体(TβRⅡ),并磷酸化激活TβRI,此时,TβRI进一步磷酸化激活Smad2/3[13]。本研究结果初步证实,OGG1截段体(242-346 aa)与Smad7截段体(128-240 aa)间存在相互作用,因此提示OGG1可能通过与Smad7的关键结构域结合,从而削弱Smad7与Smad2/3的相互竞争作用,同时阻断Smad7与TβRI结合,进而激活TGF-β/Smad2/3信号通路,发挥促进肺纤维化的作用。
本课题组前期研究发现,过表达OGG1,Smad2/3总蛋白及其磷酸化形式均表达上调,且Smad7表达也上调,同时通过细胞免疫共沉淀实验也发现,OGG1与Smad7之间存在相互作用[6]。本研究首次发现,OGG1的242-346 aa区域与Smad7的128-240 aa区域存在相互作用,提示OGG1可能通过与Smad7结合,从而削弱Smad7对Smad2/3的抑制作用。因此,参与激活Smad2/3介导的促纤维化信号,加速肺纤维化进程,本研究结果进一步完善了OGG1促肺纤维化进程的作用机制。
