长链非编码RNA与GSK⁃3β相关通路在肿瘤中相互作用的研究进展
2021-08-06谢文杰张文波邹晨
谢文杰 张文波 邹晨
镇江市第一人民医院(江苏大学附属人民医院)普外科(江苏镇江212002)
癌症已成为全球主要的健康问题之一。根据世界卫生组织的统计,在2018年全世界有1 810 万例新发病例和960 万例与癌症相关的死亡病例,癌症发生率和病死率分别为48.4%和57.3%[1]。长链非编码RNA(lncRNA)是全长超过200 个核苷酸的转录本,最初被认为是转录噪声,而近来研究表明lncRNA 可通过参与各种信号通路来影响肿瘤细胞增殖、迁移和上皮⁃间质转化(epithelial⁃mesenchymal transition,EMT)等多种生理过程[2]。GSK⁃3β是丝裂原活化蛋白激酶超家族的成员之一,作为一种多功能的丝氨酸和苏氨酸激酶,在多种细胞活动中起关键作用。最初,GSK⁃3β被认为是糖原代谢和胰岛素信号传导的关键介质,但目前证据表明GSK⁃3β是细胞调控信号通路的重要成分,被证实参与了多种人类疾病的发病,如糖尿病、癌症和双相情感疾病等[3]。lncRNA 参与多个GSK⁃3β相关通路的调控,如PI3K/Akt、Wnt/β⁃catenin、NF⁃κB,与肿瘤进展、侵袭和转移等生物学行为有关。近年来对于lncRNA 和GSK⁃3β的研究一直是个热点,前者有望成为新的癌症治疗靶标和潜在的生物标志物,后者有关的药物研发也可能成为治疗癌症的新利器。目前,对于lncRNA与GSK⁃3β相关通路相互作用在肿瘤中影响的研究逐年增加,有望将两者结合起来,以期为癌症的治疗带来新的方向。本文对近年来的有关文献展开叙述,总结相关研究并提出展望,希望为后来研究者提供一些参考。
1 GSK⁃3β相关通路
1.1 GSK⁃3β与Wnt/β⁃catenin 信号通路Wnt/β⁃catenin 信号通路的失调与多个癌症进展密切相关。GSK⁃3β是该通路的关键抑制因子。当该信号通路处于静息状态时,GSK⁃3β与肿瘤抑制性腺瘤息肉病基因产物(APC)、酪蛋白激酶1α、Axin 和β⁃catenin 组成降解复合物,该复合物可以将细胞质中的β⁃catenin 活性维持在较低水平。随后GSK⁃3β在Ser33/Ser37/Thr41 残基处磷酸化β⁃catenin,使其在蛋白酶体中降解,从而在细胞质内维持其低浓度[4]。当Wnt/β⁃catenin 信号通路激活时,Wnt 配体与其受体Frizzled 和协同受体LRP6 结合后可以活化Dishevelled 蛋白,活化的Dishevelled 蛋白能抑制GSK⁃3β活性,使得β⁃catenin 不能被GSK⁃3β磷酸化,进而导致降解复合物分解。β⁃catenin 以Dishevelled 蛋白依赖的方式从降解复合物中分离出来。这一过程导致细胞质内的β⁃catenin 积累,随后进入细胞核并与T 细胞转录因子/淋巴样增强因子(TCF/LEF)结合,从而激活Wnt 的转录程序及靶基因,如c⁃Myc、cyclin D1、MMP⁃7 等,这些靶基因参与癌症的发生发展[5]。
1.2 GSK⁃3β与PI3K/Akt 信号通路PI3K/Akt 信号通路是癌症中常见的通路之一,与癌症进展关系密切,如结肠癌[6]。PI3K/Akt 信号通路可以通过酪氨酸激酶生长因子受体和细胞膜上的小G 蛋白而被激活。PI3K 活化能使磷脂酰肌醇⁃3,4⁃二磷酸(PIP2)磷酸化,然后转化为磷脂酰肌醇⁃3,4,5⁃三磷酸(PIP3)。PIP3 作为第二信使,通过直接结合Akt 的PH 结构域来募集和激活Akt。Akt 活化后能磷酸化GSK⁃3β的Ser9 位点并使其失活,失活后的GSK⁃3β减少细胞质中的β⁃catenin 降解,β⁃catenin 在细胞质中大量聚集,随后从细胞质进入细胞核内与各类生长因子相互作用,促进转录进程[7]。研究[8]表明,GSK⁃3β上游的磷酸酶对Akt 活性有负性调节作用,而Akt 也可以反过来负性调节GSK⁃3β。因此,GSK⁃3β或可作为肿瘤抑制因子,参与PI3K/Akt 信号通路来抑制肿瘤进展。
1.3 GSK⁃3β与NF⁃κB 信号通路NF⁃κB 是一种进化保守的转录因子家族之一,可调控与肿瘤发生有关的多种基因[9]。NF⁃κB 信号通路的激活首先是IκB 激酶(IKK)复合物的激活,该复合物由IκB 激酶α、IκB激酶β和NF⁃κB必需调节蛋白(NEMO)组成。IKK 激活后,IκB 被磷酸化,随后靶向蛋白酶体降解,从而在细胞质中释放大量NF⁃κB。活化的NF⁃κB向细胞核内转运,与细胞核内的转录因子AP⁃1 和Ets 等结合以及与DNA 分子目的基因的结合位点相互作用,诱导目的基因表达,进而参与转录调控[10]。GSK⁃3β能磷酸化NEMO 的氨基酸位点,使其稳定性和活性增强来提高NF⁃κB的活性。GSK⁃3β失活使NF⁃κB 活性降低,导致NF⁃κB 不能参与诱导炎症和转移的Bcl⁃2 和X⁃linked等基因转录[11]。总之,GSK⁃3β和NF⁃κB 活性下降导致癌细胞增殖和侵袭能力降低,从而抑制肿瘤进程。
1.4 GSK⁃3β与Notch、Hedgehog(Hh)信号通路Notch 信号参与许多重要的细胞过程,如肿瘤的增殖分化[12]。Notch 信号的激活导致Notch 的逐步分解,并释放Notch 细胞内结构域(NICD),NICD 转运到细胞核中,然后通过与其他转录因子和染色体蛋白的相互作用来调节基因表达。而GSK⁃3β可以在S/TPS/T 处使NICD 磷酸化,从而调节NICD 稳定性、核易位和转录活性[13]。此外,Hh 通路成分异常表达于多种人类疾病中,包括癌症和其他发育性疾病。Hh 信号激活通过Hh配体与跨膜受体PTCH 的结合将细胞表面信号转导子(SMO)从内吞囊泡释放到细胞表面,随后发生融合抑制子(SUFU)的分解和转录因子(Gli)核易位,从而激活下游基因的转录,包括Gli1、Gli2、PTCH1 和Bcl⁃2[14]。GSK⁃3β是Hh 通路的负性调控因子,通过磷酸化后降解SUFU 和Gli 来调控Hh 信号通路[15]。
2 lncRNA 与GSK⁃3β相关通路在不同肿瘤中的作用
2.1 胃癌胃癌是全球第五大最常见的癌症,当前的挑战是找到侵入性较小的早期检测工具以及将分子生物学的最新发现转化为对胃癌患者的有效治疗[16]。胃癌中lncRNA 与GSK⁃3β通路相互作用对肿瘤的发生发展起着关键作用。例如本课题组发现的LINC01225[17],其高表达水平可使Wnt1的异常表达和GSK⁃3β的表达下调而激活Wnt/β⁃catenin 信号通路促进EMT 过程,发挥促癌作用。此外,NEAT1[18]、UCA1[19]同样被发现在胃癌中高表达,通过不同通路影响胃癌细胞的生物学行为。机制上,NEAT1 过表达后可上调miR⁃17 并增加PI3K、Akt 和GSK⁃3β的磷酸化水平,从而激活PI3K/Akt 通路来提高胃癌细胞增殖和迁移能力。UCA1 可通过miR⁃182 来调节TIMP2,从而激活PI3K/Akt/GSK⁃3β和NF⁃κB 信号通路来促进胃癌细胞的增殖、迁移并诱导其凋亡。另外,YANG 等[20]发现LINC00665 在胃癌表达下调。它可以失活Wnt 信号使GSK⁃3β的表达上调,而β⁃catenin 和cyclinD1 被抑制,进而抑制肿瘤的增殖并诱导其凋亡。由此可见,lncRNA 可参与GSK⁃3β相关通路的调控影响胃癌的发生发展。
2.2 肝癌肝癌是全世界与癌症相关死亡的第三大主要原因,其发病与多种分子途径有关[21]。lncRNA 在多种途径中起着至关重要的作用。一方面,肝癌中高表达的lncRNA 有促癌作用。例如,H19 与miR⁃675 可显著提高Akt 和Cdc25A 的活性,降低GSK⁃3β的活性,从而促进肝癌细胞的迁移和侵袭[22]。SNHG5 的高表达与肿瘤大小、TNM分期相关。机制上,SNHG5 通过竞争性结合miR⁃26a⁃5p 调节GSK⁃3β表达,从而激活Wnt/β⁃catenin信号通路达到致癌作用[23]。另一方面,DGCR5[24]、CADM1⁃AS1[25]在肝癌中低表达,能明显抑制肝癌的进展。其中,上调DGCR5 的表达水平可以使GSK⁃3β的表达上调以及β⁃catenin、cyclin D1 表达下调,从而使Wnt/β⁃catenin 通路失活来发挥抑癌作用。而CADM1⁃AS1 通过抑制Akt 和GSK⁃3β磷酸化,使P21、P27 和P15 表达上调以及cyclinD、cyclinE 的表达下调,从而诱导G0/G1 阻滞抑制肝癌进程。总之,肝癌中的lncRNA 的异常表达后,可通过调控GSK⁃3β通路影响癌细胞的恶性行为。
2.3 结直肠癌结直肠癌是全球第四大致命癌症,每年有近90 万人死亡[26]。lncRNA 可作为结直肠癌的早期诊断生物标志物和治疗靶点[27]。一方面,ZHENG 等[28]报道了MALAT1 在结直肠癌中高表达,并且可调节GSK⁃3β的表达,影响β⁃catenin的降解,从而调控Wnt/β⁃catenin 信号通路促进癌细胞的增殖、迁移和侵袭。同样高表达的SL⁃CO4A1⁃AS1 通过减弱β⁃catenin 与GSK⁃3β之间的相互作用来抑制β⁃catenin 的降解,从而激活Wnt/β⁃catenin 信号通路促进结直肠癌的进展[29]。另外,LINC00675 在结直肠癌组织和细胞中低表达,其通过miR⁃942 增加GSK⁃3β 的表达而抑制Wnt/β⁃catenin 信号通路,从而降低癌细胞增殖、侵袭和迁移能力[30]。
2.4 其他肿瘤除上述肿瘤外,lncRNA 与GSK⁃3β相关通路相互作用在其他肿瘤中同样也有研究。据报道,DANCR 在乳腺癌中表达上调,与肿瘤生长密切相关。机制上,DANCR 与RXRA 结合并通过GSK⁃3β 增加其Ser49/78 磷酸化来激活PIK3CA 转录,随后增强PI3K/Akt 信号传导和肿瘤发生[31]。ZEB2⁃AS1 的高表达与细胞增殖和迁移相关。ZEB2⁃AS1 被认为是位于ZEB2 附近的三阴性乳腺癌的癌基因,通过PI3K/Akt/GSK⁃3β/ZEB2信号通路上调ZEB2 表达并激活EMT[32]。有研究指出,CCAT2[33]和GAS5[34]在骨肉瘤中异常表达。前者高表达使GSK⁃3β的表达下调和β⁃catenin 的表达上调,激活Wnt/β⁃catenin 信号通路导致肿瘤的发生。后者低表达可充当miR⁃203a 的海绵,激活PI3K/Akt/GSK⁃3β信号传导并抑制NF⁃κB 信号传导,从而抑制肿瘤进展。在卵巢癌中,SNHG3[35]和MALAT1[36]的表达水平明显升高,并且两者都可通过调节GSK⁃3β的表达来激活Wnt/β⁃catenin信号通路,进而导致癌细胞的增殖和迁移。而在子宫内膜癌中,DLEU1[37]在癌组织及细胞中高表达,DLEU1 通过miR⁃490 海绵化来调节SP1 表达进而激活PI3K/Akt/GSK⁃3β信号通路促进子宫内膜癌细胞的增殖和迁移。不仅如此,ZHANG 等[38]研究发现LINC00222 在肺癌组织中表达下调,而LINC00222 过表达可以抑制癌细胞增殖、侵袭和诱导细胞凋亡来促进癌细胞的致瘤活性。其机制是LINC00222 的过表达增强了GSK⁃3β的活性,抑制Wnt/β⁃catenin 信号通路。综上,lncRNA 与GSK⁃3β相关通路相互作用在多种肿瘤中发挥着重要的调控作用,与肿瘤的发生发展及预后密切相关。本文总结了lncRNA 与GSK⁃3β相关通路在肿瘤中作用,见表1。
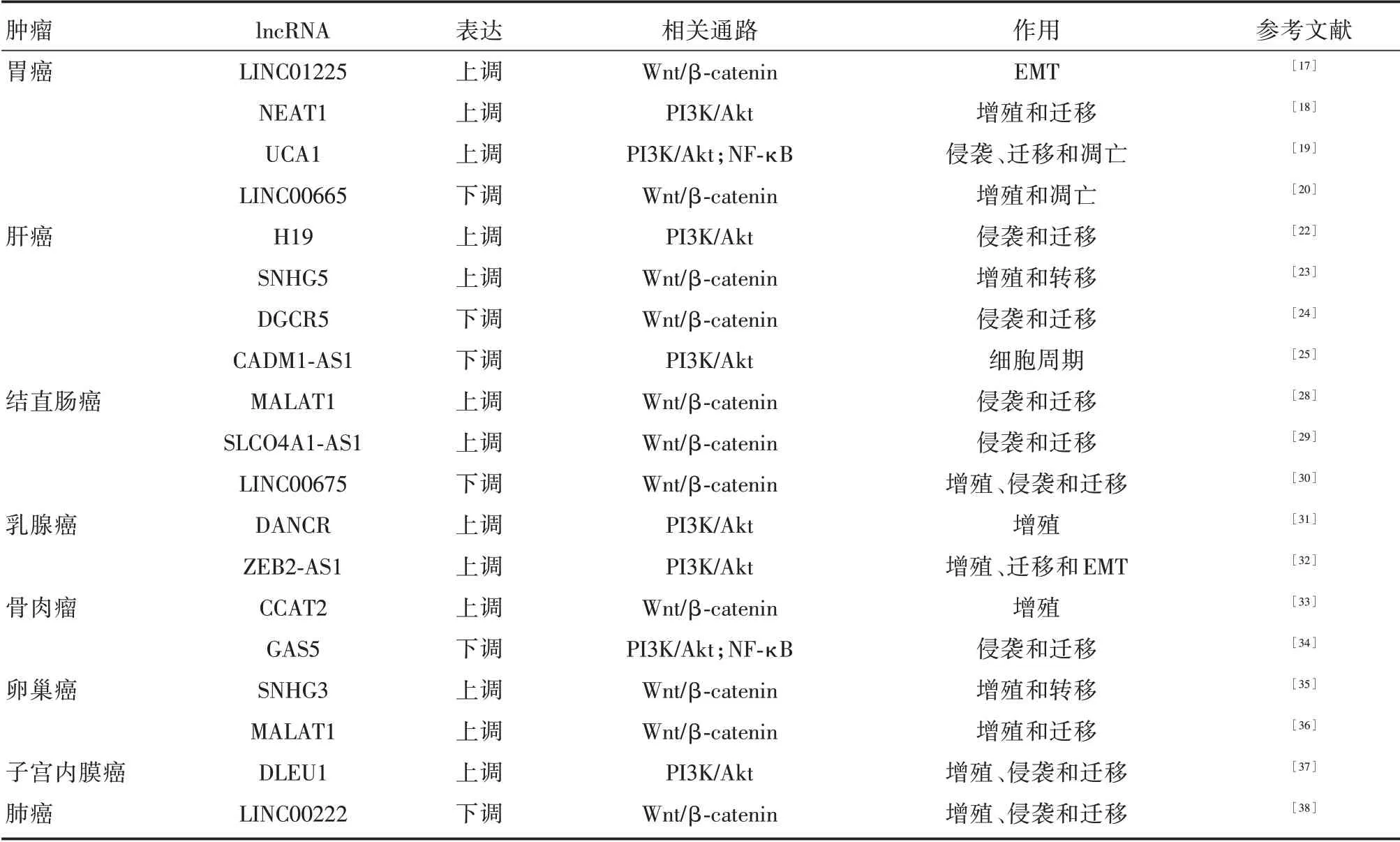
表1 lncRNA 与GSK⁃3β相关通路在肿瘤中的作用Tab.1 The role of lncRNA and GSK⁃3β related signaling pathways in cancer
3 总结与展望
本文总结了近年来有关lncRNA 与GSK⁃3β相关通路相互作用在多种肿瘤中的影响。笔者发现lncRNA 通常通过调控GSK⁃3β有关的Wnt/β⁃catenin、PI3K/Akt 和NF⁃κB 信号通路影响肿瘤的发生发展。lncRNA 通过调控GSK⁃3β的表达,影响Wnt/β⁃catenin、PI3K/Akt 信号激活抑制肿瘤进展;而调控NF⁃κB 信号通路发挥促肿瘤作用。lncRNA 如何调控前三个通路的具体机制以及三个通路之间是否存在交叉和相互调节还需进一步研究证实。而目前尚未有研究发现lncRNA 调控GSK⁃3β有关的Notch 和Hh 信号通路,lncRNA能否通过GSK⁃3β调控以上两个通路及如何调控有待进一步研究。此外,不同的lncRNA 通过相同的通路在同一肿瘤中发挥作用,他们之间是否存在协同或对抗作用,需要后续深入研究其具体机制。目前,GSK⁃3β抑制剂被发现多种抗癌药物有着协同作用,并且其用途还在不断被发现,新的抑制剂也在进一步研发用于提升其选择性[39]。深入研究lncRNA 如何调控GSK⁃3β相关通路影响肿瘤的进展以及靶向治疗药物和GSK⁃3β抑制剂,有望在多种癌症的治疗中发挥更大的作用。本课题组也进行了相关实验研究,并且也已在外文发表。对于基因的靶向治疗、GSK⁃3β抑制剂以及相关通路的阻滞剂联合应用于癌症的治疗,也许是未来lncRNA 和药物研究的新方向。
