黑曲霉孢子性状与糖化力的相关性分析
2021-08-05张凯悦来欢欢张秀红
张凯悦,来欢欢,闫 璐,赵 微,毛 健,张秀红,*
(1.山西师范大学 食品科学学院,山西 临汾 041004;2.山西师范大学生命科学学院,山西 临汾 041004;3.江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
食醋是日常生活中常见的一种调味品[1]。中国醋多以淀粉质原料生产,北方多用高粱玉米南方多用大米[2],都需要将淀粉降解为还原糖,酵母菌转化为乙醇,再由醋酸菌将乙醇氧化为醋酸[3-5]。起淀粉降解作用的糖化剂有多种,如大曲[6]、小曲[7]、药曲[8]、红曲[9]和麸曲[10]等。由多种微生物多种酶组成的大曲,糖化力相对不是很高,生产中用量大,发酵时间长,成品醋品质较好[6]。而小曲、药曲、红曲等和麸曲中微生物种类少,甚至是纯种微生物,糖化力较高,用量少,安全性高,但种曲制作技术要求比较高[11-12]。麸曲是黑曲霉纯种曲,可顶替部分大曲,也可全部使用麸曲酿醋,是一种非常重要的糖化剂[13-15]。
麸曲使用时先由黑曲霉孢子悬液接种麸皮固态培养基制成种曲,再由种曲接种麸皮制成提供糖化力的麸曲[16]。麸曲的作用是降解淀粉,最重要的生化指标就是糖化力。种曲作为生产用麸曲的种子,主要是提供大量的优质孢子,而菌种退化是不可避免的现象[17],通过黑曲霉孢子的多少及颜色判断菌种是否退化,也经常被一线生产人员用来间接判断麸曲的质量[18]。但关于黑曲霉产孢能力与糖化力相关性的研究较少,周乐民等[19]用紫外线对黑曲霉诱变育种时发现,黑曲霉a和b菌株的糖化力分别增加了1.6倍和6~8倍,但突变株在菌株形态、生长速度、孢子形成等方面都没有可观察到的变化;肖雷等[20]在分析影响黑曲霉糖化酶和蛋白酶的营养因素时发现,黑曲霉产孢子能力对于培养基营养需求与蛋白酶类似,与糖化酶关系不大,如培养基随着淀粉含量增加,可诱导糖化酶活性提高,产孢子数量却有所下降。不同黑曲霉菌株产孢能力与糖化力关系尚未见报道。本试验比较分析黑曲霉的孢子性状及其麸曲糖化力的大小的关系,为酿醋过程中麸曲质量评价提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品与试剂
麸曲:由山西省临汾市某醋厂提供。
麸皮、土豆:市售;硝酸钠、无水乙酸钠、碘化钾、戊二醛、葡萄糖、蔗糖、硫酸亚铁、磷酸氢二钾、硫酸镁、氯化钾(均为分析纯):天津市科密欧化学试剂有限公司;可溶性淀粉(生化试剂)、硝酸铵、硫酸铵、磷酸氢二铵、无水乙醇、碘(均为分析纯):天津市光复科技发展有限公司;琼脂粉(生化试剂):北京奥博星生物技术有限责任公司;乙酸异戊酯(分析纯):上海麦克林生化科技有限公司。
1.1.2 培养基
改良查氏培养基:以査氏培养基为基础,改蔗糖30 g为可溶性淀粉20 g、蔗糖10 g,补加硝酸铵2 g。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,水1 000 mL。
麸皮浸出液培养基:按照参考文献[21]配制。
麸皮固态培养基:麸皮经20目筛子过筛,留筛子内的大片麸皮。麸皮∶水=10∶9(g∶mL),搅拌均匀,置于500 mL三角瓶内,每瓶30 g,用纱布和报纸封口。
上述培养基均于121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SW-CJ-2D型双人单面净化工作台:苏州净化设备有限公司;HH-6数显恒温水浴锅:荣华仪器制造有限公司;HH.CP-01型二氧化碳细胞培养箱、YXQ-LS-50SII立式蒸汽灭菌锅:上海博讯实业有限公司;752N紫外可见分光光度计:上海仪电分析仪器有限公司;SK200生物显微镜:麦克奥迪实业集团有限公司;PHS-3C型pH计:上海雷磁仪器厂;JSM-7500F型扫描电子显微镜:日本电子株式会社。
1.3 方法
1.3.1 黑曲霉的分离纯化鉴定
称取麸曲,制成孢子悬液,稀释到合适浓度,吸取1 mL孢子悬液分别接种于改良查氏、PDA和麸皮浸出液培养基培养,30 ℃培养3~5 d,根据《真菌鉴定手册》中黑曲霉的形态描述,挑选菌落绒状呈圆形、菌丝致密、分生孢子头明显、孢子较黑或产黄色色素的单个菌落[22],以此方法纯化3~5代,观察菌落及显微特征,确认纯种曲霉后,接种于试管斜面,4 ℃冰箱内保存备用。
将分离到的10株曲霉接种到改良査氏培养基培养2 d后,对其进行18S rDNA-ITS区域测序,所得序列拼接校准对齐后,于美国国家生物信息中心(national center for biotechnology,NCBI)数据库通过基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对。
1.3.2 种曲和麸曲制备及产孢量分析
[32]Soroush Vosoughi, Deb Roy, Sinan Aral, “The spread of true and false news online”, Science, 2018, 359(6380), pp. 1146-1151.
将黑曲霉孢子接于麸皮固体培养基中搅拌均匀,30 ℃培养,16 h时摇瓶以防结块,35 h后扣瓶培养,3~5 d后40 ℃烘干即为种曲。种曲以0.5%的接种量转接到麸皮固体培养基中,搅拌均匀,30 ℃培养1~2 d,即为麸曲。
称取适量种曲于105 ℃条件下干燥3 h至质量恒定,准确称取0.2 g绝干曲,制成孢子悬液,稀释到合适的浓度,使用血球计数板直接计孢子数,最后计算孢子浓度,个/g。
1.3.3 黑曲霉分生孢子头形态观察
黑曲霉菌落培养后参考《现代食品微生物学实验技术》,收集菌体、固定、脱水,经过50 ℃干燥2 h后制样、喷金,进行电镜观察[23]。
1.3.4 黑曲霉糖化力分析
水解圈测量:根据刘茗铭等[24]的方法,略有修改。向无菌培养皿中准确倒入15 mL固体培养基,凝固后点种黑曲霉,30 ℃培养至合适的时间,滴加约7 mL稀碘液,一定时间后测量淀粉水解圈直径(D)和菌落直径(d),并且计算D/d值。
糖化力测定[25-27]:使用3,5-二硝基水杨酸(3,5-dinitrosal icylic acid,DNS)比色法测麸曲糖化力。糖化力定义为1 g绝干曲在40 ℃、pH4.6条件下,糖化淀粉1 h生成葡萄糖的毫克数,U。
2 结果与分析
2.1 黑曲霉的分离纯化及鉴定
用改良查氏、PDA和麸皮浸出液三种培养基从酿醋麸曲中分离纯化出10株曲霉,分别记为D2、D7、D11、D14、D17、N1、N3、AW1、AY1和AY2。10株曲霉菌落直径约68~80 mm,菌株N1、N3、AY1和AY2产黄色色素,其中AY2产色素最多。

表1 曲霉菌的鉴定Table 1 Identification of Aspergillus strains
2.2 10株黑曲霉产孢子能力分析
食醋酿造过程中,黑曲霉麸曲培养时是用种曲孢子接种的,黑曲霉产孢子能力直接影响生产过程。10株菌制备的种曲颜色明显不一致,菌株AY1、AY2和N1颜色较浅呈淡黄色,其余明显转为黑色,深浅略有不同。10株黑曲霉制备种曲产孢量比较见图1。从图1可知,菌株AW1、N3、D11、D2制备种曲产孢量较多,分别为9.55×109个/g、9.35×109个/g、8.97×109个/g和8.8×109个/g,两者之间没有显著性差异(P>0.05);菌株AY1、AY2制备种曲产孢量较少,分别为1.95×108个/g和4.13×108个/g。
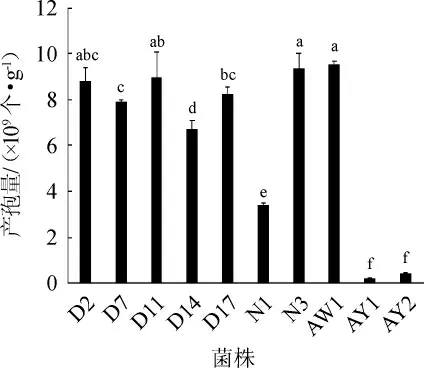
图1 10株黑曲霉制备种曲产孢量对比Fig.1 Comparison of spore yield of 10 Aspergillus niger strains in Zhongqu
2.3 黑曲霉分生孢子头形态观察
进一步用电镜观察孢子较多的AW1和N3,孢子较少的AY1和AY2的分生孢子头,结果见图2。由图2可知,AW1和N3的分生孢子头略大一点,小梗紧实,AY1和AY2的分生孢子头略小,小梗较松散,N3有很多孢子释放后留下的小孔。

图2 黑曲霉菌株AW1、N3、AY1、AY2分生孢子头微观形态Fig.2 Microscopic morphology of conidia head of Aspergillus niger strains AW1,N3,AY1 and AY2
2.4 10株黑曲霉糖化力分析
用水解圈法定性分析了10株黑曲霉的糖化力,计算其水解圈与菌落直径比(D/d),结果见表2。由表2可知,菌株AY1、N3的D/d值最高,分别为2.364、1.286。

表2 10株黑曲霉的D/d值Table 2 D/d value of 10 strains of Aspergillus niger
把10株黑曲霉制成麸曲,30 ℃培养36 h后测量糖化力大小,结果见图3。由图3可知,菌株AY1、N3的糖化力最高,分别为3158.2 U、2991.9 U;菌株D2最低,仅为1 426.5 U;定量分析结果整体与定性分析的水解圈/菌落直径比相符。但是高糖化力菌株与产孢子多的菌株没有表现出相关性,与周乐民等[19-20]的研究结果一致;推测糖化酶基因与孢子形成基因单独存在,互不影响。
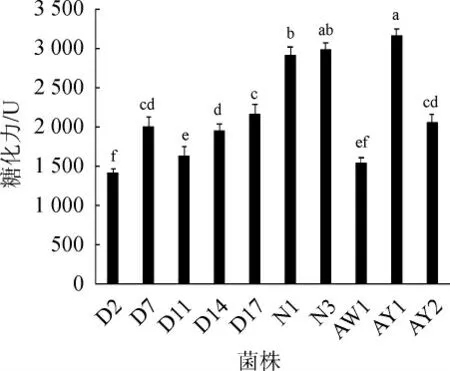
图3 10株黑曲霉制备麸曲糖化力对比Fig.3 Comparison of saccharifying power of Fuqu produced by 10 Aspergillus niger strains
3 结论
麸曲醋酿造中是用纯种黑曲霉麸曲作为糖化剂,实际生产中由于连续传代及种曲的开放式培养,很容易导致菌种退化或污染。为了研究酿醋用黑曲霉产孢能力与糖化力的相关性,从酿醋麸曲中分离纯化鉴定了10株黑曲霉,比较了10株黑曲霉种曲的颜色,定量分析其产孢能力。结果表明,菌株AW1、N3、D11、D2种曲颜色较黑,产孢量较多,分别为9.55×109个/g、9.35×109个/g、8.97×109个/g和8.8×109个/g,而AY1、AY2种曲颜色浅,产孢量较少,分别为1.95×108个/g和4.13×108个/g;用电镜观察产孢能多的AW1和N3,以及产能孢少的AY1和AY2的分生孢子头,前者分生孢子头略大一点,小梗紧实,后者分生孢子头略小,小梗疏松。
用水解圈定性分析10株黑曲霉糖化力时,水解圈与菌落直径比(D/d)较大的菌株为AY1和N3,较小的为D2和D11,其D/d比值分别为2.364、1.286、1.091、1.128;定量分析结果与定性分析吻合,糖化力大的为AY1、N3,其糖化力分别为3 158.2 U、2 991.9 U,糖化力小的仍然是D2,仅有1 426.5 U。
结合10株黑曲霉产孢能力和糖化力发现,菌株N3产孢子较多,糖化力也较高,但菌落长势快、孢子多且黑的菌株D2糖化力却比较低;菌落长势慢、孢子不明显的菌株AY1糖化力又比较高,可见产孢能力和糖化力是黑曲霉两个独立的性状,并不能简单根据黑曲霉孢子的多少和颜色来判断其糖化力高的大小;实际生产中还需要专业人士用专门方法对麸曲糖化力分析以判断麸曲质量。
