西藏牦牛粪和乳源中益生菌的筛选与鉴定
2021-08-05王帅静刘玲彦谈亚丽肖泽涛王庆宇裴宇鹏冯雪娜
王帅静,李 啸,2 *,刘玲彦,谈亚丽,肖泽涛,王庆宇,裴宇鹏,冯雪娜
(1.三峡大学生物制药学院 中国轻工业酵母功能重点实验室,湖北 宜昌 443002;2.安琪酵母股份有限公司 湖北省酵母功能重点实验室,湖北 宜昌 443003;3.安琪生物集团有限公司 湖北省酵母功能重点实验室,湖北 宜昌 443003)
益生菌即食用者通过摄取适当的量,并对其身体健康有益处的微生物统称[1-2]。乳酸菌作为一种优良益生菌,具有改善宿主的肠道环境、抑制有害菌的生长[3-4]、提高免疫力[5]、调节肠道黏膜屏障[6]、降低胆固醇含量[7]等优点,有益于宿主身体健康[8]。同时,益生菌凭借其安全、可靠及性能优良等特点在疾病的预防、治疗和重症修复过程中起着重要作用[9-11]。由于益生菌具有良好的降胆固醇,抑制有害菌生长和重症修复等特性,所以国内外市场对益生菌的需求量每年都在稳步增长[12]。
西藏地区具有低氧、高海拔及昼夜温差大等特点,有利于筛出抗逆性能较好的工业菌株。咸天成等[13]以保水率、酸化能力和乳清析出率等指标,从西藏藏灵菇中筛选出改善牦牛奶营养价值的杆菌Q5;杜琨[14]采用牛津杯法于西藏高原酸奶中筛选出能够抑制金黄色葡萄球菌(Staphylococcus aureus)的乳酸菌。目前已有从发酵食品及肠道中筛选出优良益生菌菌株并成功应用于工业生产[15-16],但是我国益生菌市场上抗逆性能较好的核心工业化菌株相对较少。因此,从西藏地区筛选功能性益生菌并对其抗逆性进行研究具有重要意义。
本研究采用钙透明圈法从西藏地区牧民家奶酪、牦牛奶、奶牛粪等样品中分离、筛选益生菌株,采用形态观察及分子生物学技术进行鉴定,并对所筛选出的益生菌的生长特性、产酸能力、胆盐、酸、人工胃液耐受性能及抑制大肠杆菌(Escherichia coli)能力进行分析,以期得到耐性比较好、具有工业化潜力的益生菌菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
公牛粪、母牛粪、犏牛粪、奶牛粪、牛犊粪、牦牛奶、犏牛奶、牧民家奶酪:西藏地区。
1.1.2 菌株
大肠杆菌(Escherichia coli)标准菌株ATCC25922、干酪乳杆菌(Lactobacillus casei)GL、植物乳杆菌(Lactobacillus plantarum)PL、鼠李糖乳杆菌(Lactobacillus rhamnosus)SLT:安琪酵母股份有限公司。
1.1.2 试剂
细菌通用引物27F、1492R:武汉奥科鼎盛生物科技有限公司;2×T5 Super聚合酶链式反应(polymerase chain reaction,PCR)Mix:北京擎科生物科技有限公司;牛胆盐(生化试剂)、胃蛋白酶(3 000 U/g)、巯基乙酸钠(分析纯):上海源叶生物科技有限公司。
1.1.3 培养基
MRS固体培养基、MRS肉汤培养基(自然pH 6.2):北京陆桥技术股份有限公司;胆盐乳糖(bile lactose,BL)固体培养基:北京索莱宝科技有限公司;SL固体培养基:山东拓普生物工程有限公司。
LB培养基:胰蛋白胨10 g/L,氯化钠10 g/L,酵母提取物5 g/L,121 ℃高压蒸汽压灭菌20 min。固体培养基中添加20 g/L琼脂粉。
1.2 仪器与设备
GDS-8000凝胶成像仪:美国UVP Biolmaging System公司;FP-1100-C Bioscreen全自动生长曲线分析仪:芬兰Bioscreen有限公司;5418G型离心机:德国Eppendorf公司;XSP-2C显微镜:上海长方光学仪器有限公司;TDL-40B离心机:上海安亭科学仪器厂;SP-754紫外可见光分光光度计:上海光谱仪器有限公司。
1.3 方法
1.3.1 菌株种子液制备
乳酸菌种子液培养:挑取保藏于MRS斜面上的乳酸菌单菌落接种于MRS肉汤培养基中,于37 ℃静置培养24 h。
大肠杆菌标准菌株ATCC25922种子液的培养:挑取保藏于LB斜面上的大肠杆菌单菌落接种于LB培养基中,于37 ℃、200 r/min条件下培养24 h。
1.3.2 乳酸菌的分离纯化与筛选
分别取1 g样品于10 mL无菌水中混匀,按10倍梯度依次稀释至10-7,取稀释度分别为10-5、10-6、10-7的菌悬液涂布于含0.2%碳酸钙的MRS、BL和SL固体培养基中[17-18],于37 ℃条件下静置培养24~48 h。培养结束后以平板上菌落直径与透明圈直径比为指标对产酸菌株进行初步筛选;采用平板划线法对筛选所得的菌株进行多次纯化,以菌落生长情况(表面乳白色)及细胞形态(杆状)为指标,对样品中的乳酸菌进行复筛。
1.3.3 乳酸菌菌株的鉴定
形态观察:将分离菌株接种到MRS固体培养基平板上,37 ℃培养48 h,观察菌落形态与显微形态[19]。
分子生物学鉴定:采用十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)法[19-20]提取细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')[21]为引物进行PCR扩增。PCR扩增体系:mix 25 μL,引物27F 2 μL,引物1492R 2 μL,DNA模板1 μL,双蒸水(ddH2O)20 μL。PCR扩增条件:98 ℃预变性3 min;98 ℃变性10 s,58 ℃退火10 s,72 ℃延伸45 s,共30个循环;72 ℃再延伸10 min。PCR扩增产物经0.8%琼脂糖凝胶电泳法检测合格后,送至奥科鼎盛有限公司测序。将测序结果提交至美国国家生物技术信息中心(national center for biotechnologyinformation,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对搜索[22-23],若与已知的菌株同源性达97.5%,则认为是同一种[23]。
1.3.4 乳酸菌的生长及代谢特性研究
(1)生长曲线的测定
将乳酸菌的种子液按5%(V/V)的接种量分别接种至装有MRS肉汤培养基的微孔板(100孔)中,将微孔板置于全自动生长曲线分析仪中,于37 ℃培养,直到乳酸菌生长至稳定期为止,期间每隔2 h测定OD600nm值,对不同菌株的生长曲线进行绘制。
(2)产酸能力测定[24]
将乳酸菌的种子液按5%(V/V)的接种量分别接种至MRS肉汤培养基中,于37 ℃静置培养24~48 h,培养过程中,每隔3 h取适量发酵液于10 000 r/min离心5 min,取上清液测pH值和乳酸含量。
(3)耐受性分析
胆盐耐受性:将乳酸菌的种子液按5%(V/V)的接种量分别接种至含不同胆盐(0、0.2%、0.4%、0.6%)[18]的MRS肉汤培养基中,置于微孔板(100孔)中,将微孔板置于全自动生长曲线分析仪中,于37 ℃培养48 h,期间每隔2 h测定OD600nm值,对菌株在不同浓度胆盐下的生长情况进行研究。
酸耐受性:将乳酸菌的种子液按5%(V/V)的接种量接种至含不同pH(2、3、4、自然(6.2))的MRS肉汤培养基的微孔板(100孔)中,将微孔板置于全自动生长曲线分析仪中,于37 ℃培养48 h,期间每隔2 h测定OD600nm值,对菌株在不同pH值下的生长情况进行研究。
人工胃液耐受性:将乳酸菌的种子液按5%(V/V)的接种量接种至MRS肉汤培养基中,于37℃条件下静置培养24~48 h取发酵液,测定菌株耐人工胃液(0.20%NaCl、0.30%胃蛋白酶,pH 2.5)的能力[18],采用平板计数法测定活菌数[18],并计算存活率,其计算公式如下:

式中:SLAB为培养2 h的活菌数,CFU/mL;SMRS为培养0 h的活菌数,CFU/mL。
(4)抑制大肠杆菌的能力
将乳酸菌的种子液按5%的接种量接种至MRS肉汤培养基中,于37 ℃条件下静置培养24~48 h,培养结束后,取发酵上清液为试验组,SLT、MRS培养基和水均为对照组,采用牛津杯法测抑菌圈直径[25]。
2 结果与分析
2.1 乳酸菌菌株的分离及筛选
从样品中共分离纯化出76株细菌,通过革兰氏染色及钙透明圈法筛选出25株疑似乳酸菌。部分典型菌株的菌落及细胞形态见图1,25株疑似乳酸菌的菌落及细胞形态描述见表1。
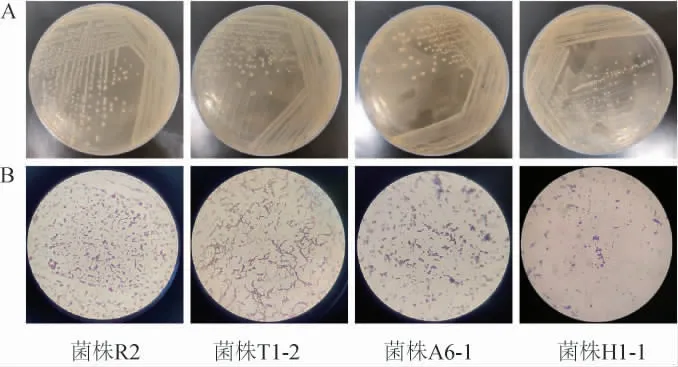
图1 典型乳酸菌菌株的菌落形态(A)及细胞特征(B)Fig.1 Colony morphology (A) and cell characteristics (B) of typical lactic acid bacteria strains

表1 乳酸菌菌株的菌落形态及细胞特征描述Table 1 Description of colony morphology and cell characteristics of lactic acid bacteria strains
由图1及表1可知,筛选得到的25株乳酸菌菌株的菌落均呈圆形、有光泽、表面光滑、有光泽、边缘规则、微凸起、不透明,细胞呈球状、杆状、链球状3种形态。
2.2 乳酸菌菌株的鉴定
25株乳酸菌菌株的鉴定结果见表2。

表2 25株菌株的分子生物学鉴定结果Table 2 Molecular biology identification results of 25 strains
由表2可知,25株乳酸菌中7株为益生菌,包括2株鼠李糖乳杆菌(Lactobacillus rhamnosum)(T1-1和T1-2);4株副干酪乳杆菌(Lactobacillus paracasei)(T1-5、T1-7、T1-9、T1-d);1株植物乳杆菌(Lactobacillus plantarum)(B2);其他17株菌株为非益生菌,分别为3株食窦魏斯氏菌(Weissella cibaria);7株肠球菌(Enterococcus);6株链球菌(Streptococcus);1株微小杆菌(Exiguobacterium)。
2.3 乳酸菌菌株的生长曲线
10株乳酸菌菌株的生长曲线见图2。
由图2可知,菌株T1-1、T1-2、T1-5、T1-7、T1-9、T1-d、B2、SLT的迟滞期为0~2 h,对数生长期为2~12 h,稳定期为12~48 h。当菌株生长至稳定期,鼠李糖乳杆菌T1-1、T1-2比菌株SLT的生物量多;副干酪乳杆菌T1-5、T1-9、T1-d比菌株GL和T1-7的生长速度快;植物乳杆菌B2生长速度明显快于菌株SLT。这些菌株短时间生长速度快,符合工业化菌株的要求。因此,选择在生长方面具有一定优势的菌株T1-1、T1-2、T1-5、T1-9、T1-d、B2、SLT测定产酸能力。

图2 乳酸菌菌株的生长曲线Fig.2 Growth curves of lactic acid bacteria strains
2.4 乳酸菌菌株产酸能力的测定结果
以商业化菌株SLT为对照,菌株T1-1、T1-2、T1-5、T1-9、T1-d、B2的产乳酸量与发酵上清液的pH值见图3。
由图3A可知,当乳酸菌菌株发酵时间为72 h时,菌株T1-1及SLT的产乳酸能力较强,乳酸含量分别为13.58 g/L和13.46 g/L,其次是菌株T1-2、T1-5、T1-9、T1-d。而菌株B2的产乳酸能力最弱(7.14 g/L),但是由图3B可知,菌株B2的发酵液pH值最低,因此,推测菌株B2产其他有机酸的能力较强。此外,所有菌株的培养过程中,发酵液pH逐步降低(从pH6.0降低至pH4.0左右),并且结合菌株生长曲线可知,这些菌株的生长能力较高,因此,可以初步推测这些菌株的耐酸能力较高,是符合工业化生产的益生菌菌株。

图3 乳酸菌菌株产乳酸量(A)与发酵上清液的pH值(B)在发酵过程中的变化Fig.3 Changes of lactic acid yield (A) and pH value of fermentation supernatant (B) of lactic acid bacteria strains during fermentation process
2.5 乳酸菌菌株耐受性分析
2.5.1 耐酸能力测定结果
以商业化菌株SLT为对照,菌株T1-1、T1-2、T1-5、T1-9、T1-d、B2的耐酸能力见图4。

图4 乳酸菌菌株耐酸能力的测定结果Fig.4 Determination results of acid resistance ability of lactic acid bacteria strains
由图4可知,当MRS肉汤培养基的初始pH值为2和3时,7株乳酸菌株几乎不生长;当初始pH值为4和6.2(自然)时,这7株菌株都能生长。其中菌株B2生长能力较好,因此该菌株表现出较好的耐酸能力。
2.5.2 耐胆盐能力测定结果
以商业化菌株SLT为对照,菌株T1-1、T1-2、T1-5、T1-9、T1-d、B2的耐胆盐能力见图5。
耐胆盐试验可以模拟益生菌在人体肠道中的生长繁殖情况,在胆盐浓度越高的情况下,若菌株仍可生长,则说明该益生菌株可以在人体肠道中生存。由图5可知,菌株SLT在胆盐浓度为0.2%时生长能力较好;菌株T1-1、T1-9在胆盐浓度为0.4%时生长能力较好,而菌株T1-2、T1-5、B2在胆盐浓度为0.6%时生长能力较好,说明菌株T1-2、T1-5、B2耐胆盐能力好,比较符合工业益生菌的耐胆盐要求[26]。

图5 乳酸菌菌株耐胆盐能力测定结果Fig.5 Determination results of bile salt resistance ability of lactic acid bacteria strains
2.5.3 乳酸菌菌株耐人工胃液能力的测定结果
以商业化菌株SLT为对照,菌株T1-1、T1-2、T1-5、T1-9、T1-d、B2耐人工胃液的能力见图6。

图6 乳酸菌菌株耐人工胃液能力Fig.6 Artificial gastric juice resistance ability of lactic acid bacteria strains
由图6可知,植物乳杆菌B2在人工胃液的存活率最高为57.4%,副干酪乳杆菌T1-2在人工胃液的存活率最低为9%。这几株菌都能在人工胃液中生存,但是菌株B2相对其他菌株而言,存活率较高,比较符合益生菌的要求。
2.6 乳酸菌菌株对大肠杆菌的抑菌效果
以商业化菌株SLT为对照,MRS培养基及水为空白,菌株T1-1、T1-2、T1-5、T1-9、T1-d、B2对大肠杆菌的抑制能力见图7。

图7 乳酸菌菌株对大肠杆菌的抑菌效果Fig.7 Antibacterial effect of lactic acid bacteria strains on Escherichia coli
由图7可知,与对照组相比,处理组中的大肠杆菌指示菌生长被明显抑制,且抑菌圈明显,说明菌株T1-1、T1-2、T1-5、T1-9、T1-d、B2的代谢产物对大肠杆菌有明显的抑制作用。其中菌株T1-2和B2具有较好的抑菌效果,抑菌圈直径分别为22.0 mm和19.5 mm。
3 结论
采用钙透明圈法从西藏地区不同来源样品中分离、筛选得到25株乳酸菌,经形态观察及分子生物学鉴定,确定7株为益生菌,分别为1株植物乳杆菌(Lactobacillus plan tarum),2株鼠李糖乳杆菌(Lactobacillus rhamnosus);4株副干酪乳杆菌(Lactobacillus paracaseium)。其中植物乳杆菌B2具有良好的生长优势、产酸能力(发酵终pH值在4左右)、耐酸(pH为4)、耐胆盐(0.6%)、耐人工胃液能力(菌株存活率为57.4%)以及抑菌效果(抑菌圈直径为19.5 mm)。本研究可为从西藏地区筛选出益生功能菌株提供一定的指导意义。
