基于网络药理学的党参-当归药对治疗间质性肺疾病的作用机制探讨
2021-08-05宋丽,张伟
宋 丽,张 伟
(1. 山东中医药大学中医学院,山东 济南 250014;2. 山东中医药大学附属医院,山东 济南 250011)
间质性肺疾病(ILD)是一类主要累及肺间质和肺泡腔,以弥漫性肺实质、肺泡炎症和间质纤维化为基本病理改变的弥漫性肺疾病[1], 临床表现为进行性加重的呼吸困难、限制性通气功能障碍伴弥散功能减低及低氧血症,影像学见双肺弥漫性病变。迄今为止,ILD的临床分类已达200余种,其中大部分病因尚不明朗,且近年来发病率呈逐年增长态势。目前ILD的治疗以糖皮质激素及免疫抑制剂、抗氧化剂等少数药物为主,这些药物在某些ILD中无明显获益甚至有害,明显影响了ILD患者的生活质量及预后。ILD属中医学“肺痹”“肺痿”范畴[2],正虚邪实,痰、瘀、毒痹阻肺络为ILD基本病机,肺虚贯穿ILD病机演变始终[3],尤其是以纤维化为突出表现的ILD后期,虽邪气大实,不可妄议攻法,缘其正气大虚也。必谨守先后天之本,默培真元,调补气血,庶几正气可支,乃可攻邪。其中脾肺两虚者,吾师张伟教授每投党参-当归药对。《素问·五藏生成》言“诸气者,皆属于肺”,气虚为肺虚之首,惟肺气充足,津血方能生化有源、运行无滞;而肺为血脏,肺血易虚、易瘀是肺固有的生理特性[4]。故以党参健运脾气,补土生金而无腻滞之弊;伍补血活血要药之当归,气生血长以鼓舞生化之源。临床观察发现,在常规处方基础上辨证增入该药对,可有效延长患者生存期,提高患者生活质量。
有鉴于党参-当归药对治疗ILD的有效成分及潜在作用机制仍不明确,本研究采用网络药理学方法,分析党参-当归药对治疗ILD的药效物质基础和潜在作用机制,建立“药对-成分-靶点-疾病”网络模式,探究该方治疗ILD所涉及的多种生物过程和信号通路,以期为ILD相关基础研究及党参-当归药对的临床合理应用提供理论依据。
1 材料与方法
1.1党参-当归药对活性化合物与靶点蛋白获取通过中药系统药理学分析平台数据库(TCMSP,http://ibts.hkbu.edu.hk/LSP/tcmsp.php)检索党参和当归的有效成分。中药在体内存在固有的吸收、分布、代谢及排泄等药物动力学(ADME)过程,为筛选潜在活性化合物,构建了包括口服生物利用度(OB)、类药性(DL)在内的综合模型以对化合物的ADME性质进行预测。本研究以数据库所建议的OB≥30%、DL≥0.18建立阈值评估候选化合物。活性化合物作用靶点也通过检索TCMSP数据库逐一配对整理获取,同时基于uniprot数据库(http://www.uniprot.org/),将得到的靶点信息进行基因名的标准化。
1.2间质性肺疾病相关靶点获取 从在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM,http://www.omim.org)、 Drugbank数据库(https://www.drugbank.ca)中检索ILD的相关靶点,重复靶点保留1个,所得靶点即为ILD相关靶点。
1.3药物-化合物-靶点-疾病网络构建 为了更合理地阐明党参-当归药对中化学成分与ILD靶点之间的关系,将“1.1”和“1.2”项结果整合,并将候选化合物与二者的靶点蛋白上传至Cytoscape 3.7.1软件,生成体现药物-化合物-靶点-疾病相互作用的四元综合网络图,以探究党参-当归药对治疗ILD的药理作用机制。
1.4药物-疾病靶点蛋白相互作用网络构建 将候选化合物的预测靶点与ILD疾病相关靶点进行映射,可明确疾病相关靶点与党参-当归药对潜在靶点之间的相互作用。即将疾病靶点与药物成分靶点通过R语言(R version 3.5.2)绘制Venn图。筛选得到的ILD-党参-当归药对活性化合物成分共同靶蛋白在STRING平台(https://string-db.org/)构建蛋白-蛋白相互作用(protein-protein interaction,PPI)网络模型,蛋白种类设置为“Homo sapiens”,最低相互作用阈值大于0.4,其他参数保持默认设置,获得PPI 网络,并利用R version 3.5.2对PPI网络中的蛋白绘制条形图。
1.5基因本体功能与靶点通路富集分析 为了说明党参-当归药对靶点蛋白在基因功能和信号通路中的作用,本研究采用David数据库(https://david.ncifcrf.gov/)对PPI网络中的蛋白质进行基因本位论(Gene Ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,利用R version 3.5.2对GO功能和KEGG通路富集分析中筛选出的信号通路等结果绘制条形图、气泡图和靶点-通路网络。
2 结 果
2.1活性化合物及靶点筛选 以OB≥30%,DL≥0.18为筛选条件,得到党参-当归药对候选化合物22个,其结果见表1。分析发现,所获得的化合物基本覆盖了党参和当归中已知的关键活性成分。如当归中β-谷甾醇beta-sitosterol可明显抑制炎症反应,对LPS所致的小鼠急性肺损伤有较好的保护作用[5]。党参中木犀草素luteolin可降低肺纤维化大鼠肺组织重量指数和羟脯氨酸含量,延缓肺纤维化进程,并抑制TGFβ1mRNA的表达[6]。在TCMSP数据库中逐一对应靶点,重复靶点仅保留1个,共得到283个化合物靶点。基于uniprot数据库进行靶点信息基因名标准化,得到188个靶点。
2.2疾病靶点获取结果 从OMIM、Drugbank数据库中分别检索ILD相关靶点,共得到3 198个相关靶点。
2.3党参-当归药对活性成分-靶点-ILD生物网络的构建及分析 利用Cytoscape软件构建化合物-靶点网络,网络中共有97个节点(其中靶点节点81个,化合物节点16个)和246条边,见图1。靶点数较多的化合物包括β-谷甾醇、豆甾醇Stigmasterol、木犀草素luteolin、大豆黄素glycitein等,推测为党参-当归药对发挥治疗ILD作用的关键化合物,体现了中药复方的多成分、多靶点互作的复杂网络关系。
2.4党参-当归药对靶点PPI网络的构建与分析将化合物靶点与3 198个ILD相关靶点进行映射,得到81个共同靶点,绘制韦恩图示如图2。为了更直观地展示党参-当归药对的作用机制,基于PPI关系,利用STRING软件构建了党参-当归药对靶点的PPI网络(见图3)。PPI 网络包含81个蛋白质节点,889条相互作用关系(连线)。根据节点的Degree绘制出了前30个关键蛋白质节点的条形图(见图4)。Degree≥50的节点包括AKT1,VEGFA,CASP3,IL-6,JUN,MAPK1,EGFR。其中,AKT1(Degree=58)、VEGFA(Degree=55)的Degree高于其他蛋白质节点,推测两种蛋白质靶点在网络中发挥了关键作用,是连通网络中其他节点的重要桥梁。

表1 党参-当归药对活性化合物基本信息
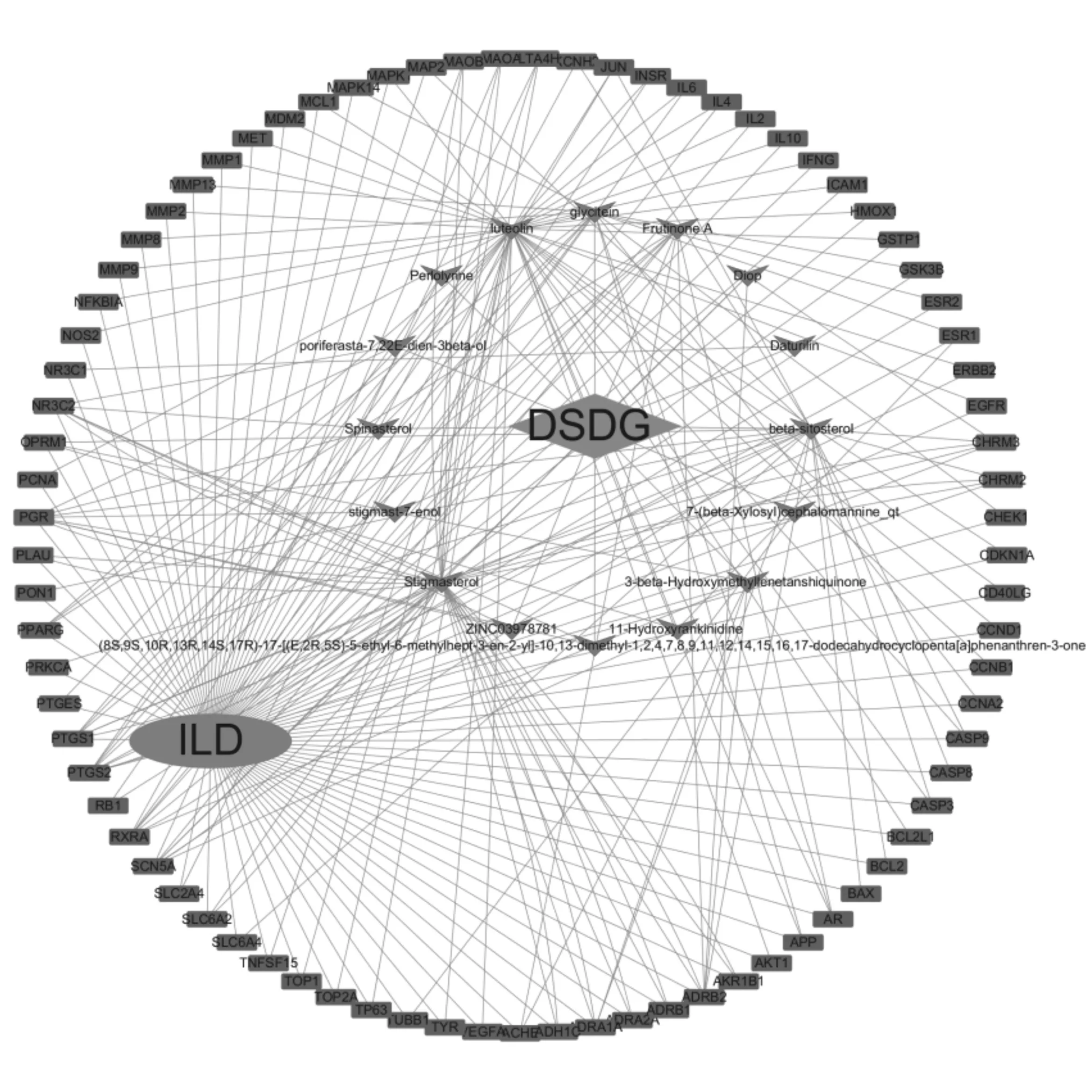
注:青色节点表示靶点;粉色节点表示疾病;红色节点表示活性分子;绿色节点表示药物。图1 党参-当归药对化合物-靶点-ILD网络
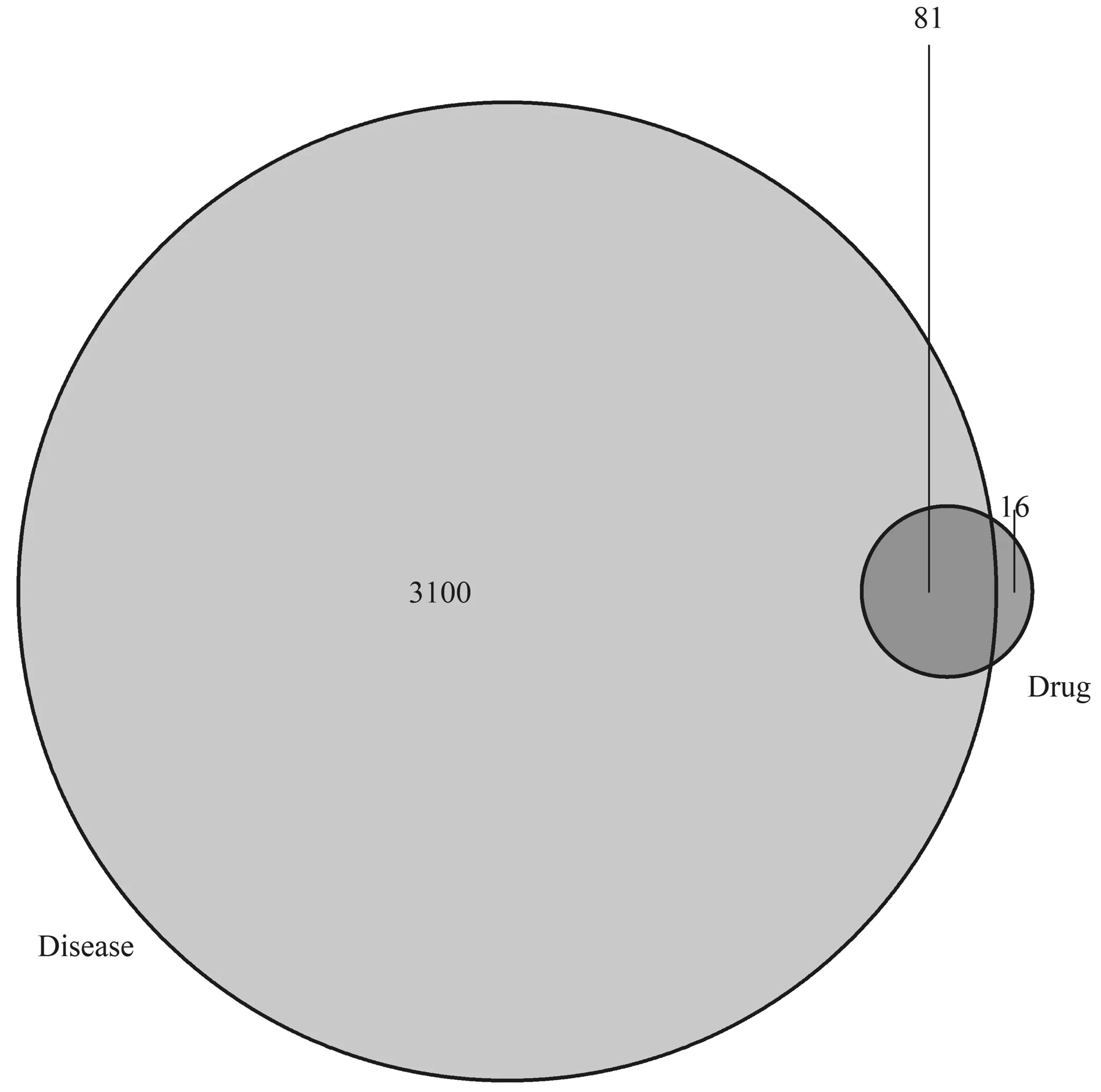
图2 党参-当归药对作用靶点与ILD相关靶点的交集基因韦恩图
2.5GO基因功能与KEGG信号通路富集分析结果 GO基因功能分析共得到生物过程101条,显著富集的生物过程有50条(P.adjust≤0.01);通路富集分析共得到KEGG信号通路136条,显著富集的通路有115条(P.adjust≤0.01),结果分别展示为柱状图、气泡图、信号通路图3部分。按P.adjust值从小到大选取前20条生物过程或通路,以柱状图从上至下排列(见图5,7);按目标基因中属于这条生物过程或通路的基因的数量从多到少选取前20条,以气泡图从上至下排列(图见6,8)。其中,Y轴代表生物过程及通路名称,柱状图X轴代表目标基因中属于这条生物过程及通路的基因的数量,气泡图X轴代表GeneRatio,即目标基因中属于这条生物过程或通路的基因的数量/背景基因集中这条生物过程或通路所有基因的数量。图中条带和气泡的颜色由P.adjust值决定,颜色从蓝色到红色反映P.adjust值从大到小;条带的长度和气泡的大小由相关联基因的数量决定,长度和面积从小到大反映相关联基因的数量从少到多。按照P.adjust值判断其可靠性,排名前10位的生物过程中与ILD有密切关系的依次是核受体活性(nuclear receptor activity)、转录因子活性(transcription factor activity)、泛素样蛋白连接酶结合(ubiquitin-like protein ligase binding)、泛素蛋白连接酶结合(ubiquitin protein ligase binding)、BH域绑定(BH domain binding)、G蛋白耦联胺受体活性(G protein-coupled amine receptor activity)、细胞因子受体结合(cytokine receptor binding)、肾上腺素能受体活性(adrenergic receptor activity),这些生物过程表明网络中ILD相关疾病靶点倾向于通过调控细胞因子受体,增强核受体活性,激活细胞转录因子,调节细胞生物信号转导,影响细胞因子分泌水平,促进蛋白质磷酸化等方式调节局部炎症与胶原沉积水平,促进肺组织局部新生血管形成及纤维化的发生(见表2)。排名前20位的通路中与ILD有密切关系的3条通路依次是IL-17信号通路(IL-17 signaling pathway)、HIF-1信号通路(HIF-1 signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway),提示党参-当归药对可以通过多通路作用于ILD,主要与氧化应激、PI3K-Akt、细胞增殖和凋亡、炎症网络调节有关(见表3及图9~11,信号通路中被干预的靶点以红色标注)。
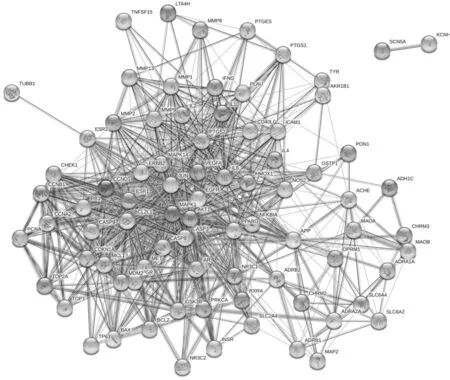
图3 党参-当归药对相关靶点的PPI网络
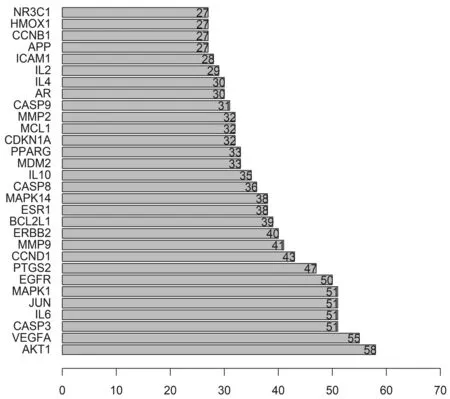
图4 PPI网络中的关键节点
3 讨 论
ILD的诊治多年来一直是极具挑战性的课题。
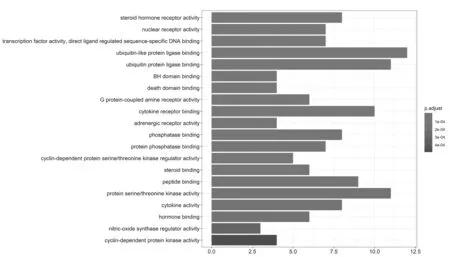
图5 党参-当归药对治疗ILD的靶点GO功能分析
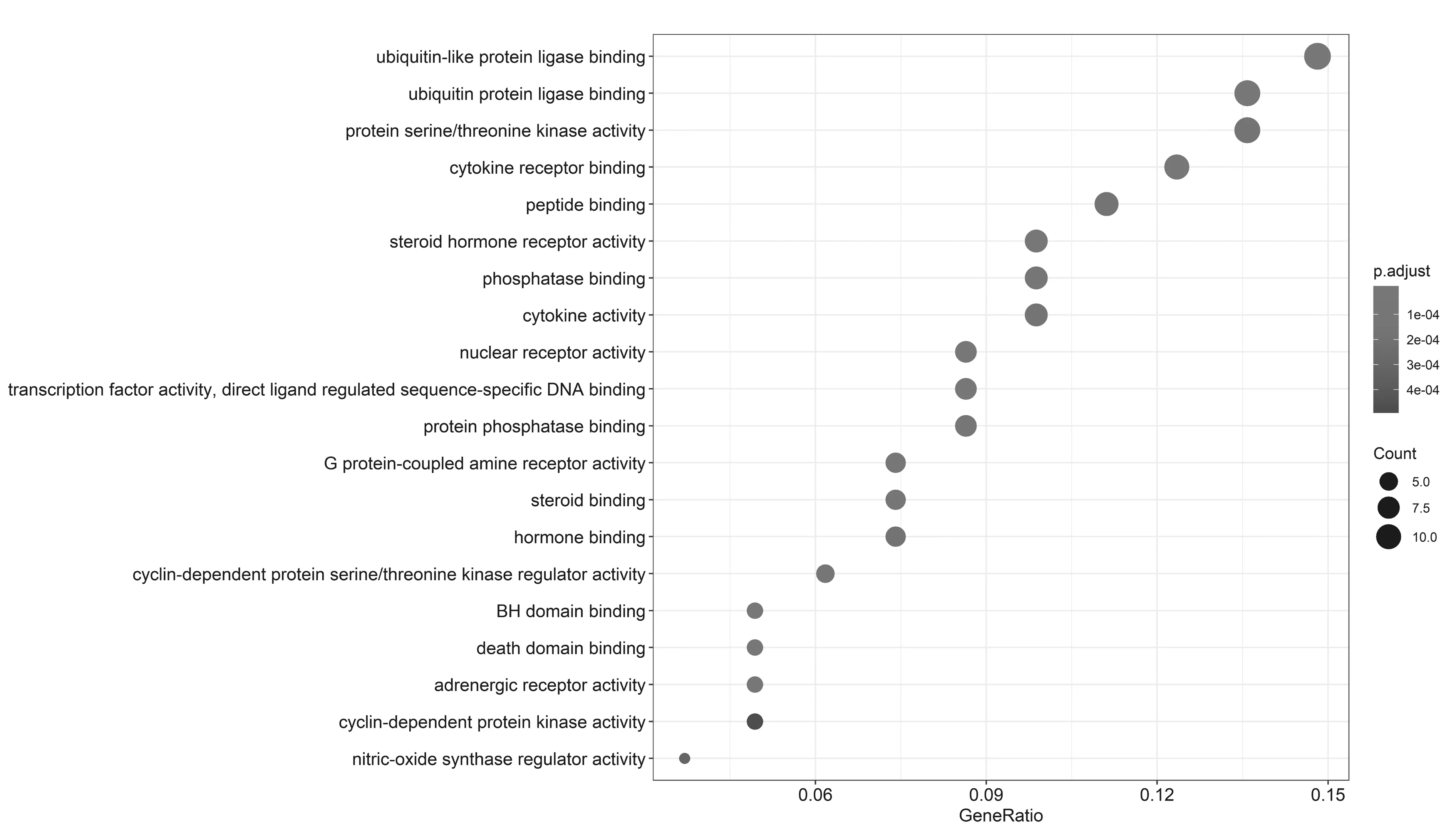
图6 党参-当归药对治疗ILD的靶点GO功能分析
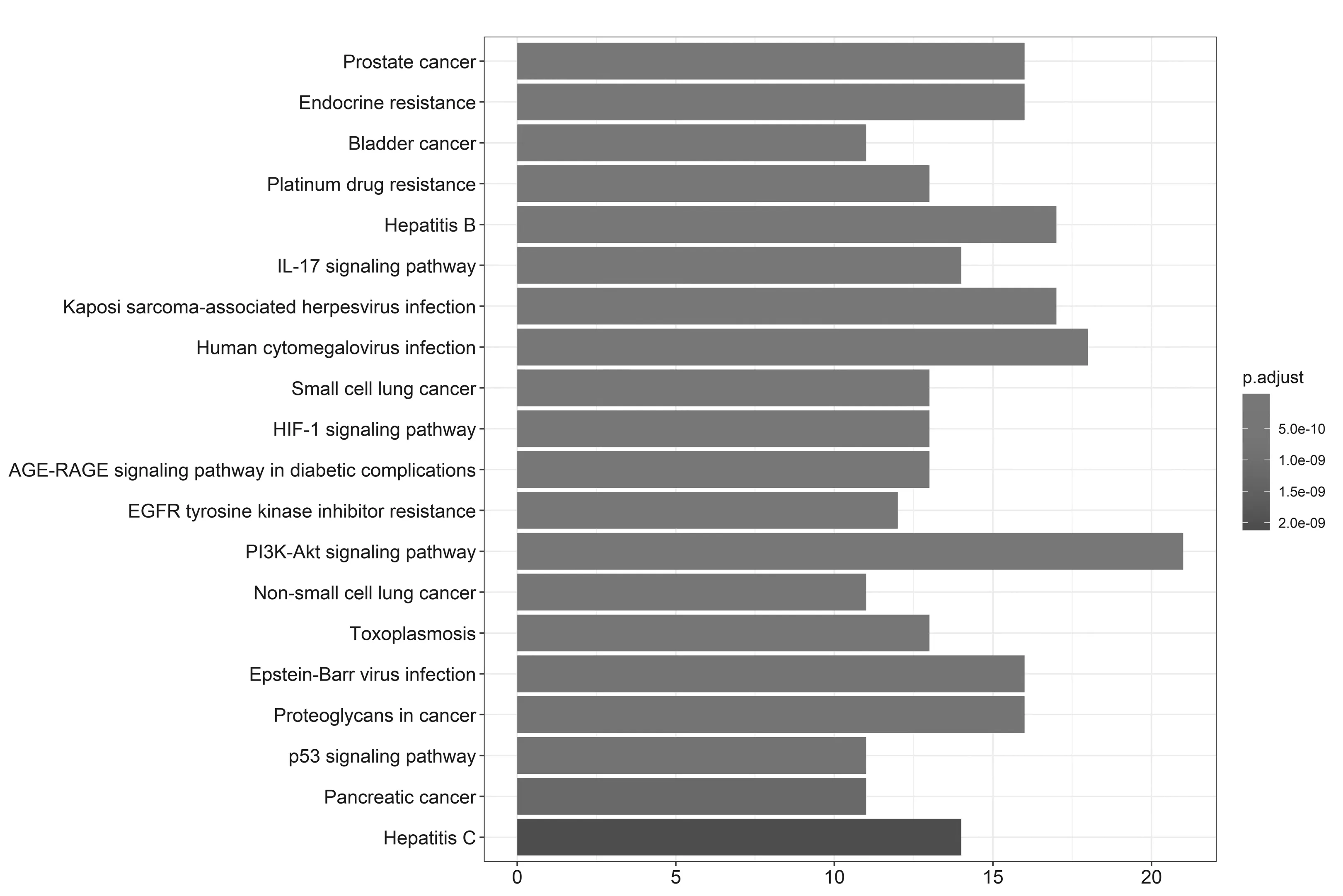
图7 党参-当归药对治疗ILD的潜在靶点KEGG通路富集分析
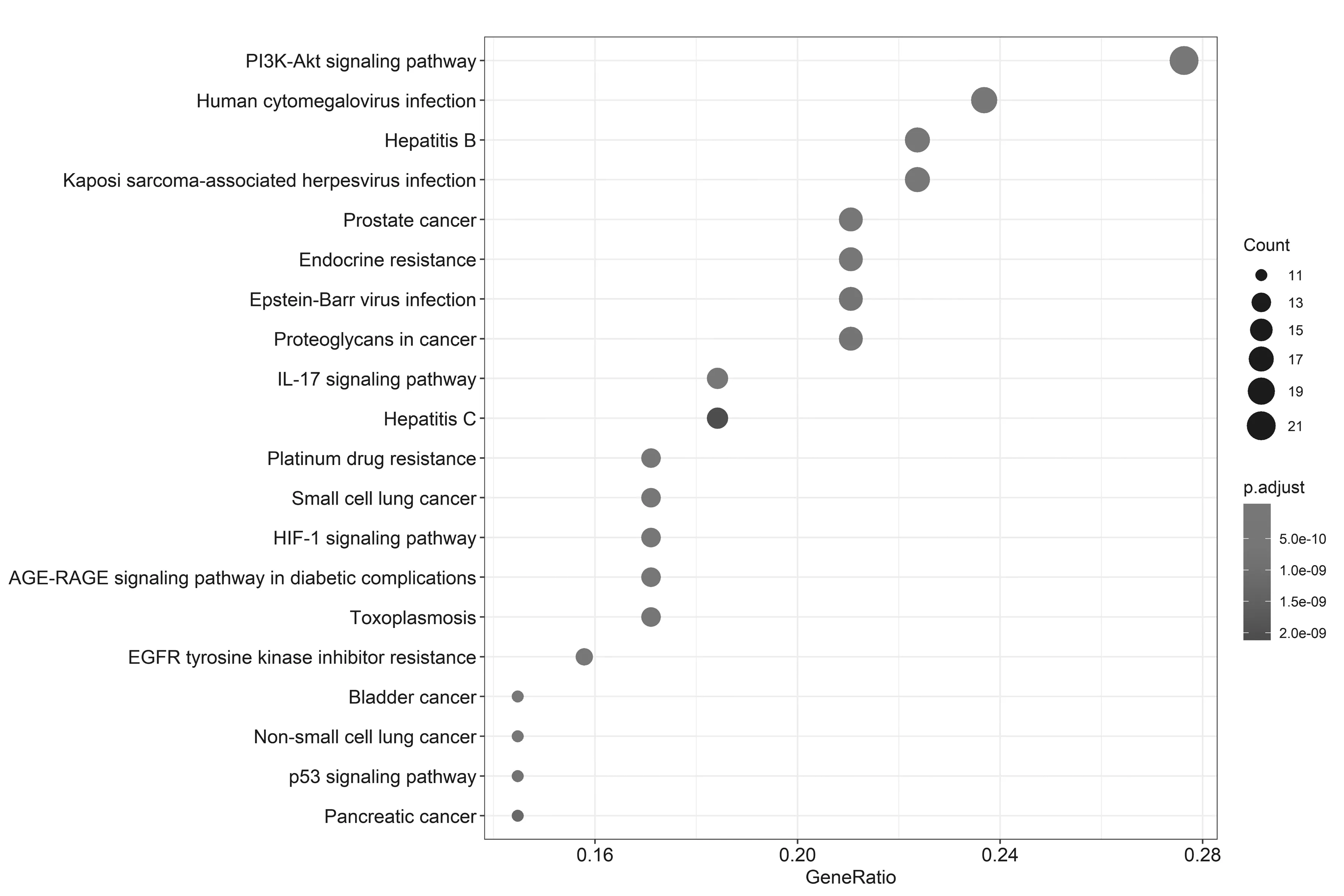
图8 党参-当归药对治疗ILD的潜在靶点KEGG通路富集分析
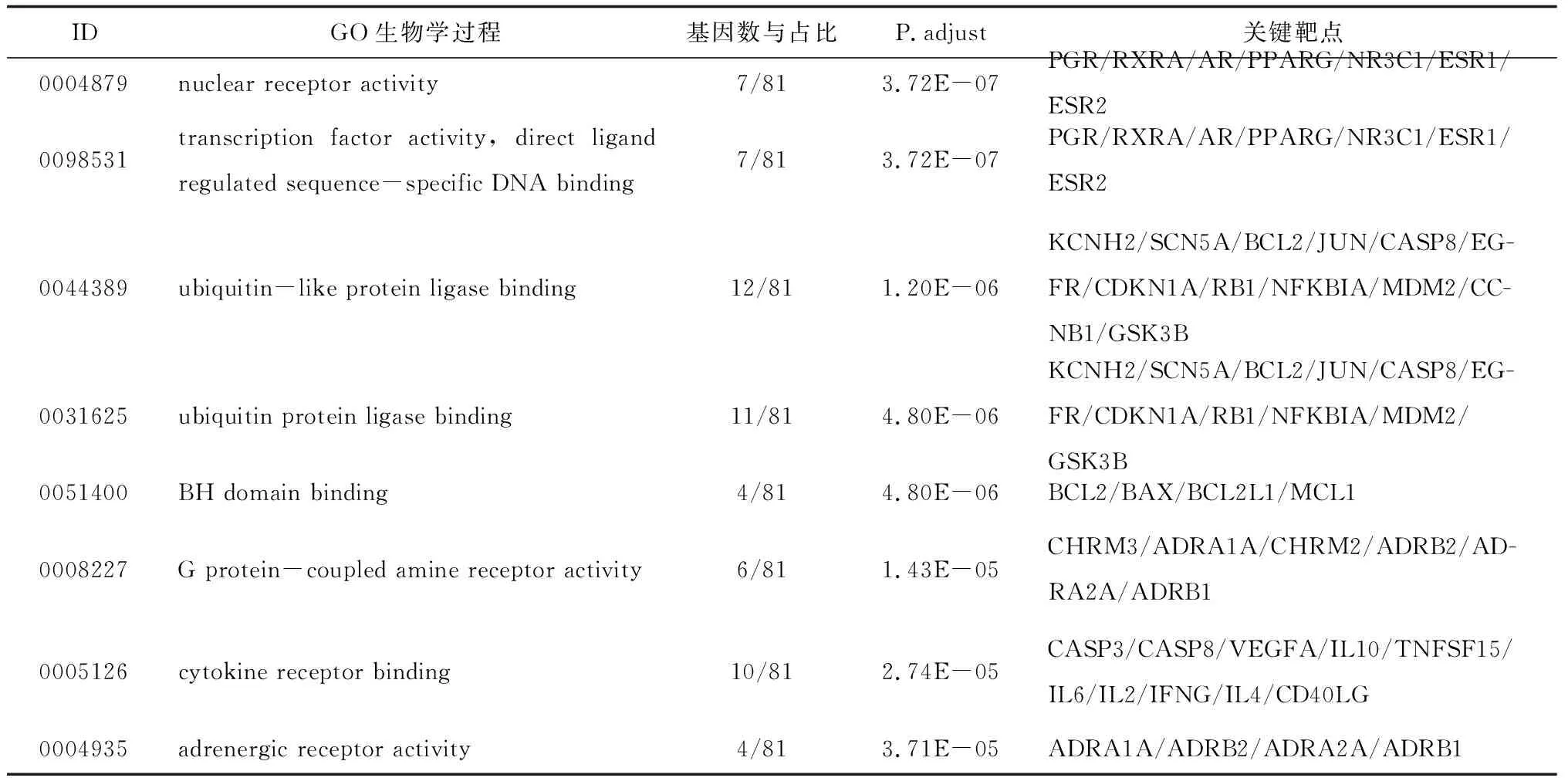
表2 党参-当归药对治疗ILD靶点生物过程的GO分析
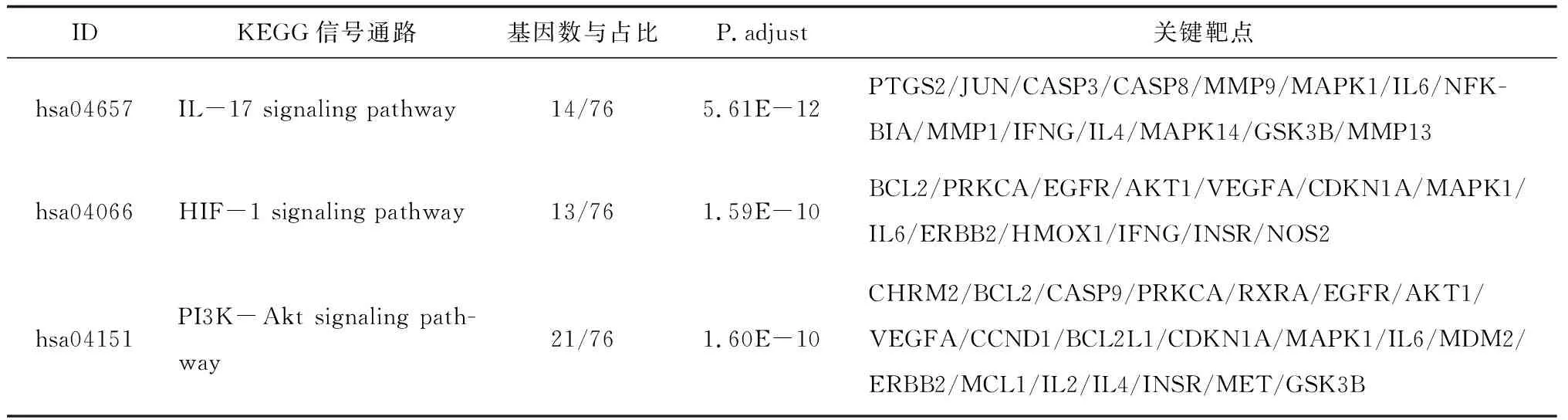
表3 党参-当归药对治疗ILD潜在靶点的重要通路
能够引起ILD的病因十分广泛,按类型可大致分为免疫性、特发性、药物性及理化因素等[7]。ILD是一组异质性疾病,但即使是同一亚类的疾病,其进展速度和病理生理变化也可不一致。糖皮质激素一般是各类ILD的首选,但抗炎治疗并不能有效延缓肺纤维化进展,且本病涉及炎症网络、胶原沉积、氧化应激、血管生成等方面的多种信号分子参与发生发展过程,恰与中药多靶点、多途径、多环节起效的作用特点相一致。
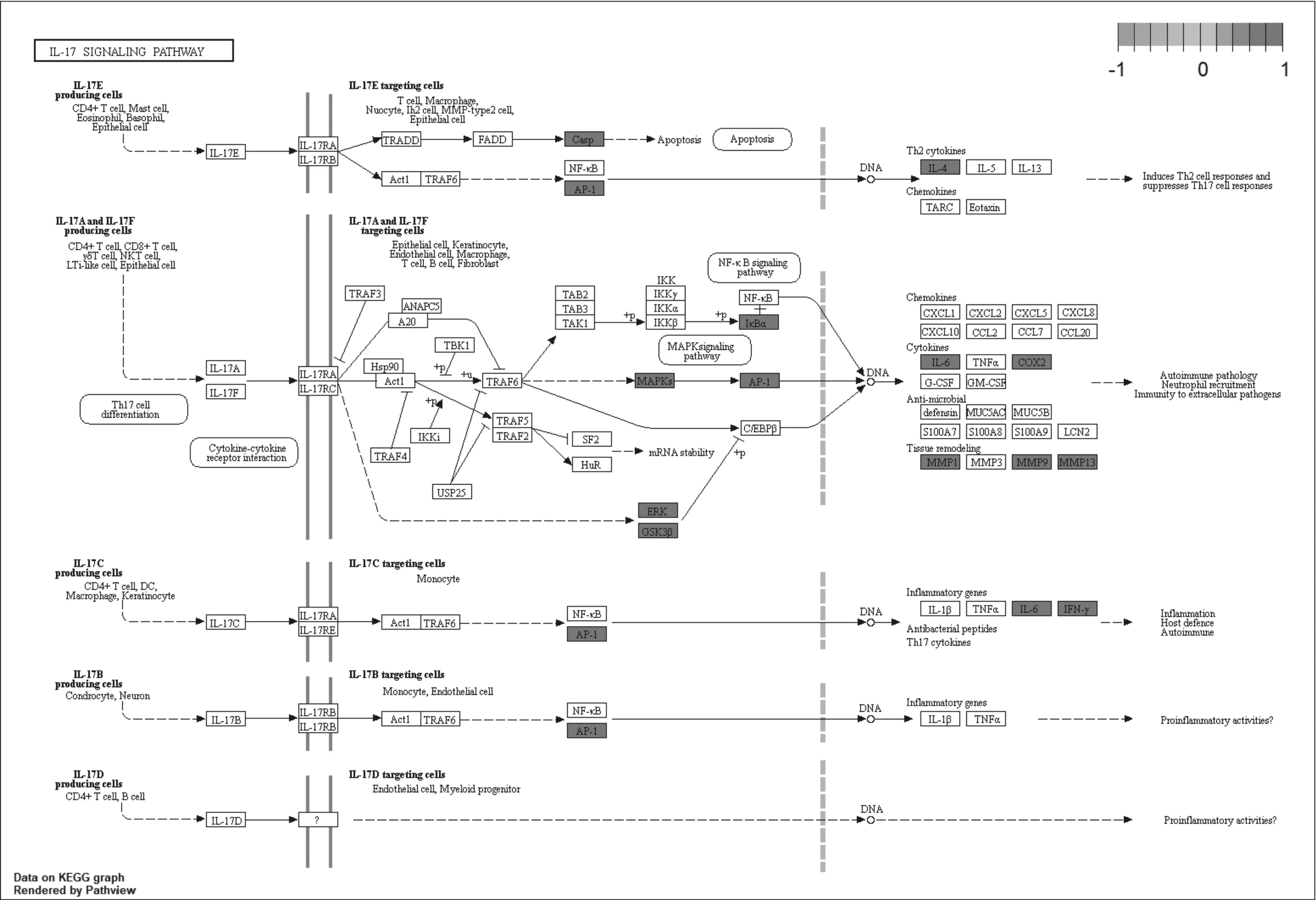
图9 IL-17信号通路与关键靶点示意图
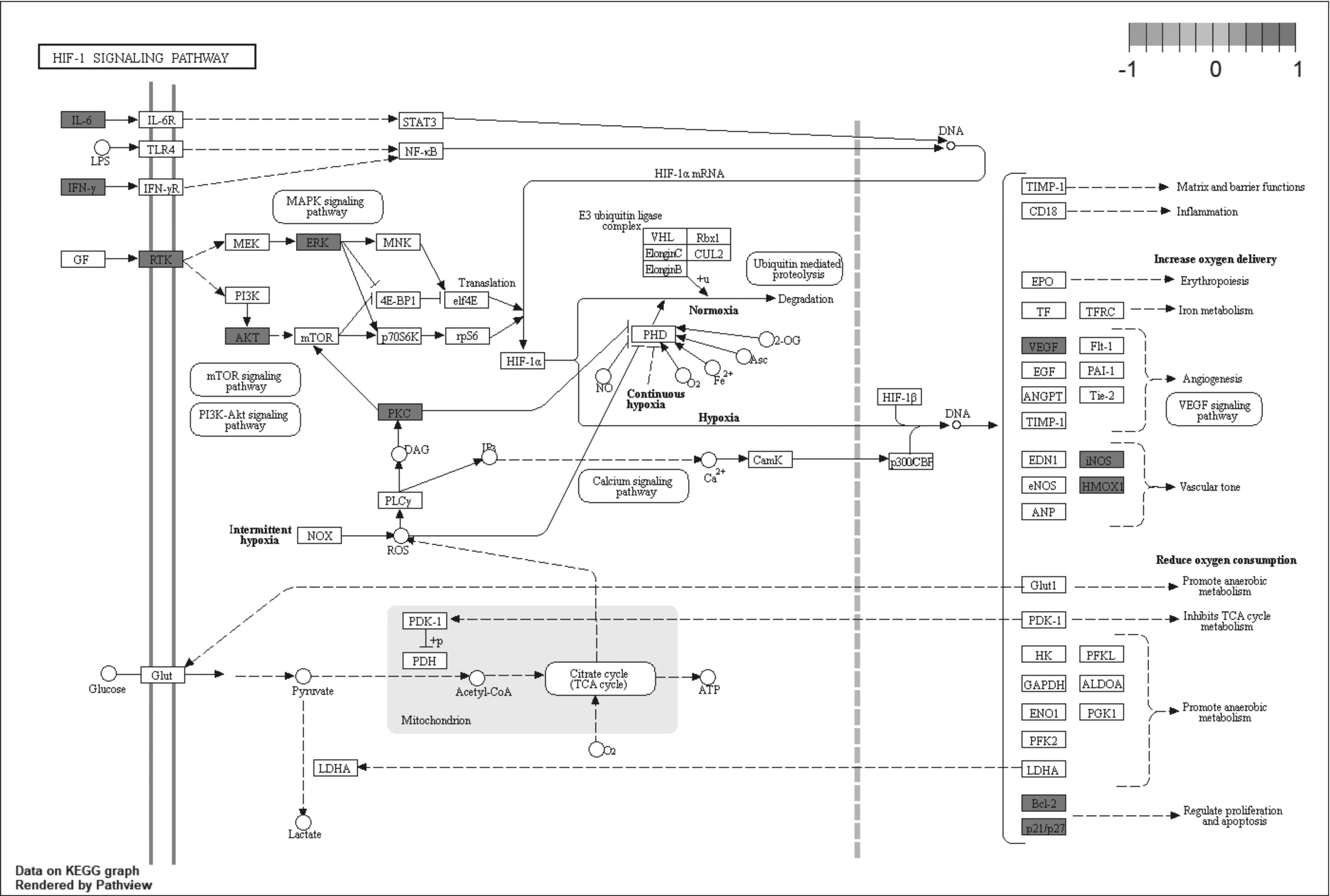
图10 HIF-1信号通路与关键靶点示意图
党参为桔梗科植物党参Codonopsispilosula(Franch.)Nannf.、素花党参(西党参)CodonopsispilosulaNannf.var.modesta(Nannf.)L.T.Shen或川党参CodonopsistangshenOliv.的干燥根,性味甘平,归脾、肺经,可补中益气,健脾益肺。当归为伞形科植物当归Angelicasinensis(Oliv.)Diels的干燥根,性味甘、辛,温,归肝、心、脾经,功在补血活血,调经止痛,润肠通便。党参-当归药对是补气养血的基本药对。现代研究证实,当归配伍党参能明显增强机体的免疫功能,显著优于单用当归或当归配伍补血药白芍、熟地黄、制首乌[8],其配伍当属相使范畴[9]。党参伍用当归可降低急性血瘀模型大鼠肺间质水肿程度,改善肺出血、抑制肺泡上皮变性[10],这在延缓ILD病理进程中具有重要意义,强烈提示该药对在临床治疗ILD中的应用价值。
网络药理学是一种建立在网络数据库检索、计算机虚拟计算及高通量组学数据分析基础上的生物信息网络构建及网络拓扑结构分析策略和方法[11-12],旨在从系统生物学等角度阐释疾病的发生发展过程,以整体观认识药物与机体的相互作用[13]。目前,该方法已成为系统水平研究中药复方潜在活性成分和作用靶点的新策略。
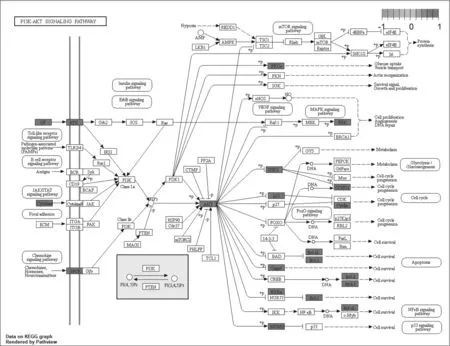
图11 PI3K-Akt信号通路与关键靶点示意图
本研究运用网络药理学方法,挖掘党参-当归药对中潜在活性化合物,与作用靶点配对得到其治疗ILD的潜在靶点,建立党参-当归药对-化合物-靶点-ILD网络图,并对靶点通路进行富集分析,系统地研究党参-当归药对对ILD的作用机制。
对药物-疾病靶点蛋白相互作用网络分析的结果显示,靶点AKT1、VEGFA、CASP3、IL-6、JUN、MAPK1、EGFR、PTGS2、CCND1、MMP-9在网络中占据核心地位。其中AKT1(蛋白激酶B1)是mTORC2信号通路重要的下游靶蛋白,后者是调节细胞增殖、代谢及自噬的中心枢纽,属于磷脂酰肌醇3-激酶(phosphatidylino sitol 3-kinase,PI3K)蛋白家族[14]。AKT1可使mTOR蛋白磷酸化而激活并促进相关蛋白的表达,进一步促进基因转录和蛋白质合成,在纤维化过程中扮演重要角色[15]。有研究证实,磷酸化AKT1参与了高氧肺损伤的发生发展,mTORC1、mTORC2双重抑制剂能减轻高氧致SD幼鼠肺损伤纤维化的作用[16]。ILD中发生的纤维化多归因于活化的上皮细胞刺激成纤维细胞增殖聚集并促进上皮间质转化(epithelial mesenchymal transition,EMT)、激活多条异常信号通路,进一步诱导成纤维细胞灶形成和肺泡结构破坏、基质沉积、瘢痕形成。其中MAPK(丝裂原活化蛋白激酶)是将细胞外刺激信号传递到细胞核内并引起一系列细胞生物学反应的信号转导系统之一[17],在多种细胞因子刺激下能够影响细胞外基质(ECM)的沉积,导致纤维化的发生。MMPs是一类钙、锌离子依赖的蛋白水解酶[18],活化的MMPs能降解暴露的胶原纤维,可对ECM起到降解与重塑作用,通过基因转录、酶原激活等方式调控着纤维化、风湿性关节炎等疾病的发生,因此,MMP家族在结缔组织相关性间质性肺病及肺纤维化中有其特殊地位。细胞周期蛋白D1(Cyclin D1,CCND1)是G1周期素家族最重要的成员,为目前公认的癌基因。CCND1过表达被认为是一种早期的、引起癌症形成的事件,在ILD相关性肿瘤如IPF-LC中或有重要意义。PTGS2即COX2,只在炎症和促使有丝分裂的刺激下才会诱导性表达并参与PGE2的合成,后者在血管生成、免疫抑制等多方面发挥重要作用[19],与白介素家族如IL-6的表达有密切联系。VEGF信号通路参与血管新生过程,对血管内皮细胞的增殖、迁移、趋化和肺组织结构重塑有十分明显的促进作用。现代药理学研究发现,党参主要含有糖类、生物碱类、聚炔类、苷类及萜类等成分,具有调节血糖、促进造血机能、抗缺氧、抗应激、抗疲劳、增强机体免疫力抗溃疡等多种药理作用[20];当归的药理学效应则包括抗血小板聚集、抗炎、抗肿瘤、调经、平喘等[21]。党参-当归药对中代表性成分如木犀草素可通过提高GSH和SOD活性、下调Bax和caspase-3 mRNA的表达产生对APAP诱导的L02细胞损伤的保护作用,其机制可能与其减轻氧化应激反应和抑制细胞凋亡有关[22];木犀草素更可直接抑制LPS诱导的RAW264.7细胞中PGE合成途径中两个诱导酶COX-2和mPGES-1的表达,而该种巨噬细胞的M1型异常活化贯穿肺纤维化发病全过程,除持续引起肺泡炎外,M1型巨噬细胞还分泌MMP-2、MMP-9等促进细胞外基质的降解[23-24],这也在PPI中得到印证。与GO基因分析和KEGG通路富集分析结果相联系,可知党参-当归药对通过增强机体免疫,影响细胞因子分泌水平,调节局部炎症与胶原沉积,抗新生血管生成和结构重塑的多表型干预的网络模式对ILD产生治疗作用,其作用信号通路与IL-17信号通路,HIF-1信号通路,PI3K-Akt信号通路关系密切。
本研究应用网络药理学方法对党参-当归药对治疗ILD的潜在成分、靶点与作用机制进行了系统性探索,为基础实验研究和临床应用提供了较全面的理论基础。但由于本研究不能将所有有效成分纳入,且无法预测药对配伍前后化学成分的变化,故研究结论具有一定局限性,结果的证实有待于进一步实验研究。
利益冲突:所有作者均声明不存在利益冲突。
