改进胃癌临床T分期模型的建立与评价
2021-08-04郭世伟董银萍武子镇刘勇王学军张汝鹏梁寒邓靖宇
郭世伟,董银萍,武子镇,刘勇,王学军,张汝鹏,梁寒,邓靖宇
胃癌是全球第5 大常见癌症,死亡率仅次于肺癌与结肠癌[1]。尽管胃癌的诊断和治疗水平在近年有了较大提高,但其预后仍不理想[2]。肿瘤浸润深度是预测胃癌患者预后的重要因素,肿瘤浸润越深,相应的T 分期越高[3]。准确的术前临床分期对选择合理的治疗方案十分必要。胃癌术前临床分期判断主要依靠超声内镜(EUS)、多层螺旋CT 等[4]。国际抗癌联盟(UICC)与美国癌症联合会(AJCC)联合发布的第8版胃癌TNM分期[5]推荐EUS为首选诊断工具。但EUS对于T3期判断准确性较低,故临床常采用 EUS 联合 CT 来判断临床 T 分期[6]。然而 CT 对 T3期的判断准确性也不理想,常规临床T 分期的判断方法仍有一定的改善空间[7]。本研究通过收集行根治术治疗的胃癌患者相关临床病理资料,应用EUS联合多层螺旋CT综合评估得到常规临床T分期,进一步结合EUS肿瘤纵切面最大短径建立改进的术前临床T 分期模型,以期提升对病理T 分期的预测能力,为临床制定个体化治疗方案提供更好的参考。
1 对象与方法
1.1 研究对象 回顾性纳入2018 年1—12 月在天津医科大学肿瘤医院行胃癌根治术的患者227例,其中男155例,女72例,年龄28~81 岁,中位年龄56 岁。术后病理显示102 例为pT1~pT2 期,125 例为 pT3~pT4 期;132 例淋巴结阴性(pN0),95例淋巴结阳性(pN1~pN3)。
1.2 纳入和排除标准 纳入标准:(1)术前均行CT和EUS检查。(2)术前咬检病理检查证实为胃腺癌。(3)R0切除。(4)临床病理资料完整。排除标准:(1)术前行新辅助放化疗者。(2)远处转移者。(3)合并其他恶性肿瘤者。(4)既往有胃部手术史者。(5)存在出血、穿孔、梗阻者。(6)胃食管结合部癌者。
1.3 方法
1.3.1 CT检查 患者术前2周内行多层螺旋CT检查。CT检查前禁食 8 h,检查前 20 min 嘱患者饮水 600~1 000 mL 以保证胃处于充盈状态。若无禁忌证,于检查前15~20 min 给予患者肌内注射20 mg 山莨菪碱以减少胃肠蠕动。选用GE Lightspeed扫描设备对腹腔、盆腔行256层CT扫描,图像由高年资影像科医生与手术医生共同分析判定。
1.3.2 EUS 检查 使用日本Fujinon SU-7000 型超声系统主机,环扫型电子超声内镜EG-530UR检查,超声内镜频率为5、7.5、10、12 MHz。超声小探头主机型号为Fujinon SP-702,扫描频率为12、15、20、25 MHz。患者在检查前禁食12 h,检查时患者于左侧卧位,首先行常规内窥镜检查评估胃部的总体情况,尽量清除胃黏液和食物残渣。随后,将EUS 探头插入十二指肠降段,并用反向后视镜进行观察。检查时将空气吸出,并向胃中注入300~800 mL脱气水,沿十二指肠降段逐段扫描至贲门。EUS容易发现较大的病灶和淋巴结,而较小病灶的浸润深度由EUS 结合小型超声探头来确定。图像分析由1名经验丰富的内镜室医师完成。
1.3.3 资料收集 收集患者性别、年龄、胃癌病理T分期、肿瘤位置、Borrmann分型、基于CT的T分期、EUS下肿瘤侵犯胃壁层数、EUS 肿瘤纵切面最大短径。胃癌病理T分期采用第8版UICC/AJCC分期标准[5]。肿瘤按所在位置从上而下划分为胃底、胃体、胃窦及胃小弯/角切迹。胃癌的Borrmann 分型:息肉或肿块型(Ⅰ型)、无浸润溃疡型(Ⅱ型)、浸润溃疡型(Ⅲ型)、弥漫浸润型(Ⅳ型)[8]。胃癌在CT下表现为胃壁增厚及异常强化。判断标准:T1期病灶侵犯胃黏膜固有层、黏膜肌层或黏膜下层;T2期病灶侵犯至固有肌层;T3期病灶穿透浆膜下结缔组织,而尚未侵犯脏层腹膜或邻近结构;T4期病灶侵犯浆膜(脏层腹膜)或邻近结构[9-11]。EUS能较为清晰地显示胃壁的5个层次,分别为黏膜表面反射波及黏膜层(第1层)、黏膜肌层(第2 层)、黏膜下层(第3 层)、固有肌层(第4层)、浆膜层(第5 层)。胃癌在EUS 下表现为一层或多层胃壁结构破坏、增厚或形态不规则[12]。本研究按照肿瘤侵犯胃壁的层数将患者划分为第1~4层组与第5层组。
1.4 统计学方法 数据用SPSS 26.0 统计学软件进行处理,通过单因素分析及多因素Logistic 回归分析pT3~pT4 期的相关危险因素。筛选出影响因素后建立改进的术前临床T 分期模型。采用Hosmer-Lemeshow(H-L)检验评价改进的临床T 分期模型及常规临床T 分期的拟合优度[13]。利用MedCalc 15.0 软件绘制受试者工作特征(ROC)曲线并计算曲线下面积(AUC),评价2 种模型对病理T 分期的预测效能,P<0.05为差异有统计学意义。
2 结果
2.1 pT1~pT2期和pT3~pT4期患者临床及病理特征比较 pT3~pT4期女性患者比例,肿瘤位置在胃底、胃体及胃小弯/角切迹比例,Borrmann 分型Ⅲ、Ⅳ型比例,基于 CT 得到的 T3~T4 分期比例,EUS 下肿瘤侵犯胃壁第5层比例及EUS肿瘤纵切面最大短径均高于pT1~pT2期(均P<0.05),见表1。
2.2 常规临床T分期模型及初步评价 以术后病理T分期为因变量,将基于CT的T分期与EUS下肿瘤侵犯胃壁层数作为自变量进行多因素Logistic回归,变量赋值方法,见表2。结果显示,基于CT的T分期与EUS下肿瘤侵犯胃壁层数均为术后病理T分期的影响因素,见表3。Logistic 回归方程为Logi(tP)=ln[P(/1-P)]=-2.599+2.409X4+2.553X5,P为病理pT3~pT4期预测概率值,建立预测方程P=1[/1+e-(-2.599+2.409X4+2.553X5])。H-L检验显示该模型拟合度一般(χ2=1.601,P=0.449)。
2.3 改进临床T分期模型的建立 以术后病理T分期为因变量,纳入性别、肿瘤位置、Borrmann分型、基于CT得到的T分期、EUS下肿瘤侵犯胃壁层数、EUS肿瘤纵切面最大短径进行多因素Logistic回归分析,变量赋值方法,见表2。结果表明,基于CT 的T 分期、EUS 下肿瘤侵犯胃壁层数及EUS 肿瘤纵切面最大短径是术后病理T分期的影响因素,见表4。故将这3个变量纳入并建立Logistic回归模型,得到Logi(tP)=ln[P(/1-P)]=-7.884+2.528X4+2.019X5+3.437X6,建立pT3~pT4期预测方程P=1[/1+e-(7.884+2.528X4+2.019X5+3.437X6])。H-L 检验显示该模型拟合度良好(χ2=7.134,P=0.522)。
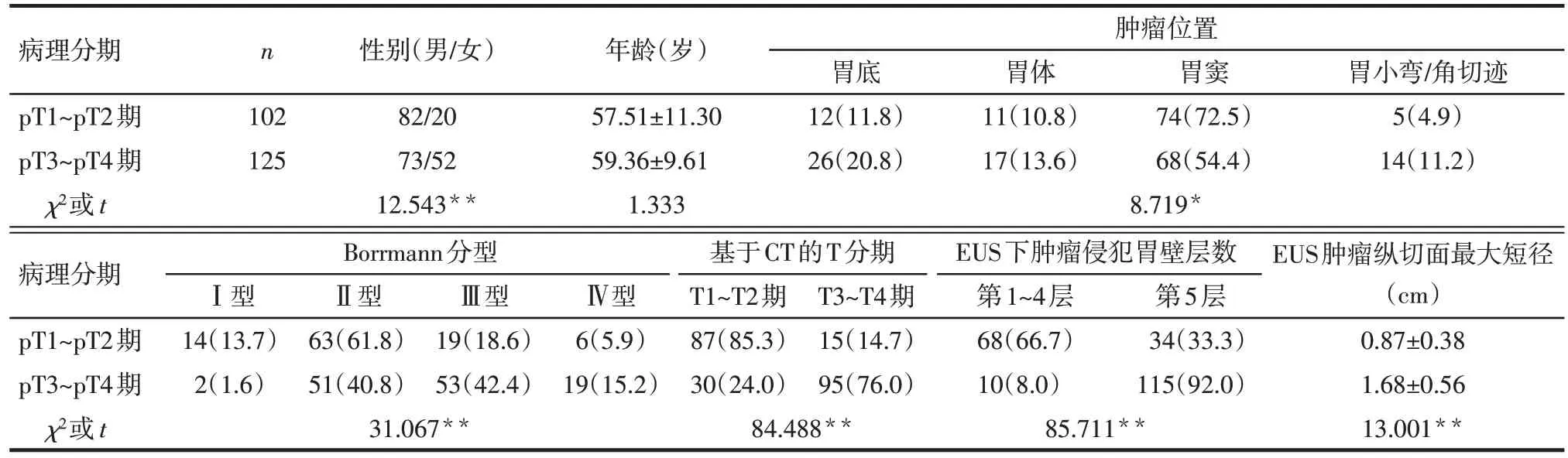
Tab.1 Comparison of basic data between different pathological T staging groups表1 不同病理T分期组患者基本资料比较

Tab.2 Variable assignment table of Logistic stepwise regression analysis of pT3-pT4 in the gastric cancer patients表2 胃癌患者pT3~pT4期多因素Logistic回归分析变量赋值表
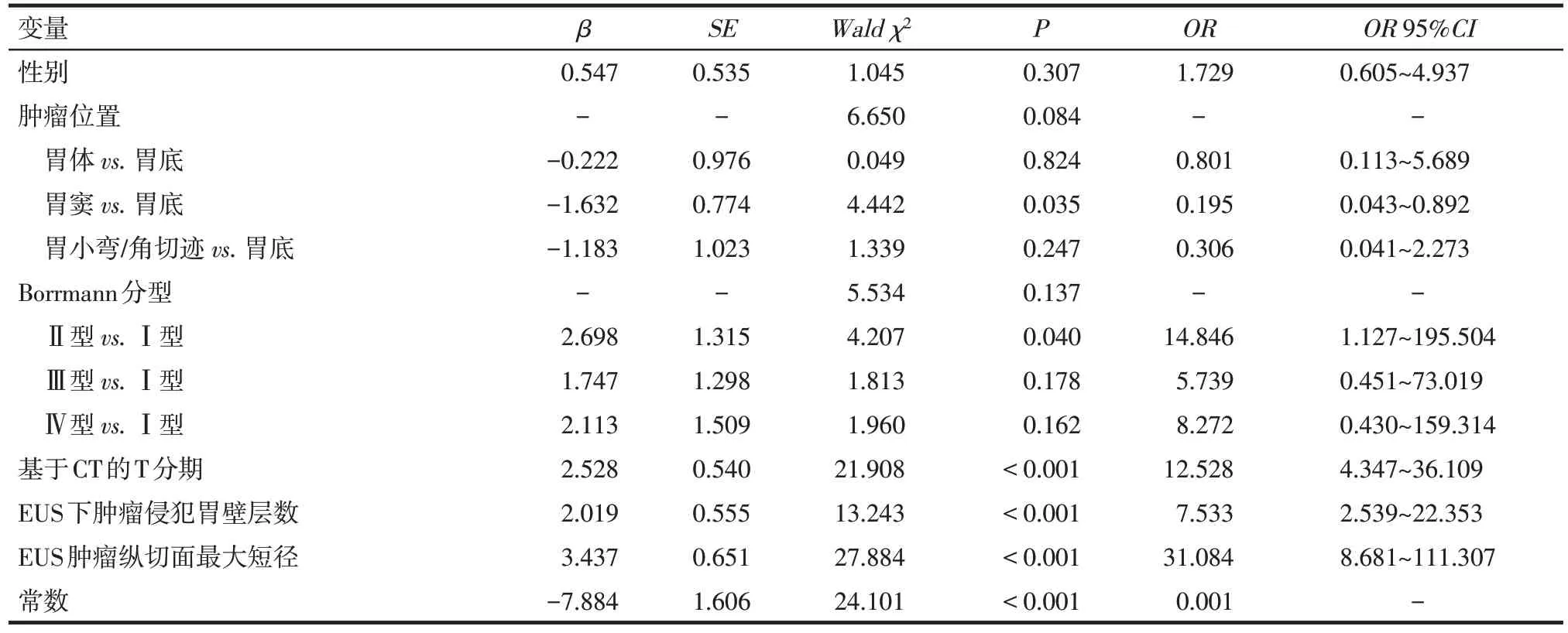
Tab.4 The multivariate Logistic regression analysis of risk factors of pT3-pT4 in gastric cancer patients with revised clinical T staging model表4 胃癌患者pT3~pT4期危险因素改进临床T分期模型多因素Logistic回归分析
2.4 常规临床T分期及改进临床T分期模型的预测价值比较 改进临床T 分期模型-2 对数似然值为135.700,优于常规临床T分期模型(195.708)。以术后病理T分期为金标准,对2种临床T分期模型ROC曲线进行比较,发现改进的临床T 分期模型其ROC曲线下面积大于常规的临床T 分期模型(Z=3.870,P<0.01),见图1、表5。在淋巴结阳性亚组中,改进的临床T 分期模型亦优于常规的临床T 分期模型(Z=2.058,P<0.05),见图2、表6。
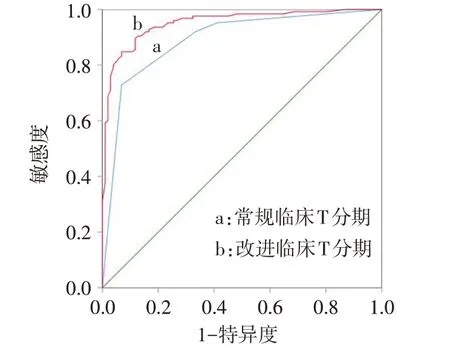
Fig.1 ROC curve of conventional clinical T staging model and revised clinical T staging model图1 常规临床T分期模型与改进临床T分期模型ROC曲线图
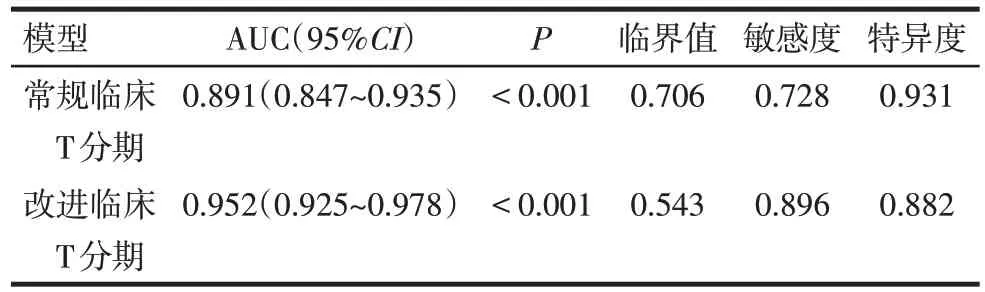
Tab.5 Two clinical T staging models of ROC curves analysis表5 2种临床T分期模型的ROC曲线分析
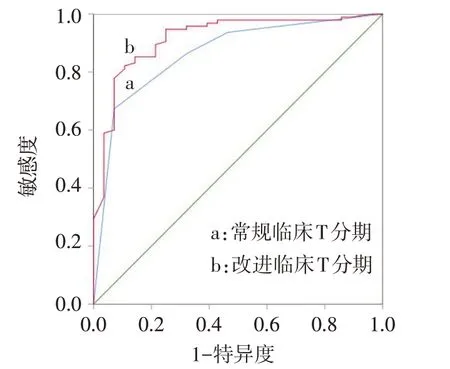
Fig.2 ROC curve of conventional clinical T staging model and revised clinical T staging model in the lymph node positive subgroup图2 淋巴结阳性亚组常规临床T分期模型与改进临床T分期模型ROC曲线图
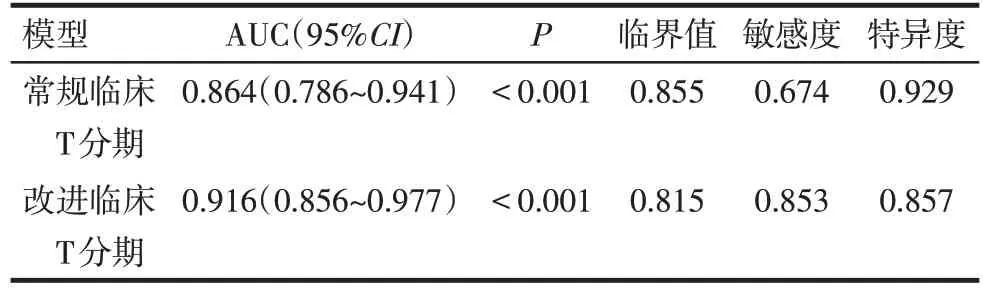
Tab.6 Two clinical T staging models of ROC curve analysis in the lymph node positive subgroup表6 淋巴结阳性亚组中2种临床T分期模型的ROC曲线分析
3 讨论
胃癌作为胃肠道的常见恶性肿瘤,其治疗及预后与准确的临床分期和病理诊断密切相关。准确的术前临床T 分期对选择合理的手术方式、切除范围及新辅助化疗方案十分必要,可使患者最大程度上受益。过度分期可能导致部分手术范围过大或者错失行微创手术的机会,分期过低可使患者未及时行新辅助化疗而导致治愈率降低。腹腔镜手术具有创伤小、痛苦小、术后恢复快等优势。2020 年中国临床肿瘤学会(CSCO)胃癌指南指出,cT2及以下分期并且无远处转移的胃癌可行腹腔镜手术;在亚洲,D2胃癌根治术通常需配合辅助治疗,而进展期胃癌患者常需行新辅助化疗;cT3~4N1~3M0 患者可考虑术前进行新辅助化疗[14]。
EUS 可以较好地检测胃癌的浸润深度,对T 分期判断的准确度可达81.6%[15]。然而EUS无法观测到浆膜下浸润,故对于T3 期判断效果较差,常会被低估。多层螺旋CT 可较为清晰地观测到浆膜下浸润,EUS 与多层螺旋CT 结合来综合判断T 分期,准确度可达83.22%[6]。但CT对T3期的判断准确性较其他分期低,仅为57.4%[7]。
在本研究中,笔者发现EUS 层数及基于CT 的T分期预测病理pT3~pT4期的AUC值为0.891,预测效果仍有一定提升空间。EUS下胃癌肿瘤纵切面是与肿瘤所在胃壁垂直的切面,该切面的长径常与胃壁平行,而该切面的最大短径则代表胃壁垂直的肿瘤最大浸润深度。笔者尝试分析EUS肿瘤纵切面最大短径能否作为预测病理T 分期的新指标。通过Logistic回归分析发现基于CT的T3~T4分期、EUS下肿瘤侵犯胃壁第5 层、较长EUS 肿瘤纵切面最大短径是pT3~pT4 期的独立危险因素。以这些变量建立的改进临床T 分期模型预测病理pT3~pT4 期的ROC 曲线AUC 值为0.952,预测效果较好。另外,在淋巴结阳性亚组中,改进的临床T 分期模型的预测效果也优于常规临床T分期模型。
综上所述,改进的临床T 分期模型可明显提高对病理T 分期的预测能力,为患者的个体化治疗提供更好的临床依据。
