叶酸对阿尔茨海默病的影响及其机制研究进展
2021-08-01李剑飞郭锡汉薛京伦
李剑飞,郭锡汉,薛京伦,汪 旭,*
(1.云南师范大学生命科学学院,云南 昆明650500;2.复旦大学遗传学研究所,上海201438)
叶酸(folate)为B族水溶性维生素,作为一碳代谢的一组甲基传递体,参与嘌呤、嘧啶合成,以及DNA和各种生物分子甲基化反应。氧化型叶酸经一系列还原过程形成5,10-亚甲基四氢叶酸(5,10-methylenetetrahydrofolate,5,10-MeTHF),为dUMP转化为dTMP提供甲基;5,10-MeTHF随即还原为5-甲基四氢叶酸,为甲硫氨酸(methionine,Met)提供甲基,合成生物体重要甲基供体S-腺苷甲硫氨酸(S-adenosyl methionine,SAM),保证DNA精准合成。因此,叶酸摄入及代谢异常与DNA、染色体的结构和功能紊乱息息相关,是发育异常、退行性疾病、肿瘤发生的关键风险因子。据报道,帕金森氏病、亨廷顿氏病、肌萎缩性脊髓侧索硬化症和阿尔茨海默病(Alzheimer's disease,AD)的发生发展均与叶酸供给和代谢状态相关。
AD是一种记忆、学习、注意力、人格、空间感等认知功能渐进性破坏乃至丧失的神经退行性病变,其主要组织病理学特征是大脑不溶性淀粉样蛋白斑块和细胞内神经纤维缠结的形成与渐进性恶化,二者的核心组分分别是β-淀粉样蛋白(amyloid-β protein,Aβ)和高度磷酸化的微管结合蛋白tau,它们的异常增加是AD发生发展的主要生物学标志。本文围绕叶酸对Aβ和tau生成过程的生物学作用,综述叶酸对AD患病风险的影响与可能机制,为AD防范奠定营养干预依据。
1 血清叶酸和同型半胱氨酸水平与AD
多项分子流行病学研究提示,一碳代谢组分中的各种甲基传递体、辅酶和相关微营养素与AD的发生发展有着错综复杂的联系,一碳代谢核心组分叶酸的摄入及其代谢状态与老年人的认知水平变化、AD风险具有显著关联。意大利一项以60岁以上、已出现认知障碍的人群为对象的回顾性调查分析,发现血清叶酸含量与认知能力呈正相关,叶酸水平较高(3~4 ng/mL)的个体认知能力显著高于低叶酸个体(<2.2 ng/mL),而一碳代谢中Met合成的底物之一,同型半胱氨酸(homocysteine,Hcy)的高水平(>17.68 μmol/L)则与认知障碍的恶化程度正相关。Ma等在病例对照研究中对比了134名中国健康老年人、129名轻度认知障碍患者(mild cognitive impairment,MCI)和131名AD患者的血清叶酸浓度,发现3个群体的叶酸浓度依次降低、与认知状态呈负相关;该团队进一步发现Hcy水平与认知障碍恶化正相关,提示高水平Hcy不仅是心血管病的独立风险因子,其对于神经细胞正常功能也存在负面效应。Hama等根据简易智力量表(mini-mental state examination,MMSE)评分,在日本45名血清叶酸缺乏(<3.6 ng/mL)的认知障碍患者中给予叶酸补充干预(5 mg/d,28~63 d),干预后受试者MMSE评分及轻度认知障碍得到明显改善,Hcy也在干预后显著降低。Ravaglia等对平均年龄74岁的816名意大利健康人群随访4年,发现112名志愿者发展为MCI,其中70名罹患AD,关联分析揭示低水平血清叶酸(<11.8 nmol/L)、高Hcy水平(>15 μmol/L)个体发展为MCI和AD的风险显著提高。
多个实验室利用动物模型开展了叶酸与AD相关病理因素变化的关联研究。Lawton团队通过不同剂量叶酸膳食干预12个月,发现无叶酸膳食组的CD-1小鼠较之叶酸添加组(50 μg/d)出现显著的记忆障碍,海马区与记忆相关MafB
和Zfp410
基因表达显著下调。Troen等研究人员以无叶酸膳食饲喂大鼠10周,继而进行认知状态、血液学和生化分析。发现叶酸缺乏使受试大鼠空间学习与认知功能损害,补充Met可一定程度逆转这种现象,提示一碳代谢各种组分对认知状态改变、AD发生的影响具有多样性和复杂性。Yang等为孕期小鼠补充叶酸(5 mg/kg),发现仔鼠海马神经发生较对照得到更好地维护、后代的学习与记忆能力显著提高。亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)是平衡一碳代谢中DNA合成与甲基化过程的关键酶(图1)。Bahous团队用MTHFR
多态性小鼠模型评价了遗传变异和营养失衡对叶酸代谢及AD发生发展过程的影响,发现MTHFR
C677T突变使受试动物短期记忆损伤和焦虑、突触标志基因转录水平异常,叶酸缺乏膳食还诱发甲基供体SAM水平降低,与Aβ加工、神经生长因子、一碳代谢和表观修饰相关基因如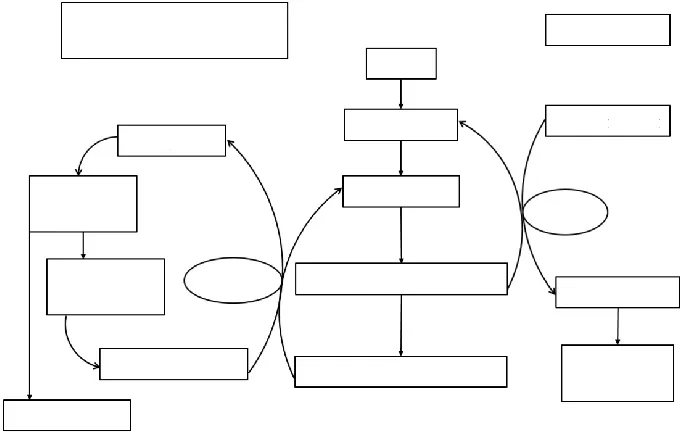
图1 一碳代谢途径示意图
PS1
、Ngf
、Bdnf
、Hdacs
、DNMTs
、Nmda
、nr1
、Mat2a
、Pemt
和Chdh
均出现转录异常。这项研究进一步提示叶酸对于维持正常甲基化、核苷酸和神经递质合成、良好认知状态具有重要作用。甲基转移酶是维护一碳代谢和机体甲基化反应的重要酶系,其成员DNMT1
和DNMT3a
均可在神经元中表达。Feng等构建了条件性敲除DNMT1
或/和DNMT3a
的小鼠模型,发现双敲除小鼠海马神经元体积较对照小、学习记忆缺陷、DNA甲基化程度显著降低、与突触可塑性相关的MHCI
和Stat1
表达失调,结果提示DNMT1
和DNMT3a
是维持DNA甲基化、调节神经元基因表达、维系突触可塑性与学习记忆必不可少的因素。有研究以质谱法分析了17位过世的AD个体前额叶皮质组织和外周血淋巴细胞12个潜在AD易感基因位点(APH1B
、APOE
、SIN3A
、BACE
、HTATIP
、APP
、NCSTN
、TFAM
、DNMT1
、MTHFR
、PSEN1
)的DNA甲基化改变,发现MTHFR
启动子区的甲基化水平显著升高;还有团队在AD逝者脑组织解剖分析中发现,海马区细胞的DNMT1
和DNMT3a
表达水平显著下调、全基因组甲基化水平显著降低,这些结果提示MTHFR
所控制的DNA合成与甲基化反应,以及甲基转移酶对甲基化反应的维系功能紊乱均和AD的发生发展有关联。2 叶酸对Aβ代谢过程的影响
Aβ的前体为跨膜蛋白APP(amyloid precursor protein),其降解通常包括淀粉样和非淀粉样途径。在非淀粉样降解途径中,APP首先被α-分泌酶切割成N端片段sAPPα和C端片段α-CTF,α-CTF随后经γ-分泌酶(presenilin 1,PS1)切割形成P3和胞内C端结构域AICD;在淀粉样降解途径中,APP经β-分泌酶(BACE1)切割成AICD和sAPPβ,后者被γ-分泌酶进一步分解为Aβ,后续形成含38~43个氨基酸的Aβ(图2)。Aβ和Aβ是含量最高的Aβ异构体,Aβ具有更强疏水性、聚合性和神经毒性。Aβ的生成和清除过程异常可导致Aβ沉积、形成寡聚体和斑块,引起海马区和相关大脑皮层的神经元凋亡、突触连接丧失,是AD发生的高风险因素。
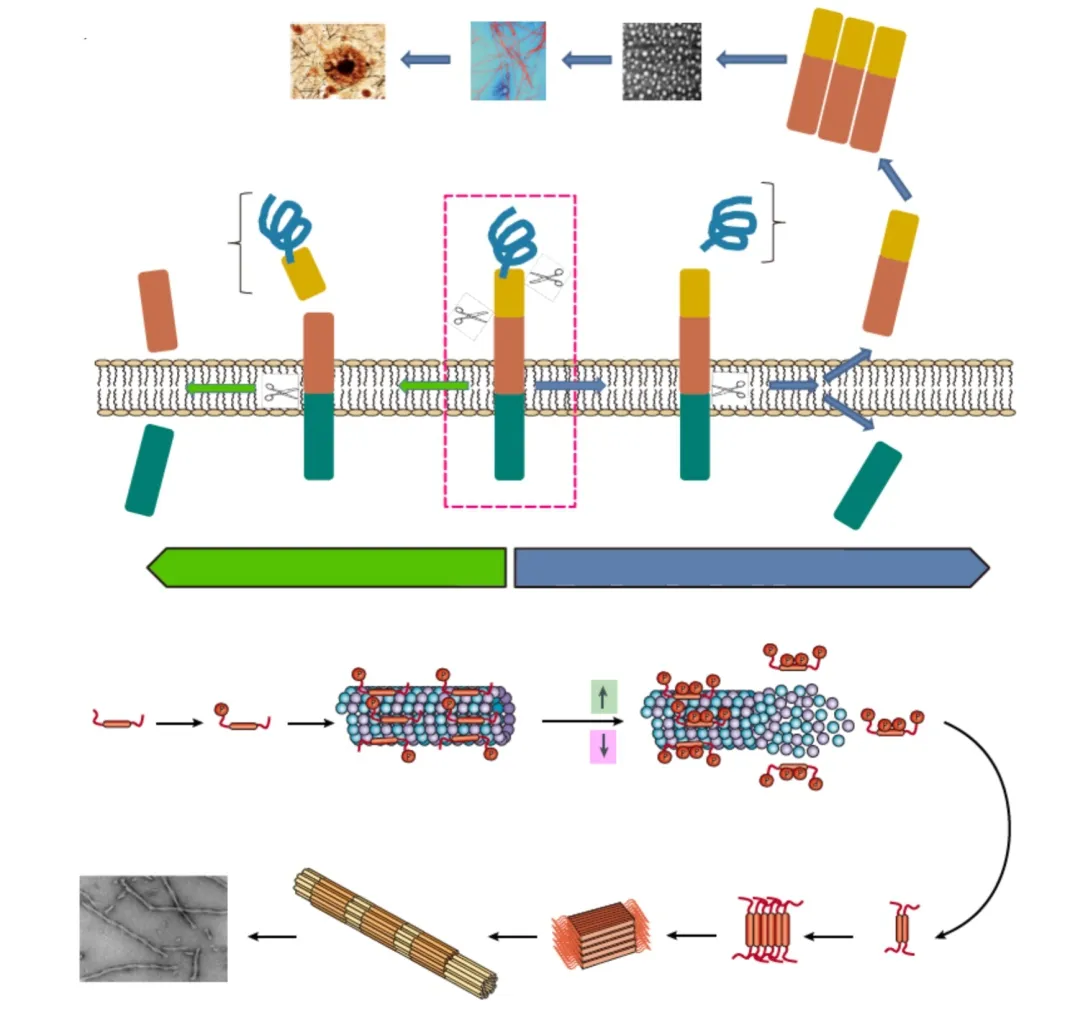
图2 淀粉样蛋白斑和神经纤维缠结形成过程示意图
BACE1和PS1是降解APP、加工合成不同大小Aβ片段的重要角色。Fuso课题组探索了表观遗传修饰对PS1
和BACE1
启动子甲基化与淀粉样蛋白生成在AD发生发展中的作用与机制,先后在AD小鼠模型中发现高浓度Hcy与低水平B族维生素引起的一碳代谢异常使得转基因小鼠PS1
和BACE1
基因低甲基化、表达上调。Li等研究人员也开展了叶酸对APP/PS1
转基因AD小鼠模型Aβ水平影响的探索。他们以叶酸缺乏膳食、叶酸和/或SAM正常膳食饲喂小鼠60 d,发现叶酸强化饲喂(120 μg/kg)使受试动物血清叶酸提高,叶酸缺乏小鼠补充叶酸后,其DNMT活性、APP
和PS1
启动子甲基化程度均不同程度提高。研究均认为叶酸通过提高DNMT酶活性而加强相关基因启动子甲基化、最终可能介导APP、PS1和Aβ水平的下降。研究人员还以Aβ-叶酸共培养小鼠海马细胞HT-22,发现Aβ寡聚物降低细胞的DNMT活性、上调PS1
和APP
的表达,叶酸则在一定程度上消减Aβ生成聚集诱发的神经毒性;该团队还为APP
/PS1
转基因AD小鼠模型加强叶酸[600 μg/(kg·d)],发现PS1
和APP
启动子甲基化水平均得到提升、表达活性降低。然而有报道却称,在意大利的120名晚发性AD患者和115名对照的外周血基因组中分析了PS1
、BACE1
、DNMT1
、DNMT3a
、DNMT3b
和MTHFR
基因的甲基化水平,发现上述基因的甲基化情形在病例-对照组间未出现显著差异。因此,一碳代谢组分变异、甲基转移酶的活性改变对于不同组织细胞的Aβ生成代谢、AD的影响还需要在不同实验系统、不同物种和组织中更缜密地深入剖析。MTHFR对于DNA合成与甲基化平衡、SAM合成、Hcy正常水平的维护具有不可替代的作用,MTHFR
677TT纯合突变型导致酶活降低近70%。分子流行病学提示MTHFR
C677T多态性与晚发性AD患病风险的增高相关。APP的Thr668位点磷酸化强度改变,可使APP分解为sAPPβ及sAPPα的平衡紊乱,严重干扰Aβ代谢。Hoffman团队探索了MTHFR功能缺陷所介导的APP分子Thr668位点磷酸化的改变,研究以正常叶酸和低叶酸膳食饲喂MTHFR
、MTHFR
和MTHFR
小鼠6个月,结果发现低叶酸组中,MTHFR
和MTHFR
小鼠蛋白激酶GSK-3β被激活、蛋白磷酸酯酶2A(PP2A)去甲基化和APP的Thr668位点磷酸化水平上升。MTHFR
遗传缺陷、GSK-3活化,PP2A去甲基化和APP的Thr668位点磷酸化可能构成Aβ病理性加工的一条机制链条。MTHFR
多态性与膳食叶酸缺乏的相互作用可能损伤神经系统稳态并增加AD患病风险。研究发现,机体叶酸水平变化可调控特异性miRNAs表达,从而介导其靶基因表达改变,引起相应的健康效应。我们围绕叶酸缺乏与miR-22-p和miR-149-5p表达的关系、以及2种miRNAs对MTHFR
的靶向调控开展了大量工作,发现叶酸缺乏可以通过上述2种miRNA的表达改变而介导MTHFR功能紊乱。根据前述讨论,不排除叶酸水平的改变可通过miRNA表达而影响AD风险的潜能。目前已有一系列的研究,报道了靶向PS1
、APP
和BACE1
的miRNAs如miR-126-3p、miR-335-5p、miR-4422-5P、miR-188-3p、miR-339-5p、miR-200b-3p、miR-106a-5p等。其 中miR-339-5p、miR-200b-3p、miR-106a-5p和miR-339-5p可以响应叶酸缺乏,靶向并调控PS1
、APP
和BACE1
对Aβ生成与加工过程。Liu等以APP
/PS1
转基因小鼠为研究对象,探讨叶酸缺乏和正常膳食对miRNA及其靶基因APP
和BACE1
的影响。发现叶酸缺乏下调miR-200b-3p、miR-106a-5p和miR-339-5p表达,从而解除相关miRNAs对APP
和BACE1
的表达抑制,促进Aβ生成加工与聚集。在离世的AD患者脑组织中,也发现miR-339-5p水平下降,在离体实验中抑制miR-339-5p表达后,人胶质母细胞瘤细胞的BACE1
表达水平上升,提示miRNA响应机体微环境变化并介导AD发生发展的可能性。3 叶酸对tau代谢过程的影响
tau是由MAPT
编码、存在于神经元的一种微管结合蛋白,其与微管蛋白结合,参与微管装配,对于细胞骨架组装、神经元微管的动态平衡具有重要作用。正常状态下,tau具有维持神经突触结构稳定、神经发生和神经元极性等生理功能,人脑中的tau含多个潜在磷酸化位点,通常2~3个位点可被磷酸化。而在AD患者脑组织内蛋白磷酸酯酶PP2A活性下降,蛋白激酶GSK-3β活性增强,磷酸化-去磷酸化平衡紊乱,导致tau过度磷酸化并与微管脱离、自聚合形成神经纤维缠结(neurofibrillary tangles,NFT)。NFT具有神经毒性,可导致神经元功能障碍乃至细胞死亡,是AD的关键生物标志之一。Sontag课题组揭示了叶酸缺乏对PP2A甲基化的影响与机制,以正常叶酸(1 mg/L)、低叶酸(0.01 mg/L)和无叶酸(0 mg/L)条件分别干预不同遗传修饰的鼠神经母瘤细胞24 h,发现无叶酸状态下调LCMT-1
转录、PP2A甲基化及其亚基Bα浓度,细胞凋亡坏死频率增加;过表达LCMT-1
或B
α,均可以缓解无叶酸状态诱发的PP2A去甲基化和tau磷酸化;该团队对C57BL/6J小鼠饲以正常叶酸(6.7 mg/kg)、低叶酸(0.2 mg/kg)或无叶酸饮食2个月,发现小鼠前额叶皮质、中脑和小脑神经元PP2A甲基化水平降低、LCMT-1
的下调。叶酸缺乏对于LCMT-1
表达、Bα水平均具有负面影响。Li等研究人员通过探讨叶酸对tau磷酸化的影响,剖析可能存在的叶酸-PP2A-tau磷酸化-AD患病风险轴。研究以不同浓度叶酸(0~40 μmol/L)干预人SH-SY5Y神经细胞模型96 h,其间以10 nmol/L磷酸酯酶抑制剂(OA)暴露9 h。结果发现,OA处理细胞的tau-Ser396位点磷酸化程度随叶酸浓度的增加而被抑制,在叶酸40 μmol/L时抑制效应最佳;研究还分析了叶酸干预后细胞的PP2A活性,发现随着叶酸浓度增加,PP2A亚单位PP2Ac分子Leu309位点低甲基化被逆转、tau磷酸化水平下降,研究提出了叶酸通过抑制PP2A去甲基化而下调tau磷酸化、降低AD风险的假说。
为揭示2型糖尿病患者中的AD发病率高于正常人群的机制,Zheng等以叶酸缺乏(0 mg/kg)、常规叶酸(15 mg/kg)、高叶酸膳食(15 mg/kg+120 μg/kg),即在常规基础上额外补充叶酸干预经链佐霉素建模的糖尿病小鼠8周,发现高浓度叶酸干预能显著降低糖尿病小鼠脑内tau的Ser396位点过度磷酸化、PP2A甲基化、DNMT转录上调,叶酸通过调节糖尿病小鼠PP2A甲基化而降低tau磷酸化的结果支持叶酸可能作为改善糖尿病患者认知障碍的多靶点药物。
4 结语与展望
国家统计局第七次全国人口普查数据显示,我国60岁以上人口已达26 402万人,占18.70%,其中,65岁及以上人口为19 064万人,占13.50%,65岁及以上人口将成为增长最快的年龄组,人口老龄化程度进一步加深。AD作为一种高度异质性、病因复杂的进行性神经退行性疾病,严重影响人类生活质量、对公共健康和社会经济提出了日益严峻的挑战。65岁以后人群是AD发病高峰人群,对于快速增长的老龄人口和沉重的照护负担,如何从众多维度有效预防或延迟AD的发生发展,是当下社会面临的紧迫问题!围绕一碳代谢各类组分对脑细胞尤其是分化终端神经元基因组结构与表达的影响与机制,剖析一碳单位组分及遗传变异对Aβ聚集和tau磷酸化、氧化胁迫与炎症反应、离子通道与微环境稳态等生物学过程相关基因、酶功能的影响与机制,甄别目前该领域研究成果吻合度不尽人意的瓶颈所在,将是防范AD、推进公共健康发展的重要科学领域。
