两种异常核型髓系肿瘤的基因突变及临床相关性分析
2021-08-01徐启璐冉学红王军军张俊英刘丽萍
徐启璐,高 慧,冉学红,王军军,张俊英,刘丽萍,*
(1.潍坊医学院,山东 潍坊261053;2.潍坊医学院第一附属医院/潍坊市人民医院血液内科,山东 潍坊261041)
7号染色体丢失或长臂缺失(-7/7q-)是骨髓增生异常综合征(myelodysplastic syndromes,MDS)和急性髓系白血病(acute myeloid leukemia,AML)中最常见的染色体改变之一,尤其是继发性MDS和AML。然而1号和7号染色体的不平衡易位形成衍生染色体+1,der(1;7)(p10;q10)[以下简称der(1;7)],导致1号染色体长臂(1q)三体和7号染色体长臂(7q)单体,是髓系肿瘤中一种少见的重现性、获得性核型异常。自1980年Geraedts首次报道的3例伴der(1;7)核型异常的骨髓纤维化患者以来,至今已报道近300例,国内仅有少数几篇报道。由于一半以上的患者既往有抗肿瘤化疗史(特别是含有烷化剂、拓扑异构酶II抑制剂)和/或放疗史,或职业性有毒物质接触史,因此与继发性或治疗相关的MDS(t-MDS)或AML(t-AML)相关。目前对于der(1;7)的预后仍存在争议。此外,der(1;7)患者的突变谱与预后生存的关系仍未明确。在本研究中,我们对2013—2020年通过常规细胞遗传学分析检出的21例伴有der(1;7)和-7/7q-异常的髓系肿瘤患者进行了二代测序技术(next generation sequencing,NGS),并探讨der(1;7)和-7/7q-患者的实验室检查结果、基因突变和临床转归方面的差异。
1 材料与方法
1.1 病例资料
回顾性分析2013年1月—2020年11月潍坊市人民医院21例伴有der(1;7)或-7/7q-异常的MDS、AML和骨髓增殖性疾病(myeloproliferative neoplasm,MPN)患者的临床资料,确认der(1;7)或-7/7q-为唯一的细胞遗传学异常,排除伴有其他细胞遗传学改变的患者。将其分为der(1;7)组和-7/7q-组,所有患者均在初诊时采集骨髓标本,应用NGS检测与疾病相关的38个基因突变,分析NGS结果及相关临床资料。疾病诊断均符合2016年世界卫生组织(World Health Organization,WHO)关于MDS、AML(非M3型)、MPN修订分型标准。预后危险度分级MDS参照修订的国际预后评分系统(IPSS-R),AML参照2017年成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南。疗效评价参照修订的2018年MDS国际预后工作组(IWG-PM)疗效标准和2017 ELN的白血病诊断和管理标准。21例患者中有17例应用去甲基化药物(地西他滨/阿扎胞苷)治疗,11例应用蒽环类药物化疗。研究随访截至2020年12月25日,中位随访时间169 d。
1.2 染色体制备
用常规方法对未经刺激的骨髓液培养(24和48 h)制备的R显带中期细胞进行常规染色体分析。对20个中期细胞进行了常规细胞遗传学分析。核型按照人类细胞基因组学国际命名体系(ISCN2016)报告。部分患者应用荧光原位杂交(fluorescencein situ
hybridization,FISH)检测1号及7号染色体长臂。对200个间期细胞进行FISH分析。1.3 二代测序检测基因突变
提取骨髓液标本中基因组DNA,制备DNA全基因组文库。使用聚合酶链反应(PCR)引物扩增目的基因组38个MDS/AML/MPN相关基因,将目标区域DNA富集后,采用illumina测序平台进行二代测序。测序后用dbSNP、1 000 genomes、COSMIC、Polyphen-2、SIFT等数据库对原始数据进行生物信息学分析,确定致病性基因突变位点。平均测序深度1 000×,变异频率>5%的突变位点检出率>99%。测序由武汉思泰得医学检验平台完成。
1.4 统计学处理
采用SPSS 25.0、Prism软件进行统计分析、作图;计量资料的组间比较,符合正态分布资料采用单因素方差分析或t
检验,非正态资料使用Kruskal-WallisH
检验或Mann-WhitneyU
检验;计数资料采用卡方检验或Fisher精确概率法进行差异性分析,检验水 准α=0.05。以Kaplan-Meier法 计 算 总 生 存 期(overall survival,OS),OS定义为从开始治疗到因任何原因死亡的时间或最后一次随访的时间,率的比较采用Log-rank检验。应用Spearman等级相关分析患者的核型和突变基因的相关性。P
<0.05为差异有统计学意义。2 结果
2.1 患者基本特征
本研究共纳入21例患者,男性14例,女性7例,中位年龄58(52~64)岁。对21例患者的骨髓中期细胞进行常规染色体分析,应用FISH对其进行突变检测,结果见图1,利用缺失扩增探针检测发现3个1q21,1个D7S522异常荧光信号。患者的临床特征及实验室检查结果见表1,可见21例患者中11例为der(1;7)核型异常患者,10例为-7/7q-核型异常患者,der(1;7)组中MDS 3例,AML 7例,MDS/MPN-MF伴 发 肺 癌1例;-7/7q-组中MDS 5例,AML 5例。der(1;7)患者中以男性为主,男女比例10∶1,-7/7q-患者的男女比例大致均等(2∶3),差异有统计学意义(P
=0.024)。der(1;7)组患者的血小板计数(1.5×10个/L)显著低于-7/7q-组(4.3×10个/L,P
=0.036),der(1;7)组患者的C反应蛋白(C reactive protein,CRP)(51.3 mg/L)显著高于-7/7q-组(8.15 mg/L,P
=0.029)。将核型异常患者分为MDS与AML亚组,der(1;7)与-7/7q-患者的骨髓原始细胞计数差异无统计学意义(均为P
>0.05)。两组患者的免疫分型具有相似性(χ
=0.078,P
=1.000),共同表达CD38、CD13、HLA-DR、CD117、CD34、CD33。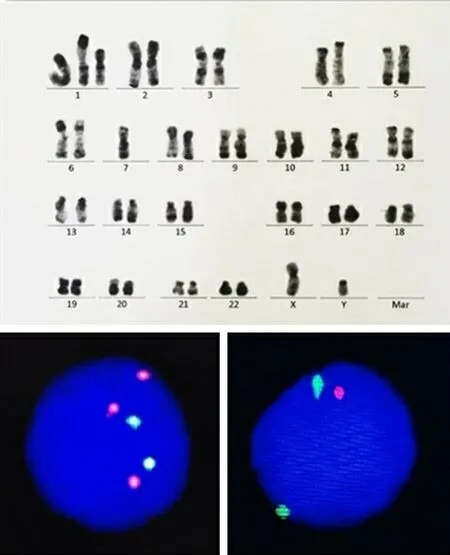
图1 骨髓细胞遗传学检测结果

表1 der(1;7)与-7/7q-髓系肿瘤患者的临床特征及实验室检查结果
根据WHO(2016)分型,der(1;7)的MDS患者多为MDS-EB1分型;AML多为M5型,-7/7q-多为MDSEB2型;AML各型较分散。预后危险度分层,分析结果见表1,AML患者IPSS-R评分der(1;7)全部表现为中等预后,-7/7q-全部表现为不良预后,两组差异有统 计 学 意 义(P
<0.01)。21例 患 者 中17例[der(1;7)7例,-7/7q-10例]应用去甲基化药物治疗,11例[der(1;7)8例,-7/7q-3例]应用蒽环类药物化疗,MDS患者中7例(87.5%)应用去甲基化药物治疗,AML患者中8例(61.5%)应用去甲基化药联合蒽环类药物化疗,der(1;7)组患者的总缓解率(ORR)优于-7/7q-组(P
=0.131)。2.2 核型与基因突变的相关性
采用NGS检测基因突变,21例患者中有6例(28.6%)未检测到突变,11例der(1;7)患者中有7例(63.6%)检测到突变,10例-7/7q-患者中有8例(80%)检测到突变,共检出13种基因37个突变,4例(23.8%,4/21)携带1个突变,11例(52.4%,11/21)携带2个(5例)、3个(3例)、4个(1例)或5个(2例)突变。人均检出(1.76±1.02)个突变患者的突变基因分布见表2。根据基因功能分类,按突变频率由高到低依次表现为遗传 相 关 基 因(DNMT3A
、IDH1
/IDH2
、TET2
、ASXL1
、SETBP1
、EZH2
)(59.5%,22/37)、转录调节相关基因(RUNX1
、ETV6
、BCORL1
、CUX1
)(21.6%,8/37)、信号转导相关基因(JAK2
、CBL
)(10.8%,4/37)、剪接体相关基因(U2AF
1)(8.1%,3/37)。der(1;7)患者中RUNX1
(21.4%)、IDH1/IDH2
(21.4%)、JAK2
(21.4%)基因突变频率较高,-7/7q-患者中SETBP1
(17.4%)、TET2
(17.4%)、ASXL1
(13%)、U2AF1
(13%)、DNMT3A
(13%)基因突变频率较高。两组核型基因组成差异有显著统计学意义(P
=0.012),突变基因类型与核型之间存在正相关(r
=0.522,P
=0.001)。分别比较单个基因型在两种细胞遗传学中的数量分布,仅SETBP1
基因突变数量差异有统计学意义(P
=0.035)。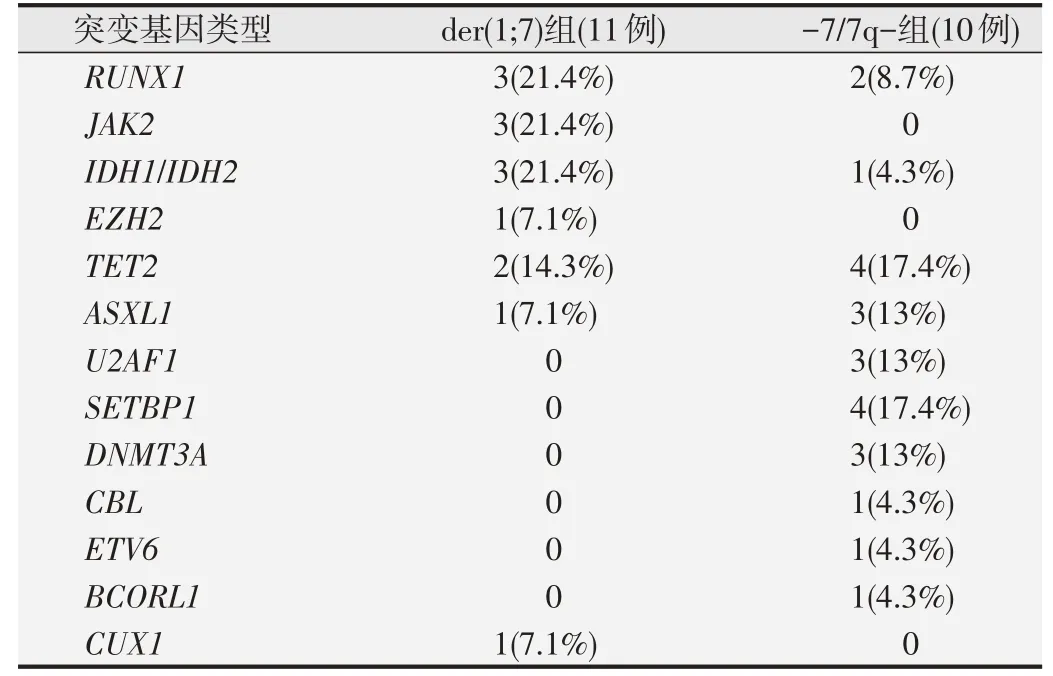
表2 der(1;7)与-7/7q-髓系肿瘤患者的突变基因分布*
2.3 核型与患者预后生存的相关性
der(1;7)与-7/7q-髓系肿瘤患者的生存曲线见图2,der(1;7)组患者的中位OS、总OS均较-7/7q-组显著缩短,差异有统计学意义(P
=0.045,HR=2.844),两组患者死亡风险差异无统计学意义(P
=1.000)。基因突变型与野生型的核型异常患者生存曲线见图3,der(1;7)患者中RUNX1
基因突变型较野生型中位OS明显缩短(P
=0.435,HR=1.936);IDH1
/IDH2
(P
=0.300,HR=0.343)、JAK2
(P
=0.487,HR=0.476)突变型较野生型表现出较长的OS;-7/7q-患者中ASXL1
突变型较野生型中位OS显著缩短(P
=0.018,HR=5.583),SETBP1
基因表达频率较der(1;7)患者高,差异有统计学意义(P
=0.035)。SETBP1
与ASXL1
基 因 常 常 伴 随 出 现(2/10)。U2AF1
突变型较野生型OS延长(P
=0.464),且常与SETBP1
突变伴发(2/10)。DNMT3A
(13%)为-7/7q-患者中常见的突变基因,突变型较野生型中位OS缩短(P
=0.061,HR=5.375)。TET2
突变在der(1;7)和-7/7q-患者中均有表达,两者之间差异无统计学意义(χ
=0.361,OR=0.333)。
图2 der(1;7)与-7/7q-髓系肿瘤患者的生存曲线
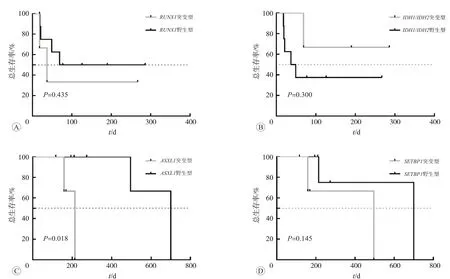
图3 基因突变型与野生型的核型异常患者生存曲线
3 讨论
der(1;7)染色体异常是着丝粒区域内有丝分裂重组的产物,在MDS、AML及MPN中的发生率分别为1%~3%、1%~2%和1%,中位OS为24~46个月,白血病转化率为14%~52%。本研究患者的临床特征与既往报道大体一致,der(1;7)组患者男性居多,血小板计数显著低于-7/7q-组;CRP显著高于-7/7q-组,与初诊时出血、感染发生率高有关。两组患者的年龄分布相似,WBC、HGB和LDH的计数差异无统计学意义。der(1;7)组的AML较-7/7q-组骨髓原始细胞计数高,但差异无统计学意义。这与既往报道的der(1;7)异常MDS患者具有较低的骨髓原始细胞比例有差别。
der(1;7)和-7/7q-两种细胞遗传学组可能具有不同的致病模型,目前已经发现与这种易位相关的一些特异性分子靶点。Westman等在11例合并der(1;7)异常的MDS或AML患者中发现了4例IDH1
/IDH2
突变,Hartmann等对80名7q-患者进行NGS确定ASXL1
、TET2
、RUNX1
的高频突变;而国内陈苏宁教授团队对22例der(1;7)患者进行NGS,证明der(1;7)与RUNX1
的高频突变有关。本研究通过对21例髓系肿瘤患者进行NGS,发现der(1;7)患者RUNX1
、IDH1/IDH2
、JAK2
基因的突变频率较高,-7/7q-患者中SETBP1
、TET2
、ASXL1
基因的突变频率较高,基因与核型存在显著的相关性,且-7/7q-患者中ASXL1
与SETBP1
存在伴随突变。这与既往报道基本一致,但由于NGS检测Panel的设计和检测基因的热点区域不同,导致结果存在异质性。RUNX1
突变比例在初诊AML和MDS中为10%和10%~20%,本研究RUNX1
突变比例为21.4%;der(1;7)患者RUNX1
突变型(RUNX1
)较野生型(RUNX1
)OS短,预后不良,是der(1;7)患者独立的预后危险因素。蔡晓辉等证明了RUNX1
突变的患者WBC水平、原始细胞百分比及白血病转化(leukemic transformation,LT)率更高,血小板水平更低。多篇文献提出伴RUNX1
突变的年轻患者更能受益于异基因造血干细胞移植(HSCT)。本研究结果显示IDH1
/IDH2
患者相比IDH1
/IDH2
OS延长。Xu等基于33篇已发表的研究进行了meta分析,得出在核型异常的AML中IDH2
突变可延长OS,且与预后良好相关。Westman等也证明了IDH2
突变的der(1;7)患者预后明显好于野生型,与LT正相关,但与其他7号染色体异常呈负相关,这表明在白血病发生中有一种不同于其他7号染色体缺陷的特殊生物学效应,可能与1q三体有关。Molenaar等通过实验证明PARP抑制剂olaparib和talazoparib(奥拉帕利和他拉唑帕尼)与DNA损伤剂(柔红霉素)的联合化疗对IDH1
/IDH2
AML细胞的致死性更高,可能是治疗IDH1
/IDH2
AML更好的策略。本研究11例应用蒽环类药物的患者中有9例应用了柔红霉素为基础的化疗,患者OS延长,与上述研究结论一致,可用于指导治疗。此外,IDH
抑制剂在复发难治性IDH1
/IDH2
AML、MDS患者中显示出良好的前景。SETBP1
基因在-7/7q-核型异常患者中突变比例高,与ASXL1
基因常常伴随出现,且OS缩短。Saika等发现SETBP1
在ASXL1
的MDS患者中富集,并与高LT的发生率以及OS缩短有关。ASXL1
是染色体修饰与调节基因,在MDS、AML、CMML中均与不良预后相关。本研究中ASXL1
突变主要发生在-7/7q-患者中,OS较野生型显著缩短,SETBP1
与ASXL1
联合激活Myc
基因的上调,并抑制了TGF-β信号通路,在体内协同诱导AML,二者联合突变比单独出现表现出更强的侵袭性、更高的LT风险和更短的OS。因此SETBP1
是伴ASXL1
的MDS的关键驱动因素,可作为MDS的潜在治疗靶点。组蛋白去乙酰化酶抑制剂伏立诺他(vorinostat)能逆转这些启动子区域的组蛋白乙酰化,并诱导TGF-β信号通路的上调。对于ASXL1
伴SETBP1
的MDS和AML将是很有前景的治疗药物。本研究17例患者应用去甲基化药物治疗,11例应用蒽环类药物化疗,der(1;7)组患者的总缓解率(ORR)优于-7/7q-组,但OS不理想,说明der(1;7)患者对单纯应用去甲基化及蒽环类药物有较高的快速缓解率,但由于缺乏进一步的维持治疗,der(1;7)组患者的OS显著缩短。Horio等将13例der(1;7)的MDS患者,基于骨髓发育状况和骨髓原始细胞计数分为预后良好组及预后不良组,3年生存率为86%和0%。其他几项研究中两者的OS差异无统计学意义。本研究中AML病例数量多(7/11),骨髓原始细胞计数高,有2例由MDS转化为AML,余5例不能除外先前未诊断且进展迅速的LT的可能性,以及治疗相关的基因毒性暴露对治疗反应较差、病死率高。既往报道MDS中大多数基因突变导致骨髓原始细胞数升高,预后较差。因此,我们认为AML伴der(1;7)与已知低风险核型异常的AML相比,可能具有不利的临床特征及预后。Itonaga等对接受HSCT的der(1;7)、-7/7q-和核型正常组患者进行了一项大型的回顾性分析,证明der(1;7)患者在晚期疾病状态下接受allo-HSCT表现出较好的预后生存。
综上所述,der(1;7)和-7/7q-核型异常的髓系肿瘤是两种相互独立的疾病亚型,二者在实验室检查结果、基因突变和临床转归方面存在显著差异,der(1;7)较-7/7q-患者预后差,OS短,RUNX1
和IDH1/IDH2
基因在der(1;7)组中突变频率较高,SETBP1
与ASXL1
基因在-7/7q-组中常常伴随出现。将基因突变恰当地纳入该类疾病预后危险分层中,进行精确的预后风险评估,选择最佳的治疗方案,实施精准个体化诊疗,将是未来的研究方向。本研究具有一些局限性,分析及包含的患者数量有限,后续需要在大型的队列研究中进一步证实。