核受体FXR激活对宫颈癌CaSki细胞增殖的抑制效应及其作用机制
2021-08-01黄晓华牛永东石刚刚
黄晓华,牛永东,石刚刚,*
(1.汕头大学医学院第二附属医院,广东汕头515041;2.汕头大学医学院,广东汕头515041)
宫颈癌是世界范围内第三大常见的恶性肿瘤,在女性病死率中排名第四。近年来,我国宫颈癌的病死率呈上升趋势,2003—2013年发病率也稳步上升。研究表明,HPV可以通过抑制p53和Rb等关键蛋白来促进宫颈癌的发生和发展。
核受体是配体激活的转录因子,含有48个成员。法尼醇X受体(farnesoid X receptor,FXR)是核受体超家族中的成员,它最初是由Seol与Forman等在1995年发现的。FXR可以被胆汁酸激活,FXR激动剂如GW4064、CA、LCA、CDCA也可激活FXR表达。FXR在肝、肾、肾上腺等组织中高表达,在宫颈组织、脂肪组织和心脏组织中也有表达。FXR与视黄醇X受体(retinoid X receptor,RXR)形成异源二聚体,结合到靶基因的启动子如小异源二聚体伴侣(short heterodimer partner,SHP)上。除了肝脏再生和炎症的作用之外,FXR还调节肝细胞癌、胰腺癌和胃癌的发生和增殖。FXR在未交配兔和孕兔所有类型的卵泡、卵巢间质均有表达。FXR的表达与雌激素受体表达呈线性关系。在雌激素阳性的肿瘤当中,FXR与增殖标记Ki-67表达密切相关。宫颈癌的发生发展与雌激素密切相关,目前FXR在女性生殖组织中的作用仍不清楚,尤其是对宫颈癌的发生有无影响尚未见报道。本文采用FXR激动剂GW4064作用宫颈癌CaSki细胞,观察FXR激活对宫颈癌细胞增殖的影响,并探讨其相关机制。
1 材料与方法
1.1 主要试剂与仪器
宫颈癌细胞株CaSki购自美国菌种保藏中心(American Type Culture Collection,ATCC)。本研究使用的主要试剂有:DMEM培养基(Life);胎牛血清(Biowest);Trizol试剂盒、Primer Script逆转录试剂盒和荧光定量PCR试剂(TaKaRa);四甲基噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)、FXR激 动剂GW4064(Sigma);兔抗人FXR、鼠抗人p53(Santa);鼠抗人β-actin(Zsbio);HRP羊抗兔IgG、HRP羊抗小鼠IgG(Boster);Annexin V,FITC凋亡检测试剂盒(东仁)。
本研究使用的主要仪器有:二氧化碳恒温细胞培养箱(Panasonic);超净工作台(苏州净化设备有限公司);倒置相差显微镜(Nikon);多功能酶标仪(Spectra Max);BD accuritm C6流式细胞仪(美国贝克曼库尔特有限公司)。
1.2 方法
1.2.1 细胞培养和分组
CaSki细胞培养在含10%胎牛血清、青霉素100 U/mL和链霉素100 μg/mL的DMEM培养基,于37℃、饱和湿度、CO体积分数为5%的培养箱中,每隔两天更换一次培养基。GW4064是公认的FXR激动剂,实验设DMSO(1 μL/mL)对照组及GW4064作用组。每组实验重复3次。1.2.2
RNA提取和实时荧光定量PCR
细胞贴壁后加入10 μmol/L的GW4064作用24 h,用Trizol试剂盒提取RNA。按照逆转录试剂盒说明书将RNA反转录成cDNA。实时荧光定量PCR检测FXR mRNA水平。βactin作为内参。实验重复3次。采用2法计算FXR的表达量。按照表1配制PCR反应混合液。将混合液混匀后离心,置于ABI 7500荧光定量PCR仪中进行反应。95℃、30 s;95℃、5 s,60℃、34 s,40个循环。引物序列如表2所示。
表1 PCR反应混合液的配制
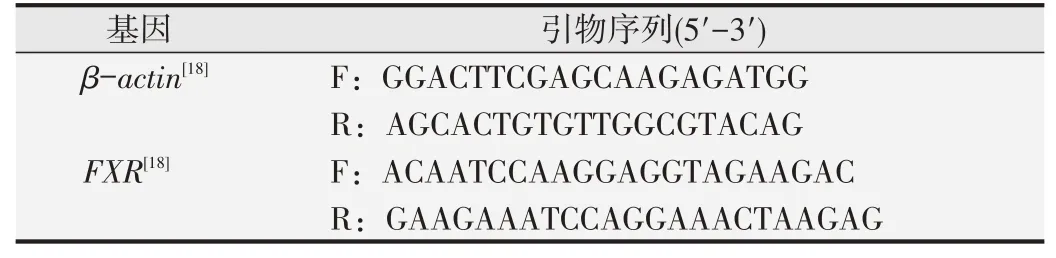
表2 PCR引物序列
1.2.3 Western blot
采 用Western blot检 测FXR及p53的蛋白水平。细胞贴壁后加入10 μmol/L的GW4064作用48 h,PBS洗涤后加入RIPA裂解液,放置在冰上裂解30 min,期间每隔5 min振荡1次。取裂解液4℃、12 000 r/min离心15 min,吸取上清液采用煮沸法变性后置-20℃保存。用10%的SDSPAGE电泳分离蛋白,采用湿转恒压100 V、75 min转移到硝酸纤维素(NC)膜上,将NC膜放入封闭液(含5%脱脂奶粉的TBST)中,室温下封闭60 min,然后滴加一抗4℃孵育过夜。次日TBST洗涤后,滴加二抗室温孵育1 h后曝光。蛋白条带用灰度值量化表示。β-actin作为阳性对照。1.2.4
MTT法检测细胞存活率
将CaSki细胞分别置于96孔板中,每孔3 000个细胞。当细胞贴壁后,加入DMSO或GW4064至培养基中继续培养24、48和72 h。弃去培养基后每孔加入不含血清的DMEM(内含10 μL浓度为5 mg/mL的MTT溶液),37℃孵育4 h,弃去培养基后每孔加入150 μL DMSO并振荡10 min。用多功能酶标仪在490 nm处读取吸光度值D
(490)。1.2.5 细胞凋亡率检测
将细胞接种于60 mm平皿中,加入DMSO或GW4064至培养基中继续培养24、48、72和96 h。采用胰酶消化法将细胞收集到EP管中,制成1×10个/mL的细胞悬液;PBS洗涤后,将100 μL预先配好的1×Annexin V结合液加入细胞沉淀中,加入5 μL Annexin V、FITC以及5 μL PI溶液,避光在室温中孵育15 min,加入1×Annexin V结合液400 μL;流式细胞仪检测细胞凋亡率,发光波长(Ex)为488 nm,激发波长(Em)为530 nm。1.3 统计分析
实验重复3次,数据用x
ˉ±s
表示,计量资料的比较采用单因素方差分析(one-way ANOVA),应用SPSS 22.0统计软件进行分析,以α=0.05为检验水准。2 结果
2.1 GW4064作用CaSki细胞后的FXR mRNA及蛋白表达水平
将DMSO及GW4064分别加入CaSki细胞培养基当中,分别于24和48 h提取mRNA和蛋白,检测FXR mRNA及蛋白表达水平。在CaSki细胞中,GW4064作用组FXR mRNA及蛋白水平均较DMSO组明显增加,差异具有统计学意义(图1,P
<0.05)。
图1 GW4064对CaSki细胞FXR mRNA和蛋白表达水平的影响
2.2 GW4064对CaSki细胞增殖的影响
CaSki细胞用GW4064处理24、48、72 h,通过MTT法检测细胞存活率,GW4064组较对照组均明显下降,差异均具有统计学意义(图2,P
<0.05),提示GW4064激活FXR后可抑制CaSki细胞的增殖。
图2 GW4064对CaSki细胞增殖的影响
2.3 GW4064作用后CaSki细胞的凋亡率
流式细胞术检测GW4064对CaSki细胞凋亡的影响(图3,P
<0.05)。与对照组相比,GW4064作用组CaSki细胞的早期及晚期凋亡率均增加;随着时间推移,早期凋亡率减少,而晚期凋亡率增加。这表明,诱导细胞凋亡可能是FXR发挥抑制细胞增殖的机制之一。
图3 流式细胞术检测GW4064作用后CaSki细胞的凋亡率
2.4 GW4064作用后CaSki细胞p53蛋白的表达水平
通过Western blot检测GW4064作用CaSki细胞48 h后p53蛋白的表达水平。与DMSO组相比,GW4064作用组CaSki细胞中p53蛋白的表达水平升高,差异具有统计学意义(图4,P
<0.05)。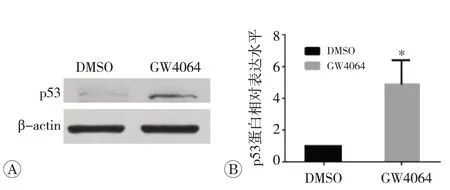
图4 GW4064对p53蛋白表达水平的影响
3 讨论
核受体家族与多种癌症发生发展有关,如肝癌、胰腺癌和胃癌等。我们前期的研究表明,与癌旁正常组织相比,孕烷X受体(pregnane X receptor,PXR)在宫颈癌组织中低表达,用PXR激动剂利福平及质粒转染过表达PXR可在体内及体外抑制宫颈癌细胞株的增殖。而PXR表达受到FXR受体调节,用胆酸或FXR激动剂GW4064喂养小鼠可造成强大的PXR诱导。在本研究中,FXR激动剂可在细胞水平抑制宫颈癌细胞株的增殖,证明激活FXR可在体外发挥抑制宫颈癌增殖的效应。
FXR通过调节肿瘤生长因子的表达和凋亡来影响癌细胞的增殖。在乳腺癌、睾丸癌、结肠癌等不同的肿瘤细胞株中,FXR激活均可引起细胞凋亡。FXR活化可通过激活某些信号通路,诱导细胞凋亡,从而影响肿瘤细胞增殖。FXR激活诱导宫颈癌细胞凋亡,可能与p53诱导凋亡有关。
p53
基因存在于染色体17p上,作为肿瘤抑制基因,控制细胞进入S期,p53在细胞增殖中起着重要的作用。p53突变抑制细胞增殖活性,与肿瘤增殖有关。p53肿瘤抑制因子在调节细胞生长、DNA修复和诱导细胞凋亡中起关键作用。本研究应用GW4064激活FXR,可以增加p53的蛋白表达水平,提示FXR激活至少部分通过增加p53表达对细胞凋亡发挥效应。综上所述,FXR对CaSki细胞株发挥促凋亡、抗肿瘤生成的作用。说明FXR在宫颈癌发生中起重要调控作用,有可能成为宫颈癌治疗的潜在靶点。
