用7种医疗用品原料比较家兔肌肉植入试验两种评价方法的检测敏感性
2021-08-01黄雅理高显己孙会敏
赵 霞,黄雅理,高显己,王 颖,孙会敏*,林 飞*
(中国食品药品检定研究院,北京100050)
家兔肌肉植入试验是将检测样品直接埋植于兔肌肉群中,在植入后不同时间观察组织反应的进程和演变,比较检测样品与对照样品的生物相容性,进行毒理学安全性评价。目前越来越多地用于体内埋植或注射等临床给予途径的新医疗器械和医疗用品原料的评价,而且一般用途均属于较高风险,需要采取特别措施严格控制管理以保证其安全性,临床前均按照国家标准(GB/T 16886.6)和国际标准化组织(ISO 10993-6)文件要求进行植入试验。但上述标准中对样品处理、植入方法和时间、观察判定方法等有不少可变条件,选择较高标准的试验条件对试验结果的准确判定意义重大。因此本实验室在应用该试验方法检测的样品中,选择颗粒、薄膜等7种不同产地的医疗用品原料,进行短期、中期和长期植入体内后的检测与评价,同时比较不同植入时间、不同观察方法的敏感性和可信性是否有差异。
1 材料与方法
1.1 材料
1.1.1 检测样品
选择不同材料、规格、产地的7种医疗用品原料,对照样品选择已应用于临床多年的进口原料,见表1。
表1 7种医疗用品原料相关情况
1.1.2 实验动物
清洁级新西兰白兔共84只,雄性,体质量2.4~3.0 kg,每种检测样品使用12只。源于中国食品药品检定研究院实验动物资源研究所,实验动物生产许可证SCXK(京)2019-0017号。实验动物使用许可证SYXK(京)2017-0013号,兔在实验动物室适应观察1周后进行实验。1.1.3 主要仪器
本研究使用的主要仪器包括:蒸汽灭菌器、电子天平、电热恒温干燥箱、组织病理学设备、生物显微镜、大视场工作仪、电动剃刀和手术灯。1.1.4 主要器械与试剂
实验使用下列器械与试剂:不锈钢2号标准筛(孔径850 μm)、10 mL注射器、医用剪刀、镊子、手术刀、止血钳、缝合针、丝线、3%戊巴比妥钠溶液、2%碘酊、75%乙醇溶液和10%甲醛溶液等。1.2 方法
1.2.1 样品制备
根据检测样品的形状不同,薄膜裁剪成长×宽=10 mm×3 mm;体积小于长×宽×高=10 mm×5 mm×3 mm的样品颗粒不需切剪。肉眼挑选均匀一致、周边没有锐角的作为植入样品,清洗、过滤、烘干,放置在玻璃平皿中,经高压灭菌(温度113℃、压力0.060 MPa、20 min)处理后用于试验。1.2.2 手术植入
电动剃刀去除兔腰背部以下脊柱两侧被毛,面积为15 cm×20 cm。3%戊巴比妥钠溶液麻醉,在脊椎两侧2.0~3.0 cm处,从第12胸椎至第5腰椎设4个植入点,每点间隔2.5 cm,深约1.5 cm,左侧植入检测样品,右侧植入对照样品。1.2.3 术后观察
植入后连续观察5 d植入点的皮肤反应,有无出血、红肿、样品颗粒移位或脱落等,第7天拆除切口缝合线。术后第15、30、60和90天分别称取每只动物体质量,每天观察动物整体状态,是否出现异常反应或濒死状态。1.2.4 解剖观察
植入后第15天(2周以上)、30天(4周以上)、60天(8周以上)和90天(12周以上)分别处死3只兔,切取包裹样品周围1.0~1.5 cm的肌肉组织,中间切开,暴露植入样品,大体观察植入部位组织有无异常病变;经固定、包埋、切片、染色后,每只兔检测样品组和对照样品组4个植入点各制备3张切片。1.2.5 组织反应病理学分级
生物显微镜高倍镜观察4个植入点各1张切片的囊腔壁炎症反应和肉芽形成程度,以及检测样品在植入组织中的形态学改变。观察最典型一个视野中纤维化囊腔壁厚度,新生血管形成、脂肪细胞浸润数量和炎性细胞数量及种类,进行统计分级。分级标准见表2。
表2 植入样品周围组织反应分级
1.2.6 组织反应半定量评价计数
生物显微镜高倍镜观察4个植入点各3张切片,计数一个视野中囊腔壁的炎性反应个数×2(包括嗜中性粒细胞、淋巴细胞、浆细胞、巨噬细胞、嗜酸性粒细胞及坏死细胞数量等)和组织反应(包括新生血管形成个数、纤维化厚度、脂肪细胞浸润个数等)。计算检测样品平均数值与对照样品平均数值的差值。1.2.7 级别和分值判定
每组3只兔检测样品组与对照样品组的平均分值比较,组织反应级别相同或平均分值的差值在0~2.9数值范围为无刺激;组织反应级别相差Ⅰ个等级或平均分值的差值在3.0~8.9为轻度刺激;组织反应级别相差Ⅱ个等级或平均分值的差值在9.0~15.0为中度刺激;组织反应级别相差Ⅲ个等级或平均分值的差值>15.0为重度刺激。2 结果
2.1 一般状况观察
植入后第1~5天观察各植入点切口无出血、样品在植入腔内无排出,皮肤无红肿。在植入各时间范围内动物精神好,外观及行为正常,活动自如,未见明显异常反应或濒死状态。
2.2 体质量增长
选择植入90 d组各检测样品3只兔平均体质量见表3。植入后至取材前各时间点兔平均体质量增长基本正常,未发现各检测样品对兔的体质量产生明显影响。

表3 兔植入样品各时间点体质量增长观察
2.3 大体观察
在植入检测样品后第15、30、60和90天各组动物分别处死3只,手术暴露植入样品,其植入部位组织未见血肿、水肿、炎症和明显囊腔纤维化等病变;检测样品和对照样品颗粒大小和形态与植入前基本一致,未见降解和吸收。
2.4 组织反应分级
显微镜观察7种检测样品和对照样品每个植入点1张切片,根据炎症反应和纤维囊腔形成的程度和数量其进行组织反应分级,发现检测样品在植入后第15天存在炎症反应II级6个,纤维囊腔II级3个;植入后第30天存在炎症反应II级4个,纤维囊腔II级3个;植入后第60天存在炎症反应≥II级4个,纤维囊腔≥II级3个;植入后第90天存在炎症反应II级1个,纤维囊腔≥II级2个(见图1)。与对照样品比较,组织反应级别相差Ⅰ个等级有轻度刺激性的是植入后第60天的3号样品以及植入后第90天的3、5号样品(见表4)。
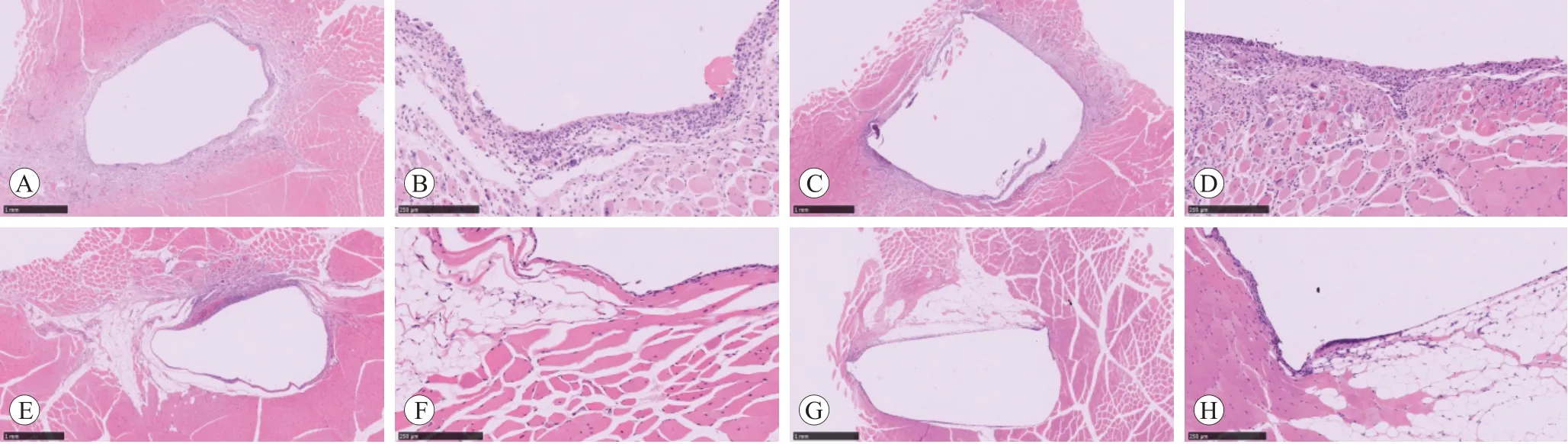
图1 显微镜观察植入部位肌肉组织纤维囊腔形成和炎症反应分级

表4 7种检测样品植入不同时期组织反应分级
2.5 半定量评价计分
显微镜观察7种检测样品和对照样品植入点的炎性反应和组织反应,计算平均分值的差值,发现植入后第15天均<2.9,为无刺激性;植入后第30天5号样品为4.5,为有轻度刺激性;植入后第60天3、4、6号样品为6.4、3.0、3.2,有轻度刺激性;植入后第90天3、5号样品为7.5、3.2,有轻度刺激性(见表5~表8)。

表5 7种检测样品植入第15天半定量评价分值统计

表8 7种检测样品植入第90天半定量评价分值统计
2.6 各植入时间点组织病理学比较
检测样品植入第15天,样品周围组织反应主要是炎性细胞浸润和水肿为主,成纤维细胞和毛细血管构成的肉芽组织和少量脂肪细胞;植入后第30天,样品周围肌肉组织和结缔组织处于快速修复状态,新生毛细血管中度增生,炎性细胞浸润和水肿明显好转;植入后第60~90天,样品周围肌肉组织和结缔组织呈稳定状态,新生毛细血管逐渐消失,脂肪细胞浸润增加,炎性细胞浸润和水肿基本消失(见表9)。
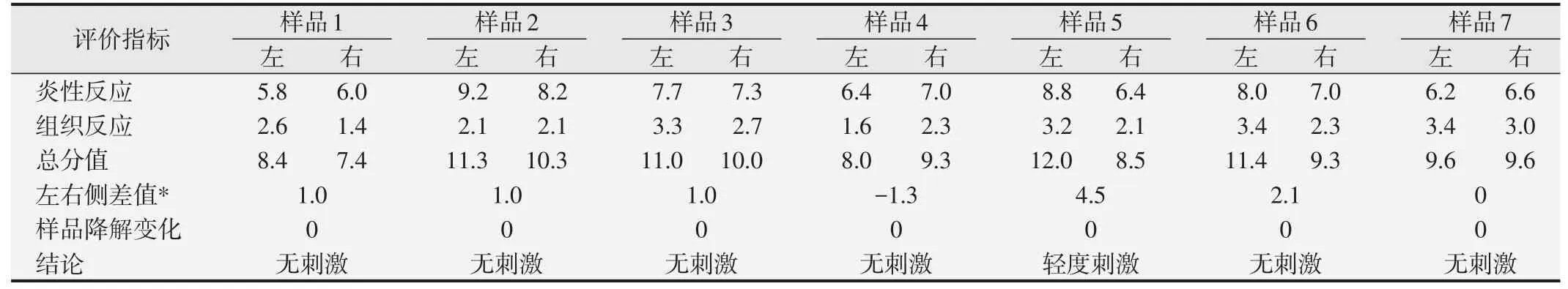
表6 7种检测样品植入第30天半定量评价分值统计

表7 7种检测样品植入第60天半定量评价分值统计

表9 非降解吸收样品对各植入期的组织病理学反应特点*
3 讨论
对医疗用品原料进行生物相容性评价时,一般采用中华人民共和国国家标准GB/T 16886.6和国际标准化组织ISO 10993-6等规范要求进行。国家标准GB/T 16886.6-2015版与GB/T 16886.6-1997版 相比,主要采用ISO 10993-6:2007版内容,增加了附录E半定量分值评价法的具体实施细则,对植入样品数量、观察切片数量、可降解/可吸收材料应用、判定标准及打分细则等均作了明确规定。但仍保留了国家标准GB/T 16886.6-1997版组织反应分级法相关内容。两种检测方法在判定检测样品时,结果是否一致,哪个更敏感、可信度更高,是本研究关注的内容。
本研究结果表明,组织反应分级法检出有轻度刺激性的是植入后第60天的1个样品,植入后第90天的2个样品;半定量分值评价法检出有轻度刺激性的是植入后第30天的1个样品,植入后第60天的3个样品,植入后第90天的2个样品。其敏感性明显提高、检出率明显增加,其原因主要是后者将炎细胞分类更细致且明确,计数的分数值放大了2倍(分值×2),判定刺激性平均分值的差值范围标准固定,每只动物植入点显微镜观察由3~4张切片增加到10~12张切片,切片数增加可减少平均分值个体误差,更具有代表 性。由此显示半定量分值评价法其检出率增加、敏感性、可信性提高,更能确切反应出受试样品与肌肉组织生物相容性的刺激程度。
样品植入周期的设计要充分考虑材料特性和体内滞留期的长短,确保植入物在体内生物学组织反应达到稳定状态,以完整评价其生物相容性。对7种检测样品和对照样品分别植入到兔同体左侧或右侧脊柱旁肌,进行短期15和30 d、中期60 d和长期90 d术后观察,通过组织病理学观察、分级、半定量计分,评价周围组织的反应程度。结果显示植入后第15天,样品周围组织反应主要是炎性细胞浸润和水肿为主,与手术切口的大小、无菌操作、愈合恢复状态密切相关,区分创伤反应和植入物刺激反应较困难,检出假阴性和假阳性率较高。植入后第60天观察,样品周围肌肉组织和结缔组织呈稳定状态,炎性细胞浸润和水肿基本消失,新生毛细血管逐渐消失,脂肪细胞浸润增加,纤维囊腔存在轻微~轻度增生。检测样品如存在刺激性,其炎症反应和纤维囊腔形成明显加重,检出率和可信性相对提高。
金属材料、高分子材料、陶瓷材料以及复合材料等在临床上用途广泛。原材料的风险性定位分为低度风险、中度风险和高度风险。人工器官、血管支架、血管内导管、植入器材、手术黏合剂、封堵剂、一次性输液器、输血器,注射用内包装等属于高度风险材料,需要进行多项毒理学试验以及严格安全性审评才能进入临床,而动物植入试验是仿照临床给予途径、接触部位和接触时间,评价其局部刺激和全身毒性反应,目前该试验更倾向与亚慢性毒性试验或慢性毒性试验结合,增加剂量(体积或数量)、增加全身检测项目(血液学、生化学、组织脏器等),以满足生物材料和生物功能对不同患者自我康复能力,实现病变或缺损组织及器官的永久修复。
