基于TCGA数据分析CX43表达在胶质瘤中的临床意义及其与免疫细胞浸润的关系
2021-08-01郑建涛
郑建涛,杨 勇,周 东,*
(1.华南理工大学医学院,广东 广州510006;2.广东省人民医院/广东省医学科学院,广东广州510080)
胶质瘤是最常见的原发性颅内恶性肿瘤,占脑肿瘤的50%左右。目前针对胶质瘤标准的治疗方案主要为最大安全范围的手术切除联合术后放疗和化疗,但是在标准治疗方案下,胶质瘤患者的预后依然不佳,5年生存率约为10%。2016版WHO中枢神经系统肿瘤分类首次将分子病理类型纳入胶质瘤病理诊断,其中异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变、1号染色体短臂和19号染色体长臂(1p/19q)共缺失的患者预后较好,是胶质瘤重要的预后指标。然而不同分子病理分型胶质瘤的发生机制尚未完全明确,因此探索其中潜在的基因差异表达具有重要意义。
连接蛋白43(connexin 43,CX43)是重要的连接蛋白之一,以缝隙连接或半通道的形式参与肿瘤微环境的调节。在胶质瘤领域,目前在基础试验中发现CX43的表达增加可促进肿瘤细胞生长及侵袭。然而关于CX43
基因与神经胶质瘤临床病理特征及免疫微环境间的报道较少。本文旨在利用生物信息学的方法探索CX43
基因表达与胶质瘤病理特征、预后的关系及其在肿瘤免疫微环境中的作用。1 材料与方法
1.1 样本来源
通过癌症基因组图谱(The Cancer Genome Atlas,TCGA,https://portal.gdc.cancer.gov/)下载TCGA胶质瘤患者RNA-Seq表达谱数据及临床相关数据。剔除数据不完整的部分样本,最后纳入分析的病例共592例,其中低级别胶质瘤(lower grade glioma,LGG)组包含WHO II级和III级共449例,IV级为胶质母细胞瘤(glioblastoma multiforme,GBM)组共143例。
同时回顾性收集广东省人民医院神经外科2019年4月—2020年4月胶质瘤患者术后石蜡标本切片及临床信息共34例。
1.2 实验方法
1.2.1 评价
CX43
基因在具有不同病理特征的胶质瘤患者中的表达情况
按LGG及GBM组别、IDH突变情况和1p/19q是否共缺失状态比较胶质瘤患者中CX43 mRNA的表达情况。1.2.2 评估
CX43
基因表达对胶质瘤预后的影响
以CX43
基因表达水平的中位数为界限进行分组,大于等于中位数者列为CX43高表达组,低于中位数者列为CX43低表达组。使用Kaplan-Meier生存分析曲线图,应用log-rank检验方法比较CX43
基因高表达组及低表达组的预后差异。1.2.3 基因集富集分析
基因集富集分析(gene set enrichment analysis,GSEA)是一种计算方法,对输入基因集的组间差异进行排序,从而确定其在不同生物学功能及信号通路中的富集情况。将胶质瘤标准化的mRNA数据集分为CX43高、低两个表达组。在GSEA(4.1.0)版本中,选择“h.all.v7.2.symbols.gmt”注释基因集、表型标签选择“高表达或低表达”,置换次数选择1 000次。结果中归一化富集分数(normalized enrichment score,NES)>1.5、名 义 上(nominal,NOM)P
<0.05且错误发现率(false discovery rate,FDR)q
<0.25被认为差异具有统计学意义。1.2.4
CIBERSORTx免疫浸润分析
CIBERSORTx(https://cibersortx.stanford.edu/)是由Alizadeh实验室和Newman实验室开发的一款分析工具,用于估算基因表达谱,并使用基因表达数据估算混合细胞群体中成员细胞类型的丰度。首先,将标准化的mRNA数据集上传到CIBERSORTx上,利用网页分析工具,选择排列置换次数1 000次,可得到22种免疫细胞在各样本中的含量。进而比较CX43高、低表达组间各种免疫细胞的成分。1.2.5 临床样本免疫组化染色
石蜡标本切片,脱蜡水化,微波抗原修复、3%双氧水阻断,10%山羊血清封闭,CX43一抗(购自博士德公司,货号BA1727,按1∶150稀释)4℃孵育过夜,复温漂洗后孵育二抗、漂洗后使用DAB显色剂显色、苏木素复染、脱水晾干后封片,显微镜观察。同法检测M2样巨噬细胞分子标志CD163,其中CD163一抗购自Abcam公司,抗体按1∶500稀释。CX43免疫组化结果判读,根据免疫组化的染色强度将无明显染色计为0分,浅黄色计为1分,棕黄色计为2分,棕褐色计为3分。然后按染色面积评为:≤10%为0分,10%~25%(含)为1分,25%~50%(含)为2分,50%~75%(含)为3分,>75%为4分。两项评分相乘为最终评分,评分≤6分为CX43低表达组,>6分为CX43高表达组。M2样巨噬细胞分子标志CD163免疫组化结果判读,在显微镜下评估CD163阳性肿瘤相关巨噬细胞的数量。随机选择5个高倍镜视野(×400倍),将每个高倍视野的标记细胞计数后,取平均数代表该样本中CD163阳性M2样巨噬细胞的浸润数量。1.3 统计学方法
使用R语言4.0.0版本进行统计分析并作图。组间连续变量比较使用Student'st
检验,组间率的比较使用卡方检验。以α=
0.05为检验水准。2 结果
2.1 CX43 mRNA表达与胶质瘤临床病理特征的关系
CX43 mRNA的表达水平在LGG及GBM组间比较差异无统计学意义(图1A)。在IDH突变型组中CX43 mRNA的表达水平显著低于IDH野生型组(图1B,P
<0.01)。1p/19q无共缺失组中CX43 mRNA的表达水平较共缺失组显著升高(图1C,P
<0.01)。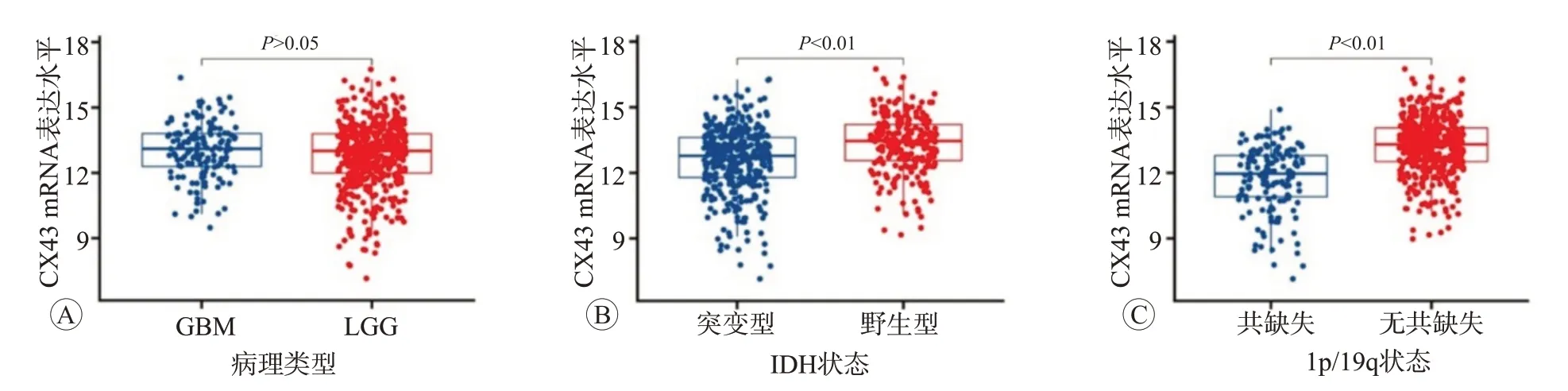
图1 CX43 mRNA表达水平与各临床病理特征的关系
2.2 CX43表达与胶质瘤患者预后的关系
Kaplan-Meier生存分析提示CX43 mRNA低表达组在胶质瘤中具有更好的预后(图2,P
<0.01)。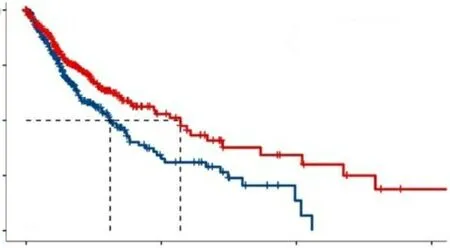
图2 CX43 mRNA表达水平与胶质瘤患者生存率的关系
2.3 CX43相关的GSEA富集分析
CX43
基因高表达组利用GSEA分析在9个特征基因集中富集(NOM,P
<0.05;FDR,q
<0.25)(表1)。其中与免疫相关的通路包括了白细胞介素-2(inteleukin 2,IL-2)/信号转录与激活因子5(signal transducer and activator of transcription 5,STAT5)信号通路、白细胞介素-6(inteleukin 6,IL-6)/Janus激酶(Janus kinase,JAK)/信号转录与激活因子3(signal transducer and activator of transcription 3,STAT3)信号通路、炎症反应等通路。结果提示CX43
基因高表达对胶质瘤的作用与免疫浸润相关。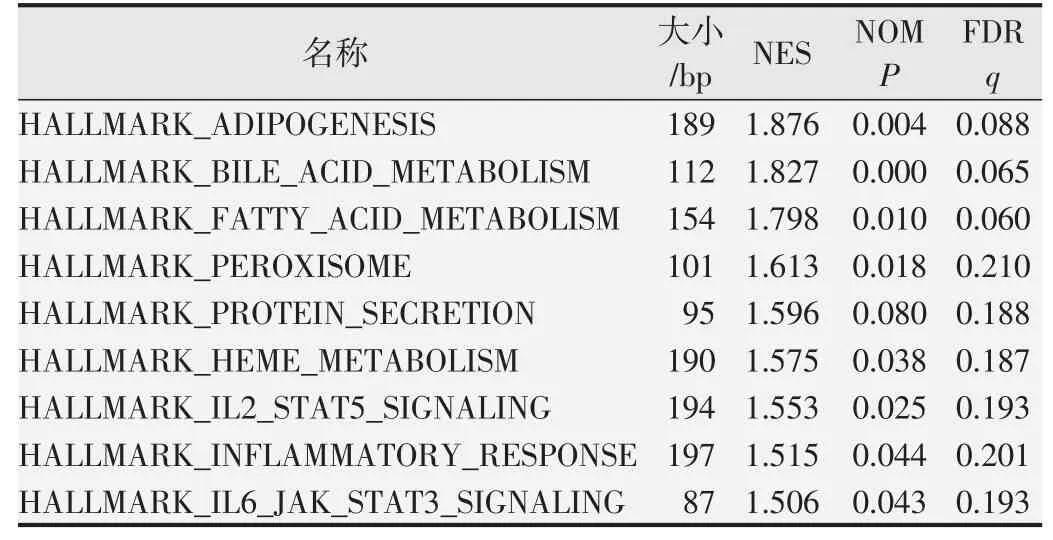
表1 GSEA富集分析
2.4 CX43 mRNA高、低表达组间免疫细胞的丰度差异
比较CX43 mRNA高、低表达组中22种免疫细胞丰度的差异(图3),结果提示幼稚CD4 T细胞、滤泡辅助性T细胞、活化NK细胞、巨噬细胞M0表型在CX43低表达组比高表达组升高,差异均具有统计学意义(P
<0.05)。而在CX43 mRNA高表达组显著升高的为单核细胞、巨噬细胞M2表型、活化树突状细胞。
图3 CX43 mRNA高、低表达组间免疫细胞的丰度差异
2.5 免疫组化分析结果
免疫组化检测CX43蛋白在具有不同临床病理特征的胶质瘤患者间的表达水平见图4,结果提示1p/19q有、无共缺失和M2样巨噬细胞标志物CD163细胞数在CX43蛋白高、低表达组间存在差异。1p/19q无共缺失的比例及M2样巨噬细胞(CD163细胞)数在CX43蛋白高表达组中增加(P
<0.05,表2)。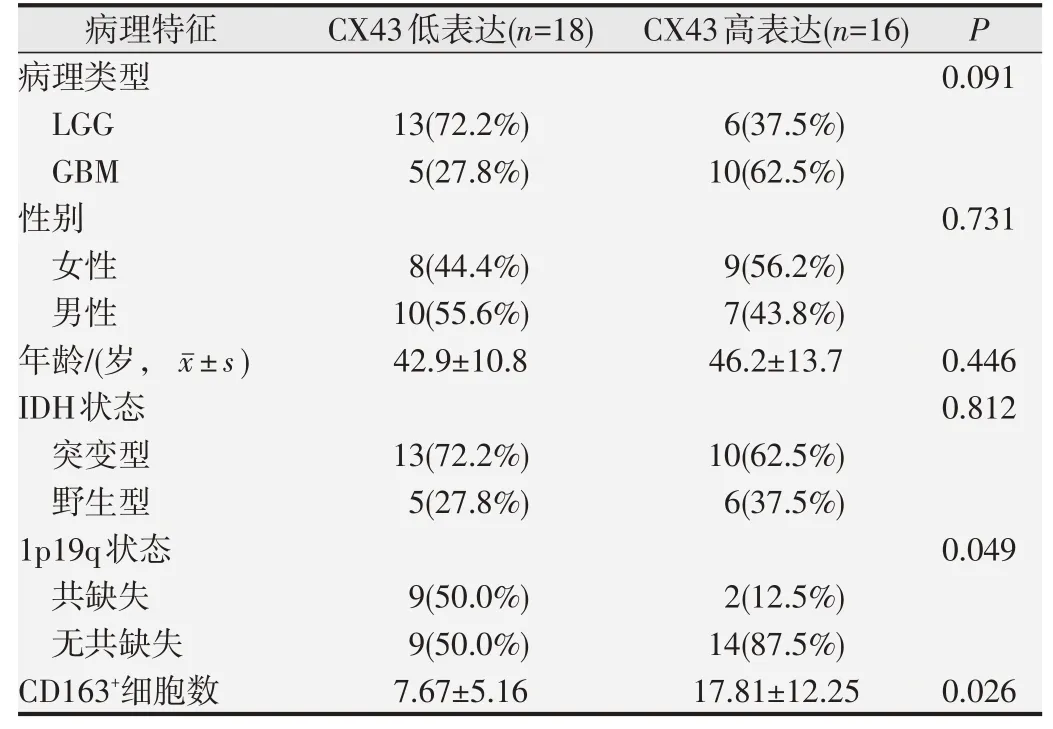
表2 免疫组化检测CX43蛋白在具有不同临床病理特征的胶质瘤患者间的表达差异
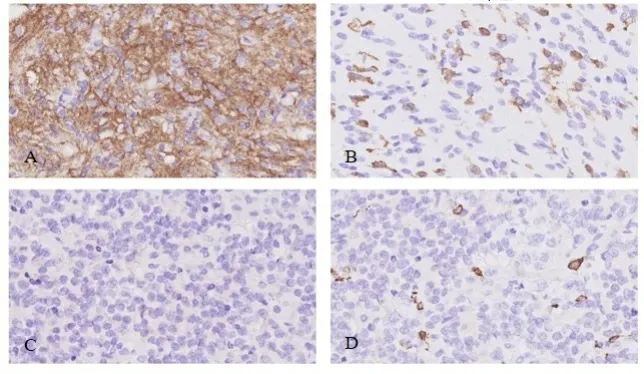
图4 胶质瘤组织中CX43及CD163表达情况的免疫组化检测结果
3 讨论
目前对胶质瘤的认识已经从原有的组织病理诊断过渡到分子病理诊断,IDH突变、1p/19q共缺失等分子标志物被用于胶质瘤的诊断、预后评价及治疗,但胶质瘤的治疗效果仍不佳,中位生存期为20~36个月。因此利用生物信息学对公共数据库的分析挖掘,可发现新的胶质瘤差异基因,有助于未来胶质瘤的诊断和治疗。
CX43蛋白在人体所有细胞中均有表达,是维持细胞正常生理功能的重要蛋白,负责相邻细胞间或与细胞外环境的物质传递,其中包括重要的信号分子和细胞代谢产物。随着对CX43研究的深入,其在肿瘤中的作用被不断发现,CX43蛋白高表达与黑色素瘤、原发性胆管癌的不良预后相关,CX43
基因的过表达促进乳腺癌及黑色素瘤的远处转移。CX43对胶质瘤的作用集中在基础试验及免疫组化检测CX43的表达与胶质瘤临床特征方面。CX43
基因表达水平与胶质瘤临床分子病理特征及预后的研究较为少见。本文通过对TCGA数据库的生物信息分析及临床病理标本免疫组化的结果提示,CX43 mRNA在IDH野生型及1p/19q无共缺失组中高表达,且生存分析中提示CX43
基因高表达组的总体生存期更短。既往的研究表明IDH野生型胶质瘤对放化疗的反应较IDH突变型差,其无进展生存期及总体生存期均显著缩短。同样,1p/19q无共缺失的患者其中位生存期明显缩短。可见CX43
基因高表达与胶质瘤预后较差的分子病理分型相关,这可能是CX43
基因高表达生存预后更差的原因之一。Hong等发现胶质瘤细胞与星形细胞可利用CX43形成缝隙连接,传递microRNA促进胶质瘤的侵袭性,而在沉默CX43
基因表达后可消除该作用。另外CX43的表达可使胶质瘤细胞对替莫唑胺的化疗形成耐药性,从而促进肿瘤进展。这提示IDH野生型、1p/19q无共缺失的胶质瘤可能通过CX43高表达对化疗产生抵抗,从而影响患者的预后,而以CX43为靶点的治疗方法可能是未来胶质瘤治疗的重要途径之一。基于GSEA分析的结果提示CX43 mRNA高表达的胶质瘤与IL-2、IL-6、炎症免疫通路富集,而CIBERSORTx分析结果提示CX43 mRNA高表达的胶质瘤M2型巨噬细胞的比例增高。已知肿瘤免疫细胞浸润对肿瘤的生长起促进作用,尤其是M2型巨噬细胞可释放相关免疫因子促进肿瘤细胞的生长,而与之对应的M1型巨噬细胞具有杀伤肿瘤的作用。故将M2型巨噬细胞极化为M1型巨噬细胞或抑制巨噬细胞向M2表型极化是免疫治疗中攻克恶性肿瘤的突破点。IL-6是巨噬细胞向M2表型极化的因子之一,在胰腺导管腺癌中,IL-6是诱导巨噬细胞向M2表型极化的信号因子。另外,在卵巢癌中被证实减少IL-6的表达可以通过JAK/STAT3信号通路抑制巨噬细胞向M2表型的转化。在胶质瘤的研究中M2型巨噬细胞的增多可促进肿瘤细胞生长,而使用绿原酸可将M2型巨噬细胞重新极化为M1型巨噬细胞,从而抑制胶质瘤生长。结合本文结果提示,CX43的高表达可能通过IL-6/JAK/STAT3信号通路调控胶质瘤微环境中巨噬细胞向M2表型极化,使M2型巨噬细胞增多从而导致肿瘤的进展及不良预后。而针对CX43
基因的治疗可能成为改善胶质瘤免疫微环境的治疗手段,值得进一步研究。综上所述,通过对TCGA数据库的分析及临床标本验证,提示CX43高表达与1p/19q无共缺失状态相关,CX43
基因高表达为胶质瘤不良预后的指标。且CX43高表达与IL-6免疫通路相关并伴随M2型巨噬细胞增多提示CX43高表达可能为巨噬细胞向M2表型极化的促进因素。后期针对CX43与巨噬细胞M2表型极化作用的分子机制的研究,可能是对胶质瘤治疗新的探索方向。