杨树转录因子PsnNAC030基因功能1)
2021-07-30王雪怡张雪梅程紫涵刘霖姜廷波刘焕臻
王雪怡 张雪梅 程紫涵 刘霖 姜廷波 刘焕臻
(林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040)
植物在生长过程中经常遭受盐碱、干旱、极端温度等各种非生物胁迫的影响,导致植物发育矮小、作物产量降低,甚至造成死亡,严重影响农林业生产和生态环境[1-3]。土壤盐渍化是荒漠化和土地退化的主要类型之一,高盐环境已成为我国乃至全世界最主要也是影响范围最广泛的环境胁迫因子[4-5]。过量的盐分可以通过渗透胁迫、离子毒害等途径改变植物的细胞膜透性和营养状况,减少植物对营养元素的吸收并造成植物生理代谢的紊乱,影响植物的生长、发育和再生[5]。由于全球气候变暖,加快地面水分蒸发,导致世界上很多地区水供应减少,而缺水(干旱)也成为限制植物生长发育的主要影响因子之一。干旱环境往往会抑制芽生长和新叶萌生、促进老叶衰老等[6-10],与极端温度相似,也会通过蛋白质变性、产生活性氧以及细胞膜不稳定等方式来破坏细胞成分,对植物生长发育产生不利影响[11-16]。因此,当植物处于逆境下迅速激活保护机制来维持其自身细胞稳定是非常重要的。
植物内存在一系列转录因子,比如NAC、WRKY、AP2/ERF、bZIP、MYB等转录因子家族基因[17],当植物处于逆境胁迫环境时,转录因子基因能够应答环境胁迫或受环境胁迫因子诱导表达,通过基因启动子中的顺势作用元件调控下游功能基因的表达,从而调控其生长发育以及对环境胁迫的适应能力[18-19]。其中,NAC是植物所特有的且具有多种生物功能的转录因子,目前在毛果杨(Populustrichocarpa)和胡杨(P.euphratica)中分别发现170和145个NAC转录因子基因,在其他植物如拟南芥(Arabidopsisthaliana)、水稻(Oryzasativa)、小麦(Triticumaestivum)等也都相继发现NAC转录因子[20]。NAC转录因子基因不仅参与植物生长[21]、胚胎发育[22]、花形态发生[23]、叶片细胞程序性死亡[24]、侧根形成[25]、细胞分裂[26]和细胞壁发育[27]等植物生长发育过程,还在逆境胁迫应答过程中发挥重要作用。如Movahedi等[28]发现在过表达CarNAC3转基因杨树(P.deltoides×P.euramericanacv‘Nanlin895’)中,脯氨酸和光合色素水平增加,并且相对于野生型其耐盐性显著增强;水稻SNAC1基因主要在气孔的保卫细胞中被诱导表达,干旱胁迫时促进气孔关闭,可以提高水稻的抗旱性[29];通过表达小麦TaNAC2基因可以增强转基因拟南芥对干旱、盐、冷冻胁迫的耐受性[30]。
小黑杨主要分布在我国东北、西北、华北等地区,具有较强的适应能力及抗盐碱、抗旱、抗寒等优良特性,是速生丰产的好树种;同时也是我国重要的造林、绿化树种以及林木基因工程和生理功能研究的模式植物[31-33]。本研究从小黑杨中克隆出PsnNAC030基因,分析其在不同胁迫条件下的表达模式,为明确其在杨树中抗逆胁迫机制和生物功能提供参考依据。
1 材料与方法
以生长状态良好的小黑杨组培苗为试验材料,生长条件为14 h光/10 h暗、(24±1)℃、相对湿度60%~70%。采集完全舒展的叶片提取RNA,反转录合成cDNA后作为模板用于PsnNAC030基因的克隆。
将组培时间为一个月且长势一致的小黑杨组培苗洗净培养基后清水培养30 d左右,长出新的根、茎、叶后,分成5组,分别用于NaCl、干旱、高温、低温、ABA胁迫处理,其中NaCl胁迫:用150 mmol/L NaCl溶液处理小黑杨幼苗;干旱胁迫:无水处理小黑杨幼苗;高温胁迫:在培养箱37 ℃处理小黑杨幼苗;低温胁迫:在培养箱4 ℃处理小黑杨幼苗;ABA胁迫:用50 μmol/L ABA处理小黑杨幼苗。在上述处理0、3、6、12、24和48 h时,对小黑杨幼苗的叶片、茎、根组织分别进行取样。NaCl、干旱、ABA胁迫处理培养条件为14 h光/10 h暗、24 ℃、相对湿度60%;高温、低温胁迫处理培养条件为14 h光/10 h暗、37 ℃和4 ℃、相对湿度60%。所有处理及每个时间点均包含3个生物重复。
1.1 杨树转录因子PsnNAC030基因的克隆
根据Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)在线软件获取毛果杨(P.trichocarpa)转录因子基因(Potri.002G081000.1)的CDS序列,以该序列为参照设计长为24 bp的引物NAC030F1(5’-ATGACGGCGGCAACATTAGAGTTA-3’)和NAC030R1(5’-TCAAAACGGCTTCTGCAGGTGCAT-3’),以小黑杨cDNA为模板,按照预变性95 ℃,3 min;变性95 ℃,30 s;退火52 ℃,30 s;延伸72 ℃,1 min,34轮循环;再延伸72 ℃,10 min的PCR反应程序扩增PsnNAC030基因。
1.2 杨树转录因子PsnNAC030基因的生物信息学
获取长度正确的PsnNAC030基因条带,并且胶回收送至擎科生物公司测序,利用NCBI数据库Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)将测序所得序列与毛果杨Potri.002G081000.1的CDS序列和氨基酸序列进行比对,将比对率高的序列进行生物信息学分析。
利用ExPASy在线软件提供的Protparam软件(https://web.expasy.org/cgi-bin/protparam/protparam)对PsnNAC030基因的分子量、等电点等相关理化性质进行分析,并用ExPASy提供的Protscale(https://web.expasy.org/cgi-bin/protscale/protscale)预测PsnNAC030基因疏水性;根据TMHMM Server v.2.0(http://www.cbs.dtu.dk/cgi-bin/webface2.fcgi?jobid=5D47A7600000337DC54C5365&wait=20)对PsnNAC030基因的跨膜区进行分析;通过在线软件SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)分析PsnNAC030蛋白的二级结构,并用SWISS-MODEL(https://swissmodel.expasy.org/interactive/YgkGJD/models/)预测PsnNAC030蛋白的三级结构。
利用Structure(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测PsnNAC030蛋白的保守结构域,然后根据BlastP(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp)获取与PsnNAC030氨基酸序列同源性较高的不同物种,利用ClustalW软件进行多序列比对,并用MEGA6.0软件构建系统进化树。
1.3 PsnNAC030-GFP融合表达载体的构建及亚细胞定位
将条带正确的PsnNAC030基因胶回收产物作为模板,以NAC030F3(5’-GGGTCGACTGACTAGTATGACGGCGGCAACATTAGAGT-3’)和NAC030R3(5’-TGCTCACCATACTAGTAAACGGCTTCTGCAGGTGCA-3’)为引物进行PCR扩增(下划线处均为加入的酶切位点SpeI),然后用1%琼脂糖凝胶跑胶检测并胶回收。将GFP质粒经过SpeI酶切线性化后胶回收,向微型离心管内分别加入1 μL GFP线性化产物、4 μLPsnNAC030基因胶回收产物和5 μL Infusion酶,置于水浴锅50 ℃内连接20 min,然后迅速冰浴5 min,接着将连接产物转化入大肠杆菌TOP10。从载体上设计引物pBI121F和pBI121R,通过PCR扩增检测单克隆菌落,将条带正确且测序正确的菌落扩大培养,次日进行质粒提取,形成包含PsnNAC030-GFP融合蛋白的植物重组表达载体。
通过基因枪瞬时转化法[31]将阳性对照GFP质粒和融合表达蛋白PsnNAC030-GFP分别转化入洋葱表皮,置于黑暗条件下共培养48 h,之后在激光共聚焦显微镜(LSM 700,Zeiss,Germany)下观察绿色荧光蛋白的表达。
1.4 pGBKT7-NAC030融合表达蛋白的获得及自激活活性
以PsnNAC030基因胶回收产物作为模板,设计引物NAC030F4(5’-CATATGATGACGGCGGCAACATTAGAGT-3’,下划线处为酶切位点NdeI)和NAC030R4(5’-GTCGACTCAAAACGGCTTCTGCAGGTGC-3’,下划线处为酶切位点SalI)进行PCR扩增并胶回收,向胶回收产物和pGBKT7质粒中分别加入NdeI和SalI限制性核酸内切酶,双酶切后进行胶回收,另取PCR管加入4 μL基因胶回收产物、1 μL pGBKT7线性化产物和5 μL T4连接酶过夜连接,然后转化大肠杆菌,将获取的阳性转化子扩大培养并提取质粒,命名为pGBKT7-NAC030。根据CloneTech酵母双杂试剂盒提供的方法,将阴性对照pGBKT7质粒,阳性对照pGBKT7-53-pGADT7以及融合表达蛋白pGBKT7-NAC030质粒分别转入酵母菌株Y2Hgold,并分别涂布于SD/-Trp、SD/-Trp/-His和SD/-Trp/-His/X-a-Gal培养基上进行验证。
1.5 PsnNAC030基因表达的qRT-PCR
为了探究PsnNAC030基因经过NaCl、干旱、高低温、ABA胁迫诱导后在小黑杨各个组织中的相对表达量,提取处理后小黑杨各组织样品的RNA,反转录成cDNA用于实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)分析。
根据定量引物设计原则,在PsnNAC030基因的非保守结构域设计引物NAC030F2(5’-GGCTGGATGATTGGGTAC-3’)和NAC030R2(5’-CCGTCGGATTCGCTTTCT-3’)进行qRT-PCR,反应程序为:95.0 ℃ 30 s,95.0 ℃ 5 s,60.0 ℃,34 s,95.0 ℃ 15 s,60.0 ℃ 1 min,95.0 ℃ 15 s,置于定量PCR仪7500 Real Time PCR System中。根据2-ΔΔCt法[31]分析数据,计算目的基因PsnNAC030的相对表达水平。
1.6 数据处理
使用Excel 2010统计数据的平均值和标准误差。采用Excel 2010 Student’s T-Test进行差异显著性方差分析,在0.01和0.05水平下检验各组之间的差异显著性。
2 结果与分析
2.1 杨树转录因子PsnNAC030基因的克隆与生物信息学
通过PCR扩增从小黑杨组织中克隆出长度为876 bp的PsnNAC030基因cDNA片段(图1),该基因编码291个氨基酸。根据NCBI数据库Blast核苷酸和氨基酸序列比对发现,小黑杨PsnNAC030基因的核苷酸序列和氨基酸序列与毛果杨Potri.002G081000.1基因的同源比对率分别达到98.97%和98.63%。
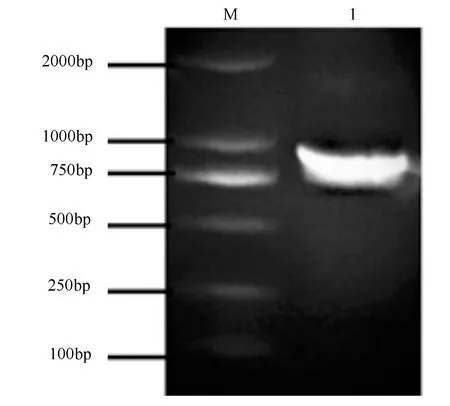
M为DL2000;1为PsnNAC030基因条带。
对小黑杨PsnNAC030基因进行生物信息学分析表明,PsnNAC030蛋白的氨基酸分子质量为33 270.73,分子式为C1496H2291N401O439S11,共包含4 638个原子,理论等电点(pI)为6.40,不稳定系数(II)计算值达到52.03(II>40不稳定,II<40稳定),脂肪系数(AI)为68.73,总平均亲水性(GRAVY)是-0.666(GRAVY>0疏水性蛋白,GRAVY<0亲水性蛋白),因而该蛋白为不稳定的亲水性蛋白。另外,通过TMHMM Server v.2.0分析表明小黑杨PsnNAC030蛋白是非跨膜蛋白,不含跨膜区域。对该蛋白序列进行二级结构预测显示,该蛋白包含19.59%的α螺旋、12.37%延伸链(Extended strand)、4.12%的β转角和63.92%的不规则螺旋。该蛋白的三级结构预测结果如图2所示,由4个α螺旋(α1、α2、α3和α4)和多个β折叠相互缠绕并通过多个循环连接形成具有一定规律的二聚体三维空间结构。

图2 SWISS-MODEL同源建模预测PsnNAC030蛋白的三级结构
系统进化树和同源序列比对表明小黑杨PsnNAC030蛋白在第9到第132个氨基酸之间有一个高度保守的NAM(No apical meristem,非顶端分生组织)结构域(如图3A)。该结构域由124个氨基酸组成,与毛果杨PtrNAC030(Potri.002G081000.1)、PtrNAC034(Potri.005G180200.1)和胡杨XP_011027492.1高度同源,同源比对率分别为98.63%、87.37%和97.59%(图3B和3C)。

A.PsnNAC030蛋白的保守结构域预测;B.PsnNAC030同源蛋白序列的系统进化树分析;C.同源序列比对,黑方框内为高度保守结构域NAM。
2.2 杨树PsnNAC030蛋白的亚细胞定位
如图4A所示,将35S::GFP质粒用SpeI酶切线性化后在2 000 bp以上有一条清晰的条带,小黑杨PsnNAC030基因以NAC030GFP-F和NAC030GFP-R为引物扩增后获得两端加入SpeI酶切位点且不含终止密码子的PsnNAC030片段,经过注入同源重组连接并转入TOP10大肠杆菌,挑取单菌落以pBI121F和pBI121R为引物进行PCR检测,将片段长度为2 200 bp左右的单菌落(图4B)扩大培养并提取质粒用于基因枪瞬时转化。
如图5所示,经过基因枪轰击法转化洋葱下表皮细胞发现,阳性对照35S::GFP在细胞内全表达,即在细胞核、细胞质、细胞膜等均有绿色荧光出现,而融合表达蛋白PsnNAC030-GFP仅在细胞核内出现明亮的绿色荧光,证明PsnNAC030蛋白定位在细胞核中。

A.35S::GFP质粒单酶切与PsnNAC030扩增,M为DL2000;1为35S::GFP经过SpeI酶切后的条带;2为PsnNAC030经过NAC030GFP-F和NAC030GFP-R扩增后的条带;B.PsnNAC030-GFP融合表达载体的检测。

A、D为暗场观察;B、E为明场观察;C、F为明暗场综合图;比例尺=20 μm。
2.3 杨树PsnNAC030蛋白具有转录激活活性
为了验证小黑杨PsnNAC030蛋白是否具有自激活活性,将PsnNAC030连接到pGBKT7载体的GAL4 DNA结合域,并转化酵母菌株Y2Hgold。如图6所示,所有转化子均能在SD/-Trp缺陷培养基上生长,但在SD/-Trp/-His二缺培养基上只有阳性对照与pGBKT7-NAC030能正常生长且在SD/-Trp/-His/X-a-Gal培养基上变蓝,结果表明小黑杨PsnNAC030蛋白具有自激活活性。

图6 小黑杨PsnNAC030蛋白的自激活验证
2.4 杨树转录因子PsnNAC030基因的时空表达
利用qRT-PCR对杨树转录因子PsnNAC030基因在150 mmol/L NaCl、干旱、37 ℃、4 ℃、50 μmol/L ABA胁迫条件下时空表达模式进行分析。以胁迫处理0 h时该基因表达量为基准,来分析不同胁迫下不同组织和不同时间点该基因的相对表达量。
结果表明,经150 mmol/L NaCl溶液处理后PsnNAC030基因在叶茎根各组织中的相对表达量均呈现出上调趋势,且在胁迫处理24 h后达到最大,表达量分别为8.701、7.436、5.557倍,之后其相对表达量水平有所下降;与茎根相比,该基因在叶中上调表达最为显著,其次是茎、根(表1)。

表1 盐胁迫下小黑杨PsnNAC030基因的相对表达量
经干旱处理后PsnNAC030基因在叶和根中的相对表达量均呈先上调后下调的趋势,且在胁迫处理12、24 h后达到最大,其相对表达量分别为31.643、23.657倍;在茎中呈先下调后上调再下调的趋势,且在胁迫3 h时出现第一个峰值,为42.986倍,胁迫12 h达到另一个峰值,为17.802倍;该基因在茎中表达量与根和叶中相比较显著,其次是叶、根(表2)。
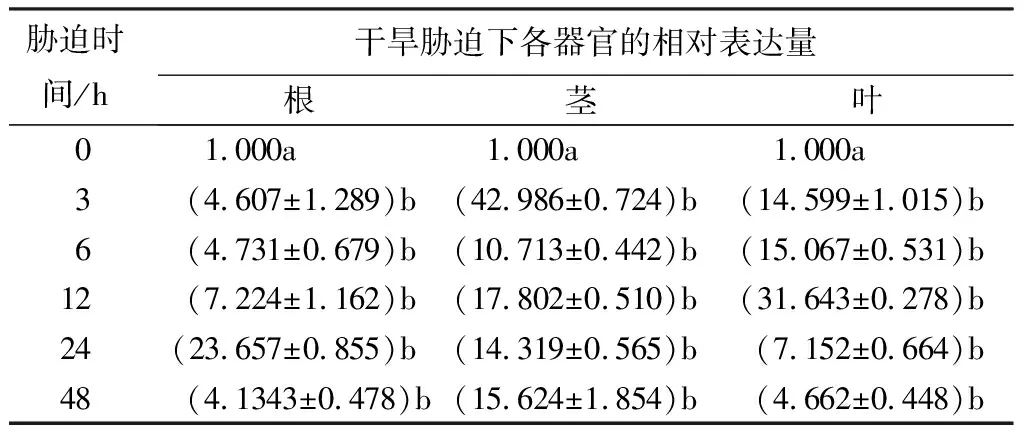
表2 干旱胁迫下小黑杨PsnNAC030基因的相对表达量
经37 ℃高温处理后PsnNAC030基因在叶中呈上调表达趋势,在胁迫12 h达到最大,其表达量为4.792倍;在茎中胁迫处理时间对该基因表达影响不显著;在根中呈下调表达趋势,且在胁迫3 h达到最大值,表达量为7.214倍,在胁迫12 h达到最低值,表达量仅为0.713倍;与茎根相比,该基因在叶中表达最显著(表3)。
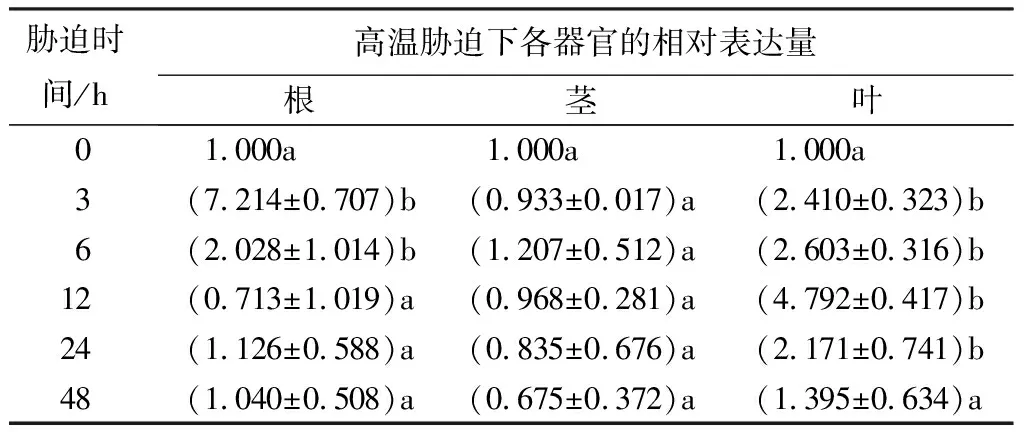
表3 高温胁迫下小黑杨PsnNAC030基因的相对表达量
经4 ℃低温处理后PsnNAC030基因在叶、茎、根中均呈上调表达趋势;该基因主要在茎中表达,且在胁迫12 h时达到最大,高达245.687倍;其次是在根中表达,在胁迫6 h达到最大,表达量为84.276倍,最后是在叶中表达,在胁迫12 h达到最大,表达量为2.948倍,之后其表达水平均有所下降(表4)。

表4 低温胁迫下小黑杨PsnNAC030基因的相对表达量
经50 μmol/L ABA溶液处理后PsnNAC030基因在叶和茎中呈上调表达趋势,均在处理6 h时出现最大值,表达量分别为5.822、1.846倍;在根中呈先下调后上调趋势,在处理3 h时出现最大值,表达量为6.424倍;与该基因在茎和根中的表达量相比,在叶片中的诱导表达较为显著(表5)。
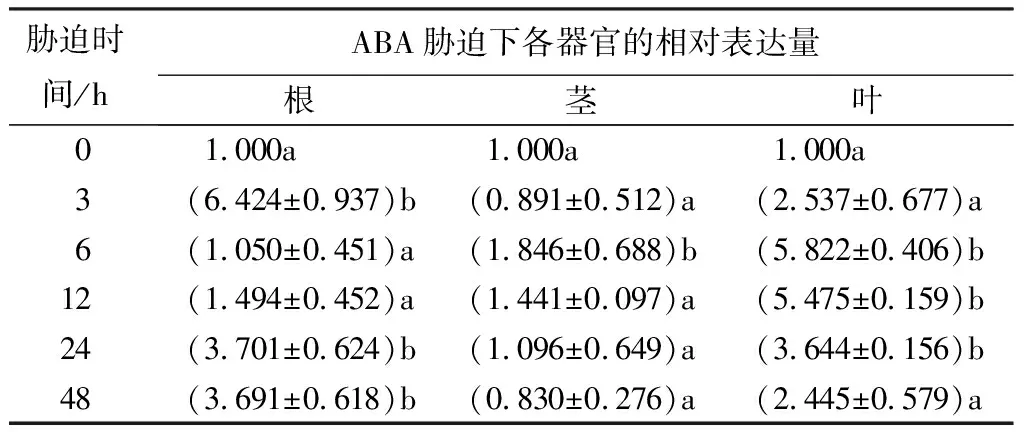
表5 ABA胁迫下小黑杨PsnNAC030基因的相对表达量
以上结果表明PsnNAC030基因对高盐、干旱、高温(37 ℃)、低温(4 ℃)、ABA胁迫具有显著的应答反应;该基因相对的表达水平具有组织特异性,表现为150 mmol/L NaCl、高温(37 ℃)、50 μmol/L ABA胁迫下在叶中表达量最高,干旱、低温(4 ℃)胁迫下在茎中表达量最高。
3 结论与讨论
NAC转录因子是植物最大的转录因子基因家族之一,广泛存在于各种各样的陆生植物中,包括NAM、ATAF和CUC 3个亚家族[34]。该家族基因含有高度保守的DNA结合结构域、核定位信号位点和高度分散的C末端结构域[35-36]。小黑杨PsnNAC030基因编码区876 bp,属于NAC转录因子基因家族,编码291个氨基酸,N端具有高度保守的NAM结构域。
迄今为止在多种植物中已克隆并鉴定出上百种NAC家族基因,其中大多数NAC基因定位于细胞核,如毛果杨PtATAF1-1基因[37]、蒙古沙冬青(Ammopiptanthusmongolicus)AmNAC2基因[38]、水稻OsNAC300基因等[39]。研究发现PsnNAC030蛋白表现为不稳定的亲水性蛋白,通过基因枪瞬时转化试验表明该蛋白定位于细胞核内,与大多数NAC基因定位结果一致。此外,大多数NAC基因可以编码翻译出具有转录激活活性的蛋白质,是因为大多数NAC转录因子具有N端含有保守结构域、C末端含有转录激活结构域以及存在苏氨酸、谷氨酸、丝氨酸、脯氨酸和多种酸性残基多次重复出现现象等特征,使其在植物激活方面具有重大功能[40-41]。例如:PsnNAC030基因在拟南芥中的同源基因ATAF1[42-43]、水稻OsNAC5和SNAC1/OsNAC9基因等[44-45]。PsnNAC030基因N端具有高度保守结构域且拥有转录激活结构域,同时结合亚细胞定位结果,可以说明PsnNAC030蛋白具有激活下游基因转录的功能,并可能参与到相应的转录调控过程中。
植物NAC转录因子参与多种非生物胁迫反应。例如:柑橘(Citrusreticulata)NAC83基因在高盐、干旱、低温和ABA胁迫条件下均有差异性表达[46];海榄雌(Avicenniamarina)AmNAC1基因在盐、干旱、低温和水杨酸处理的反应中存在不同的响应,在烟草(Nicotianatabacum)中过量表达该基因提高了其对盐、干旱的耐受性,且在酵母中异源表达该基因提高了其在盐碱、高低温环境中的存活率[47];过量表达杨树PtrNAC006、PtrNAC007和PtrNAC120基因均表现出抗干旱能力,且在转基因株系的木质部中具有较高的水势进而增加杨树在干旱条件下的存活率[48];此外,在我们之前的研究中发现过量表达杨树NAC13基因后,盐胁迫条件下转基因株系的株高、根长和鲜重等形态指标以及SOD、POD、脯氨酸含量等生理指标均显著提高,而反义表达NAC13基因后则呈现出相反的结果[49]。研究表明PsnNAC030基因与拟南芥中ATAF1同源性最高,ATAF1基因在拟南芥中的过表达导致植物对盐、ABA、干旱等多种非生物胁迫的敏感性增强,对提高植物的抗逆性具有重要作用[42-50]。本研究中小黑杨PsnNAC030可被高盐、干旱、高低温和ABA胁迫显著诱导表达,且呈现出诱导初期表达骤升、随后下降或相对稳定的趋势,表明该基因可能参与对环境骤变瞬间响应或长期适应的过程。
综上所述,可以推断出PsnNAC030基因可能在植物应对多种非生物胁迫时具有重要的潜在功能,也为研究该基因的抗性机制与功能提供了理论依据。此外,研究过表达该基因的转基因植物,将对PsnNAC030基因是否在多重非生物胁迫耐受中具有调控作用以及怎样调控有更加深入的认识,同时也为培育出能够在逆境(盐碱地、荒漠等)环境下生存的优良树种做出贡献。
