hBD-3 和NF-κB p65 在口腔潜在恶性病变和口腔鳞状细胞癌中的表达及意义
2021-07-29杜永秀杨晨希
杜永秀 杨 琴 杨晨希 徐 普
中南大学湘雅医学院附属海口医院口腔医学中心黏膜病科,海南海口 570208
口腔癌中约90%为口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC),其发病率呈逐年上升的趋势[1-2]。据报道,OSCC 的5 年生存率不足50%,早期诊断和治疗OSCC 可显著提高其5 年生存率[3-4]。世界卫生组织倾向于把可能引起OSCC 的疾病称为口腔潜在恶性病变(oral potential malignant disorder,OPMD),常包括口腔扁平苔藓、口腔白斑、口腔黏膜下纤维化等[5]。
β-防御素-3(human β-defensin-3,hBD-3)是人天然免疫系统的重要组成部分,主要表达于上皮组织中,在炎症性疾病、损伤修复以及肿瘤形成和转移中均发挥重要的作用[6-8]。核因子-κB(nuclear factor kappa B,NF-κB)是参与细胞增殖、分化、凋亡的重要核转录因子,与炎症性肿瘤的发生密切相关[9-10]。近期研究发现hBD-3 能通过激活NF-κB 信号通路促进宫颈癌细胞生长[11],但hBD-3 能否通过调节NF-κB 介导的炎症反应参与OSCC 的进展尚缺乏研究。本研究将通过检测正常口腔黏膜、OPMD、OSCC 组织中hBD-3 和NFκB p65 表达情况,探究hBD-3 和NF-κB p65 在口腔黏膜癌变过程中的表达规律及其相关性,为OSCC早期诊断和治疗提供参考依据。
1 材料与方法
1.1 材料
选取中南大学湘雅医学院附属海口医院(以下简称“我院”)病理科2015 年1 月—2018 年12 月存档的蜡块中病理确诊的OSCC 患者40 例,OPMD 患者60 例。其中60 例OPMD 组中包括口腔白斑20 例、口腔扁平苔藓20 例、口腔黏膜下纤维化20 例。对照组选取15 例正常口腔黏膜,取自我院口腔外科拔除阻生牙及外伤的患者。收集上述患者的年龄、性别、吸烟饮酒史、病变部位、上皮异常增生等临床资料。所有病例术前未经过任何治疗,OPMD 组中未伴发其他系统性疾病及黏膜疾病。
1.2 试剂及方法
兔抗人hBD-3 多克隆抗体(美国NOVUS 公司,货号:NB200-117);兔抗人NF-κB p65 多克隆抗体(北京中杉金桥生物技术有限公司,货号:TA890002);即用型快捷免疫组化MaxVisionTM试剂盒(福州迈新生物技术有限公司,货号:KIT-5920);DAB 显色剂(福州迈新生物技术有限公司,货号:DAB-0031)。
所有标本作4 μm 厚的连续切片,其中1 张作常规HE 染色,复片确诊。免疫组化染色步骤按MaxVisionTM试剂盒说明书进行。抗原修复采用高压热修复。hBD-3 抗体工作浓度为1∶400,NF-κB p65 抗体工作浓度1∶600。用PBS 代替一 抗作空白对照。
1.3 结果判断
免疫组化以胞浆和胞核出现棕黄色染色颗粒为阳性细胞,分别由2 位病理科医师在高倍镜(400×)下观察5个不同视野(不少于200个细胞),按照参考文献[6]进行评分。①阳性细胞比例打分:<5%记为0 分,5%~<25%记为1 分,25%~<50%记为2 分,50%~<75%记为3 分,75%~100%记为4 分;②染色强度评分:无(-),弱(+),中等(++),强(+++),分别记为0~3 分。标本免疫组化评分为上述2 项得分之和,得分0~1 分记为阴性(-),2~3 分为弱阳性(+),4~5 分为阳性(++),6~7 分为强阳性(+++)。
1.4 统计学方法
采用SPSS 17.0 软件进行分析。等级资料先采用Kruskal-Wallis H 秩和检验进行整体比较,然后采用Man-Whitney U 秩和检验进行两两比较;相关性分析采用Spearman 等级相关;计数资料以例数表示,采用χ2检验及Fisher 精确概率法。以P <0.05 为差异有统计学意义。
2 结果
2.1 hBD-3 在OPMD 和OSCC 中的表达
hBD-3 阳性染色定位于细胞质和细胞核内,呈黄色或者棕黄色的颗粒,见图1。OSCC 中hBD-3 的表达强度明显高于正常组及OPMD 组(P <0.05),OPMD组显著高于正常组(P <0.05),见表1。

图1 各组中hBD-3 蛋白的表达(免疫组化染色,400×)

表1 各组hBD-3 表达强度的比较(例)
2.2 各组NF-κB p65 表达水平比较
NF-κB p65 阳性染色主要定位于细胞质内,呈黄色或者棕黄色的颗粒,见图2。OSCC 中NF-κB p65 的表达强度明显高于正常组及OPMD 组(P <0.05),OPMD 组显著高于正常组(P <0.05),见表2。

表2 各组NF-kB p65 表达水平比较(例)

图2 各组NF-κB p65 蛋白的表达(免疫组化染色,400×)
2.3 hBD-3、NF-κB p65 表达与临床病理因素的关系
hBD-3、NF-κB p65 蛋白表达与患者的年龄、性别、吸烟饮酒史、病变部位均不相关(P >0.05),但与OPMD 上皮异常增生相关(P <0.05)。见表3。
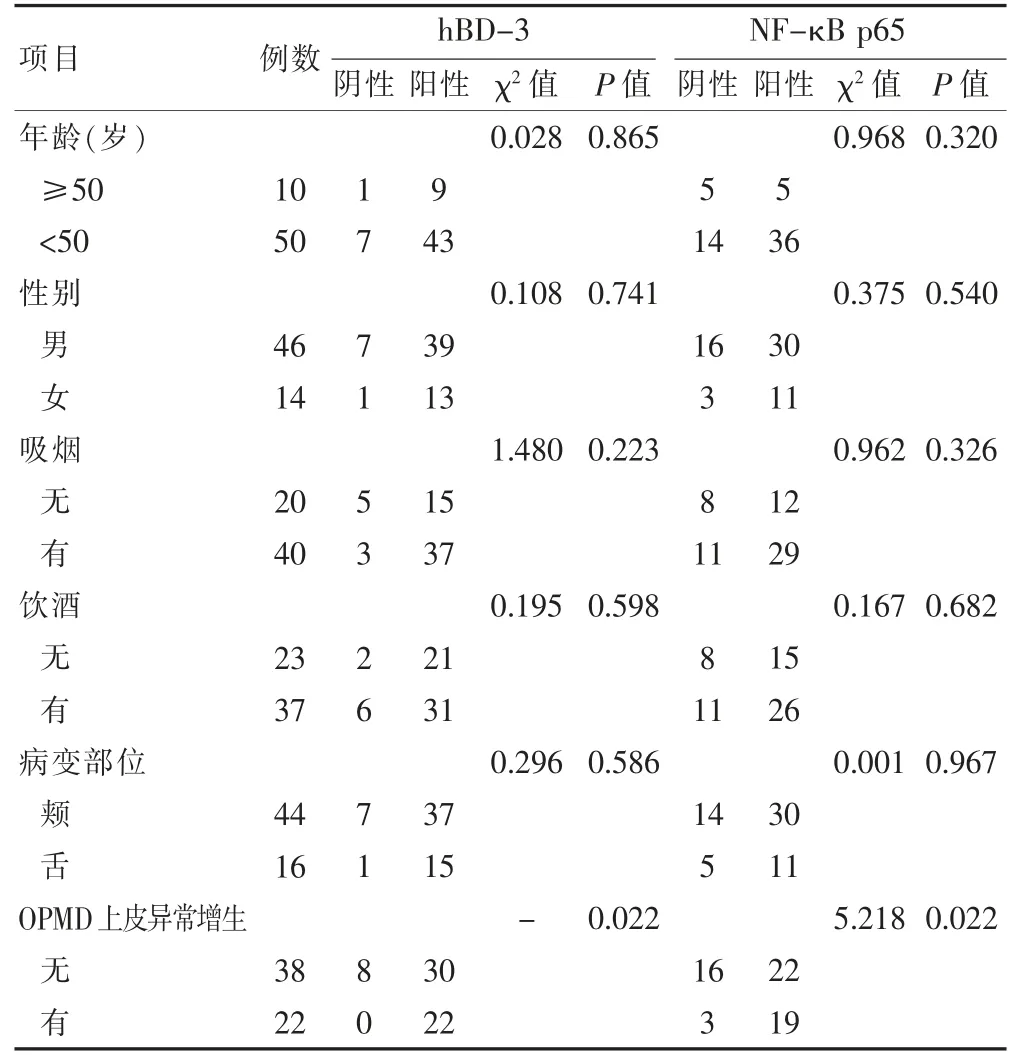
表3 hBD-3、NF-κB p65 表达与OPMD 临床病理因素的关系(例)
2.4 hBD-3 与NF-κB p65 表达的关系
结果显示,hBD-3 与NF-κB p65 表达量呈正相关(r=0.355,P <0.001)。

表4 hBD-3 与NF-κB p65 表达之间的关系(例)
3 讨论
OSCC 是头颈部较常见的恶性肿瘤,预后较差,早发现、早诊断、早治疗可以显著提高其生存率。OPMD在组织学上多表现为上皮单纯增生或异常增生,癌变率为5%~18%,上皮异常增生是OPMD 发展为OSCC 的高危因素[13]。因此,寻找能够指示OPMD 癌变的早期分子标志物,将对降低OPMD 癌变率、提高OSCC的生存率具有重要意义。
hBD-3 定位于人染色体8p22~23 区域内,相对分子质量约为5 kD,具有较强的抗菌和免疫调节功能[14]。研究发现,hBD-3 在多种肿瘤组织中存在异常表达,过表达的hBD-3 能够影响肿瘤细胞的增殖、凋亡、侵袭迁移等生理过程从而参与肿瘤发生发展[15],其致癌机制尚不明确。目前有关hBD-3 在口腔黏膜癌变过程中的研究鲜见报道。本研究显示正常口腔黏膜、OPMD、OSCC 中hBD-3 蛋白表达逐渐增强,提示hBD-3 的量变与口腔黏膜癌变有一定的相关性。OPMD 中上皮异常增生比无上皮异常增生组织中hBD-3 表达水平明显升高,提示hBD-3 与口腔黏膜恶性转化潜能有关。体外实验显示,外源性hBD-3 能促进OSCC 细胞株增殖,数量增多[16]。Shuyi 等[17]发现在OSCC 细胞株中沉默hBD-3 基因能降低肿瘤细胞增殖和侵袭能力。有学者提出上皮基底层区过表达的hBD-3 能与趋化因子受体结合招募单核/巨噬细胞到病变部位,诱导促肿瘤因子和炎症因子的释放,构建肿瘤相关微环境从而促使肿瘤发生[18-19]。
NF-κB 是一种转录调控因子,共有5种,其中p65是NF-κB 家族中的典型代表,常与p50、抑制蛋白IκB结合成无活性复合体存在于胞浆中,在外界因素作用下NF-κB p65 被激活,与IκB 解离,易位入核,启动相关靶基因,构建肿瘤微环境,造成细胞的增殖、转移等[10]。本研究结果显示,在正常口腔黏膜、OPMD、OSCC 中NF-κB p65 表达强度呈递增趋势,正常口腔黏膜未见胞核表达,OPMD 及OSCC 中出现了少数胞核表达,提示NF-κB p65 在OPMD 及OSCC 组织中存在活化现象,这提示在正常口腔黏膜癌变过程中,可能随着NF-κB p65 的活化,促进细胞增殖和抑制凋亡基因的表达,引起细胞恶性转化,促进OSCC 发生[20-21]。NF-κB p65 的表达与OPMD 上皮异常增生有关,提示NF-κB p65 可能在口腔黏膜早期癌变阶段中起作用。
对于hBD-3 和NF-κB p65 在OPMD 癌变过程中的相互作用至今未见报道。本研究显示hBD-3 与NF-κB p65 呈正相关,提示hBD-3 可能与NF-κB p65 通过协同作用来促进OSCC 的发生。Qian 等[22]发现hBD-3 表达水平与NF-κB 信号通路有关。hBD-3能通过细胞内化作用,与膜内PI(4,5)P2 结合,激活PI3K/Akt 信号通路,从而增加NF-κB 的转录活性[23]。NF-κB 信号通路活化后可以激活大量炎症介质基因的表达,比如白细胞介素-1、肿瘤坏死因子-α等,而这些炎性细胞因子又能诱导hBD-3 表达[24]。体外细胞实验表明当沉默hBD-3 基因后,NF-κB/p65 促进肿瘤细胞生长的能力明显减弱[25]。目前,关于hBD-3 通过调控NF-κB 来影响肿瘤发生发展的机制仍较少,本研究结果为将来探讨这一机制在肿瘤中的作用提供了一定的理论基础。
综合上述研究成果,hBD-3 与NF-κB p65 的高表达可能参与了正常口腔黏膜向OPMD 及OSCC 的发生、发展,联合检测hBD-3 与NF-κB p65 的表达,不但有助于了解OSCC 的发生发展,而且为OPMD 癌变的早期检测、治疗选择、预后判断提供新方向。
