基于红藻多糖的生物转化研究进展
2021-07-29谭黄虹孙慧敏郑兆娟欧阳嘉
周 凤,谭黄虹,孙慧敏,郑兆娟,欧阳嘉
(南京林业大学化学工程学院,江苏 南京 210037)
生物质是指通过光合作用而产生的各种有机体,广泛分布于陆地和海洋。其中,以木质纤维素为代表的陆生生物质是研究最多的生物质资源。但木质纤维生物质结构致密、化学组成复杂多样[1],对环境中化学或生物降解都具有较强的抵抗能力,导致对其所含的碳水化合物进行转化利用较为困难。与陆生木质纤维生物质相比,以藻类为代表的海洋生物质具有以下4 个方面的优点:1)碳水化合物含量高,木质素含量非常低,易于解聚;2)结构简单,半乳聚糖是其碳水化合物主要组成成分,易于提取;3)对生长环境要求简单,不占用耕地,节约淡水资源,不需要农药和化肥;4)光合作用效率高,生长周期短,海藻对CO2的固定能力高于陆地植物,可以更有效地减少温室气体;因此,藻类也被称为第3代生物质[2]。由于藻类生物质的上述优点,以藻类生物质为原料制备食品添加剂、燃料乙醇、大宗化学品具有显著优势。
红藻是一种常见的大型海藻,根据其所含碳水化合物组成的差异,可以将其分为琼胶类和卡拉胶类[3]。红藻多糖的含量因生长和环境条件而异,至少占其干质量的40%~50%[4]。通过酶法或化学法选择性水解红藻多糖可以制备具有多种生物功能的高价值低聚糖,其中以酶法制备的琼胶寡糖在保健品、食品和饲料添加剂、医药等领域都具有良好的应用前景。而红藻多糖多糖的完全水解则可以得到以D-半乳糖为主的混合糖溶液,不仅能用于制备生物乙醇、有机酸等发酵产品,也可用于制备具有益生元作用的稀有单糖,例如D-塔格糖等[5]。
本文围绕红藻生物质,在介绍其分布和组成基础上,重点围绕其生物转化方法和产品进行了综述,尤其是酶法制备琼胶寡糖和3,6-内醚-L-半乳糖以及微生物发酵生产化学品方面的研究进展。
1 红藻的分布和组成
1.1 分布
大型海藻是海洋中光合自养的低等植物,是海洋生态系统的重要组成部分,主要包括红藻(Rhodophyta)、褐藻(Phaeophyta)、绿藻(Chlorophyta)3 种门类。海藻的分布与海水温度、光在海水中的穿透性及海藻所含色素的比例有关。红藻在我国黄海、东海和南海均广泛分布,它们绝大部分生活在近海岸的潮下带和潮间带区域[6]。由于红藻具有藻红素和藻蓝素,其呈现特有的红色或粉红色,且可以吸收叶绿素无法吸收的青绿光,相较于绿藻和褐藻,红藻可以在相对较深的海域生长[7]。红藻分两个纲,即红菜纲(Bangiophyceae)和真红藻纲(Florideophyceae),大约有558 个属、3 740 个种[8]。绝大多数红藻分布在海水中,淡水中仅分布10多个属、50多个种。石花菜属(Gelidium)和江蓠属(Gracilaria)是最主要的产琼胶红藻[6]。角叉菜属(Chondrus)、卡帕藻属(Kappaphycus)和麒麟菜属(Eucheuma)是最主要的产卡拉胶红藻[9]。由于红藻含有用途广泛、经济价值高的海藻多糖,我国沿岸各省份都已开展了红藻的规模化人工养殖[6]。
1.2 组成成分
红藻组成与陆生植物有很大不同。红藻中含量最丰富的成分是多糖,包括纤维素、琼胶和卡拉胶,另外还含有蛋白质、脂类和极微量的木质素[10]。表1列举了不同文献中石花菜(Gelidium amansii)的化学组成。可以看出,石花菜碳水化合物质量分数非常高,其中,纤维素(其组成单体是葡萄糖)是质量分数相对低的多糖,而组成单体包括半乳糖和3,6-内醚-L-半乳糖(3,6-anhydro-L-galactose,L-AHG)的琼胶质量分数明显高于纤维素。此外,石花菜中还有部分蛋白质、少量的脂类和灰分。

表1 石花菜化学组成Table 1 Chemical composition of Gelidium amansii
在琼胶类红藻中,琼胶是含量最高的碳水化合物。琼胶也称为琼脂,是江蓠属和石花菜属红藻细胞壁的主要成分,主要由琼脂糖和琼脂胶组成[15]。其中,琼脂糖是由D-半乳糖和L-AHG通过α-1,3-和β-1,4-糖苷键交替连接组成的线形链状多糖分子(图1A)[16];琼脂胶主链结构与琼脂糖类似,其分子质量小于琼脂糖,C2、C4或C6位置含有大量的酸性修饰基团,如硫酸、丙酮酸、糖醛酸等,也存在甲基化修饰,其结构较为复杂,在各文献报道中不太统一[17]。琼胶的凝胶化作用主要是因为琼脂糖的存在,琼脂胶的凝胶形成能力很差,较高的L-AHG含量和较低的硫酸基含量有助于得到良好的凝胶品质[16]。琼脂糖和琼脂胶的比例因种属来源和收获季节而不同。例如石花菜属和鸡毛菜属(Pterocladia)红藻的琼脂糖含量高于江蓠属,而江蓠属一般含有较高的硫酸酯,硫酸酯的存在会减弱凝胶强度,因此琼脂的凝胶能力及强弱取决于品种来源及其中硫酸酯含量等18]。
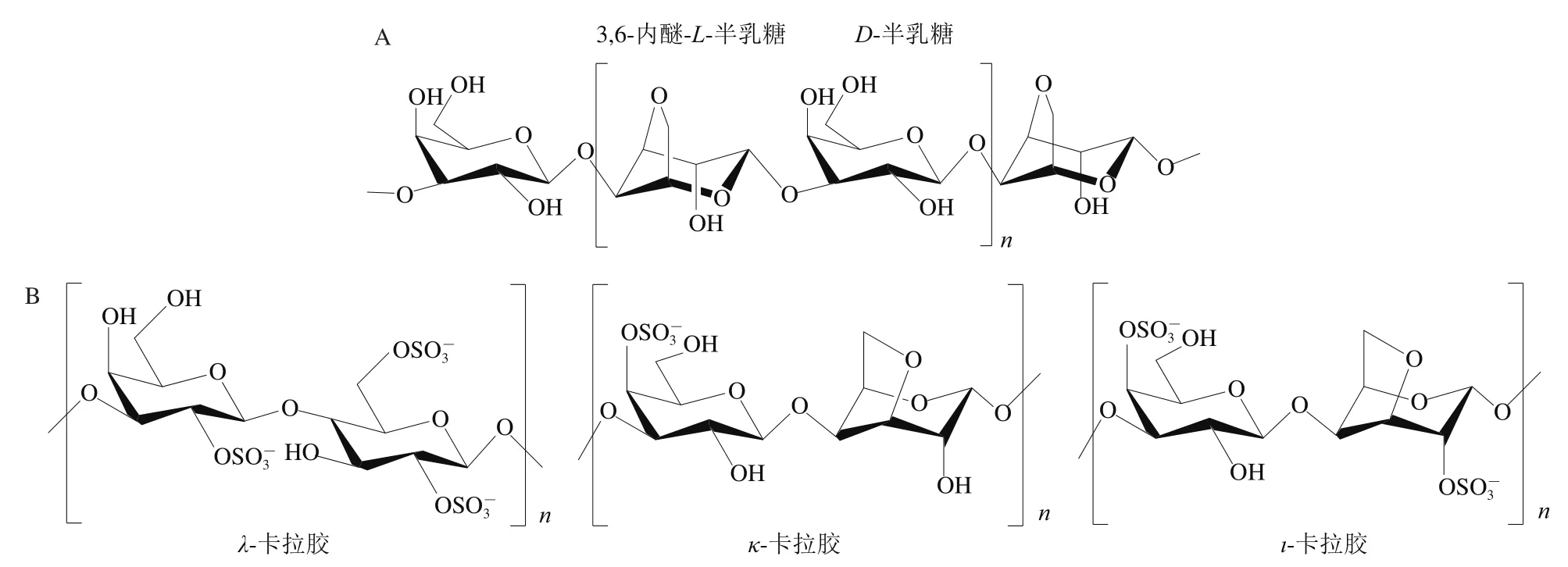
图1 琼脂糖(A)和3 种典型卡拉胶(B)的结构[16]Fig. 1 Structures of agarose (A) and three typical carrageenans (B)[16]
在卡拉胶类红藻中,卡拉胶是含量最高的碳水化合物。卡拉胶,又称角叉菜胶、鹿角菜胶,是角叉菜属和麒麟菜属红藻细胞壁的主要成分[19]。卡拉胶是由D-半乳糖和3,6-内醚-D-半乳糖通过α-1,3-和β-1,4-糖苷键交替连接组成的含有硫酸酯基团的线性高分子多糖,其硫酸酯质量分数约为15%~40%。根据其硫酸基的数量、连接位置和是否含有3,6-内醚键,卡拉胶可进一步分类为λ、κ和ι等类型[20](图1B)。硫酸酯基团和3,6-内醚键对卡拉胶的理化性能影响非常大,尤其是硫酸酯基团,卡拉胶的凝胶形成、凝胶性能、流变学性质及应用特性都与这两者相关[21]。硫酸酯基团以共价键与半乳吡喃糖基团上的C2、C4或C6相连接,导致卡拉胶带有较强的负电性,一般认为硫酸酯含量越高越难形成凝胶;3,6-内醚醚桥键即为硫酸酯基团脱除C6与C3位羟基形成的[21]。这3 种不同类型的卡拉胶中,κ型卡拉胶含有最低质量分数的硫酸酯(25%~30%)和最高质量分数的3,6-内醚-D-半乳糖(28%~35%),这使得其能够在钾离子环境中形成最大强度和硬度的凝胶。相反,λ型卡拉胶的硫酸酯质量分数很高(32%~39%),不含内醚键,使得其几乎没有凝胶形成能力,只起增稠作用[22]。
2 利用红藻多糖制备具有生理活性的琼胶寡糖和L-AHG
2.1 琼胶寡糖
从红藻中提取的琼胶黏度高、水溶性低、不易被吸收,因此在应用方面受到较大限制[23]。为了拓宽琼胶的应用范围,可利用化学法或酶法将其降解,得到不同聚合度的琼胶寡糖[24]。琼胶寡糖水溶性好、利于人体吸收、功能多样,是一种新型的海洋功能性低聚糖[23]。
琼胶寡糖又称琼胶低聚糖,是琼胶多糖经水解后聚合度为2~10的低聚糖。琼胶寡糖分为琼寡糖(agarooligosaccharides,AOSs)和新琼寡糖(neoagarooligosaccharides,NAOSs)两个系列[25],其中AOSs以L-AHG为还原端,D-半乳糖为非还原端,以琼二糖为重复单位,通过β-1,4-糖苷键连接而成;而NAOSs以D-半乳糖为还原端,L-AHG为非还原端,以新琼二糖为重复单位,通过α-1,3-糖苷键连接而成(图2)。这些琼胶寡糖不仅具有功能性低聚糖的一般特征,还具有许多普通寡糖无法替代的生理活性,是极具开发利用价值的功能性低聚糖。例如琼胶寡糖具有抗癌、抗氧化、保肝、抗肿瘤、抗炎症、增强免疫、预防糖尿病、美白保湿[26-27]和α-葡萄糖苷酶抑制活性[28-29]等,因此可以广泛应用于医药、保健、化妆、食品和饲料添加剂等领域。
传统的化学降解法制备琼胶寡糖存在反应条件难以控制、产物分析和纯化复杂、化学试剂回收困难、对环境污染大等问题。而酶法利用琼胶酶降解琼胶多糖制备各种琼胶寡糖,反应条件温和、催化效率高、无污染、底物专一性好,可以选择性地切断琼胶糖链上的糖苷键,具有更好的应用前景。
琼胶酶是可以将琼胶多糖降解为琼胶寡糖的一组糖苷水解酶[30],依据水解糖苷键位点的不同,琼胶酶分为α-琼胶酶(EC 3.2.1.158)和β-琼胶酶(EC 3.2.1.81)[31]。α-琼胶酶断裂α-1,3糖苷键产生以琼二糖为基本单位的AOSs;β-琼胶酶断裂β-1,4糖苷键产生以新琼二糖为基本单位的NAOSs[31]。α-琼胶酶水解琼胶的终产物为琼四糖;β-琼胶酶水解琼胶的终产物大多为新琼二糖[32-33]、新琼四糖[34]和新琼六糖等[35]。由于可利用的α-琼胶酶种类少,目前使用的琼胶酶多为β-琼胶酶。海洋细菌(如Pseudoalteromon asatlantica和Saccharophagus degradans2-40)的主要酶系是β-琼胶酶系,含有内切型β-琼胶酶和外切型β-琼胶酶,其酶切产物分别为NAOSs和新琼二糖[36-37]。琼脂糖水解具体过程如图2所示,α-琼胶酶或酸预处理可在L-AHG残基和D-半乳糖残基之间切割琼脂糖的α-1,3糖苷键,生成还原端带有L-AHG残基的AOSs,例如琼二糖、琼四糖和琼六糖。β-琼胶酶切割D-半乳糖残基和L-AHG残基之间的β-1,4糖苷键,从而产生在其还原端带有半乳糖残基的NAOSs,例如新琼二糖、新琼四糖和新琼六糖。

图2 生物法制备琼胶寡糖和L-AHG的反应途径[26]Fig. 2 Reaction path for the conversion of agarose into agarose-derived oligosaccharides and L-AHG[26]
除了筛选自然界中各种天然微生物生产琼胶酶外,研究者也利用基因工程手段将琼胶酶编码基因克隆至大肠杆菌等常见产酶菌株,用于异源生产各种水解活性不同的琼胶酶。例如于文功等[38-39]将来源于海洋细菌Pseudoalteromonassp. CY24的琼胶酶基因agaA和agaB分别在大肠杆菌中表达,其中,琼胶酶AgaA的水解产物主要为聚合度4或6的NAOSs,而琼胶酶AgaB则可将琼胶水解为37%的新琼八糖、32%的新琼十糖和17%的新琼十二糖;学者们从海洋细菌Agarivorans gilvusWH0801中克隆得到agWH50A[40]、agWH50B[41]、agWH50C[42]等数个编码琼胶酶的基因,将其分别在大肠杆菌中表达,这些琼胶酶能够降解琼胶获得新琼二糖、新琼四糖等不同聚合度的琼胶寡糖。
2.2 3,6-内醚-L-半乳糖
L-AHG具有消炎、美白、保湿以及预防和治疗色素沉着等性能,可应用于医疗、制药和食品行业。推测琼胶寡糖的多种生物活性主要是由于L-AHG的存在[43]。
酶法或化学法结合酶法都可用于L-AHG的制备。对于酶法而言,该过程涉及外切型β-琼胶酶I、外切型β-琼胶酶II以及新琼二糖水解酶(neoagarobiose hydrolase,NABH)(EC 3.2.1.159)等多种类型的水解酶类[44]。首先,经由外切型β-琼胶酶I断裂琼脂的β-1,4-糖苷键生成NAOSs,后者进一步被外切型β-琼胶酶II降解为新琼二糖[45],最后,NAOSs水解酶或NABH将新琼二糖水解成D-半乳糖和L-AHG[46-47]。
化学法结合酶法制备L-AHG时,主要分为两个阶段,先用稀酸或有机弱酸等化学试剂水解琼胶,琼胶的α-1,3-糖苷键更易断裂,得到AOSs,之后必须结合酶法制备L-AHG,因为L-AHG在酸性环境下极易被降解为5-羟甲基糠醛(5-(hydroxymethyl) furan-2-carbaldehyde,HMF)[48-49]。当外切型β-琼胶酶II作用于AOSs时,其能够特异性切割AOSs的β-1,4-糖苷键,最终生成琼三糖和新琼二糖[48]。新琼二糖可进一步被NABH水解成L-AHG和D-半乳糖[46-47]。
但是,上述过程中生成的琼三糖不能被常见的β-琼胶酶或NABH进一步水解。Lee等[48-49]发现了一种由海洋弧菌Vibriosp. EJY3产生的新型琼胶降解β-半乳糖苷酶(agarolyticβ-galactosidase,ABG),其可以将琼三糖水解为D-半乳糖和新琼二糖,然后利用NABH水解新琼二糖生成L-AHG和D-半乳糖(图2)。这种特殊的琼胶降解β-半乳糖苷酶不能水解乳糖等常见的β-半乳糖苷酶底物,只能水解释放AOSs非还原端的半乳糖残基,这与来源于大肠杆菌等微生物的常见β-半乳糖苷酶明显不同[48,50]。
3 红藻多糖制备乙醇和有机酸
红藻的多糖质量分数(最高可占其干质量的74%左右)高于褐藻和绿藻的多糖质量分数(最高分别占其干质量的70%和65%左右)[51],更适合应用于生物乙醇、有机酸和功能性食品制备等领域。而微生物发酵只能利用单糖,所以需要对红藻进行预处理和糖化。预处理可破坏红藻多糖结构,增加底物在水中的溶解度,增加酶对底物的可及性[52],之后通过糖化使红藻多糖(如琼胶寡糖)解聚,获得可发酵单糖。
3.1 红藻预处理和糖化
3.1.1 预处理
与木质纤维素相比,红藻中木质素的含量较低或几乎没有,使得预处理过程更简单、成本更低。目前,红藻最常用的预处理方法包括物理(例如研磨和微波预处理)、水热(例如热水萃取)和化学预处理(例如碱改性)。
3.1.1.1 物理预处理
物理预处理被认为是最有效的预处理方法,其通过破坏红藻细胞来增加酶的接触表面积,从而增加酶对底物的可及性。红藻预处理的物理方法可分为研磨预处理和微波预处理[53]。研磨预处理使得红藻细胞壁中的碳水化合物在水解过程中与化学催化剂及酶能够充分接触。微波作为替代加热源,已被广泛用于生物质原料的预处理过程中,包括木质纤维素、微藻和大型藻类[54]。微波预处理对红藻非常有效,因为红藻的含水量相对较高,这使得微波能量能够加热红藻中的水分[55],微波辐射产生的内部热量导致红藻细胞破裂,碳水化合物暴露于水相中。
3.1.1.2 水热预处理
热水萃取是最常用的水热预处理方法,其操作简单。由于在85 ℃以上的水中,琼胶和卡拉胶的溶解度增加,所以该方法可以用来提取红藻中的琼胶及卡拉胶[54]。Lemus等[56]为了从红藻中提取琼脂,将3 g干燥和研磨的样品浸泡在150 mL蒸馏水中,然后在121 ℃下高压灭菌3 h。提取琼脂后,提取的混合物用粗棉布过滤,除去主要由纤维素组成的不溶性纤维。毛细管藻(P. capillacea)、花毛藻(G. floridanum)和锯齿藻(G. serrulatum)的琼脂产量分别占总干生物质量的32.1%、31.7%和33.0%。而卡拉胶提取方法比琼胶更复杂,因此,最佳提取方法因卡拉胶植物种类的不同而不同。通常情况下,卡拉胶通过热水萃取、过滤,然后用乙醇或氯化钾沉淀。
3.1.1.3 化学预处理
化学预处理(例如碱改性)可减少多糖中的带电基团,使得琼胶或卡拉胶凝胶强度增加,也可除去木质素等非多糖组分。用氢氧化钠、氢氧化钾等碱性试剂进行碱改性,并辅以水热预处理。用质量分数5%氢氧化钠溶液在85 ℃水中碱化2 h后,其凝胶强度比115 ℃水热提取2 h提高6 倍以上[57]。在70 ℃下,每克甘蔗用1 g亚氯酸钠和0.2 mL乙酸处理30 min后,木质素被氧化并溶解在溶液中,同时没有任何碳水化合物显著损失[58]。
3.1.2 糖化
在琼胶类红藻中,琼脂糖具有线性结构,目前大多数糖化方法都是针对琼脂糖开发的。而卡拉胶类红藻的主要多糖成分——卡拉胶具有复杂的多糖结构,并且作用于卡拉胶的酶种类有限,目前有κ-卡拉胶酶和ι-卡拉胶酶等,这些酶是内切型水解酶,作用于卡拉胶的β-1,4-糖苷键,产生新卡拉胶低聚糖和新卡拉二糖[10]。目前尚未发现能够裂解新卡拉二糖α-1,3-糖苷键的酶,所以无法使用卡拉胶生产单糖。
最常见的3 种琼脂糖糖化方法分别是酸水解、酶糖化以及先酸水解后酶糖化[5]。在高温下使用稀酸(如硫酸、乙酸)对红藻或琼脂糖进行酸水解是一种简单而廉价的糖化方法。然而,在这个过程中,单体己糖、D-半乳糖和L-AHG易于进一步降解为HMF,尤其是L-AHG,对酸非常敏感[59]。HMF是一种常见的微生物发酵抑制剂,能够严重影响下游微生物发酵过程。酸水解的缺陷在于,一方面酸会腐蚀设备,且需要在下游微生物加工之前进行中和[60];另一方面,在没有任何化学预处理的情况下,仅依靠酶糖化,所得单糖含量非常少,这主要是由于在水中作为反应底物的琼脂糖溶解度很低。为了克服单独使用酸或酶进行琼脂糖水解的缺陷,研究者开发了先酸水解后酶糖化的组合水解方法。在该过程中,先通过弱酸(如醋酸)使琼脂糖的α-1,3-糖苷键被酸催化断裂,形成AOSs;之后通过联合使用β-琼胶酶II和NABH催化生成L-AHG和D-半乳糖[49,59]。
3.2 乙醇生产
红藻的高碳水化合物含量使其具有制备生物乙醇的巨大潜力。Kim等[61]以琼脂糖为底物,研究了其水解产物发酵产生物乙醇的可行性。首先通过乙酸液化琼脂糖,得到聚合度大于12的琼胶低聚糖,之后在3 种β-琼胶酶(Aga16B、Aga50D、DagA)和NABH的催化下糖化,得到D-半乳糖用于乙醇发酵。30 g/L琼脂糖经稀酸液化和同步糖化发酵后,可产出质量浓度为4.4 g/L的乙醇。Park等[10]以石花菜为底物,经稀硫酸水解得到D-半乳糖用于乙醇发酵,其着重考察了分批水解和连续水解过程中抑制物(HMF、甲酸、乙酰丙酸)的产生规律及对后续乙醇发酵的影响,发现连续水解产生的发酵抑制物较少,更利于后续发酵,含质量浓度72.2 g/L可发酵糖(D-葡萄糖和D-半乳糖)的水解液最终可生产质量浓度为27.6 g/L的乙醇。
虽然与木质纤维素相比,红藻糖化相对简单,但红藻碳水化合物的乙醇产量和生产效率明显低于木质纤维素。这是因为红藻含有大量不可发酵糖[61-62]。在红藻水解产物中的3 种主要单糖(L-AHG、D-半乳糖和D-葡萄糖)中,D-葡萄糖最容易被微生物利用,D-葡萄糖快速消耗完全后D-半乳糖才开始被利用。尽管L-AHG是红藻水解液中含量极为丰富的单糖,但其不被任何工业微生物发酵,如常见的酿酒酵母、卡斯酒香酵母和产乙醇重组大肠杆菌等[10]。此外,红藻水解过程产生的发酵抑制物(HMF、甲酸、乙酰丙酸等)也会导致乙醇产率降低。
3.2.1 代谢工程提高生物乙醇产量
红藻水解液中D-半乳糖的含量远高于D-葡萄糖,虽然酿酒酵母等工业乙醇发酵菌株都能利用D-半乳糖,但D-半乳糖发酵的乙醇得率和产率都低于D-葡萄糖。D-半乳糖的有效利用对提高乙醇发酵得率和产率至关重要[63-65]。常见的乙醇发酵菌株细胞内的半乳糖代谢途径均为Leloir途径[63]。Bro等[63]通过代谢工程对酿酒酵母半乳糖代谢的基因调控网络进行改造,加快了半乳糖的消耗速率。Ostergaard等[65]通过消除半乳糖代谢系统的3 个已知负调控因子(GAL6、GAL80和MIG1),使半乳糖摄取速率提高了41%,乙醇得率提高了70%。过表达磷酸葡萄糖变位酶PGM2能显著提高Leloir途径代谢流,从而使得半乳糖吸收速率提高70%,乙醇得率也比未改造原始菌株提高61%[63]。此外,Lee等[66]利用反向代谢工程提高酿酒酵母的乙醇发酵能力,发现过表达磷酸甘露聚糖突变酶SEC53和转录抑制因子TUP1可以显著提高酿酒酵母的半乳糖代谢能力和乙醇产量。此外,过表达TUP1还显著缩短了碳源从D-葡萄糖转化为D-半乳糖后的发酵延滞时间。
红藻水解液中同时存在D-半乳糖和D-葡萄糖,可消除D-葡萄糖抑制作用,从而显著提高乙醇生产效率。Ha等[67]在酿酒酵母中引入纤维二糖利用途径,并通过表达纤维糊精转运蛋白使得半乳糖和纤维二糖同时进入酿酒酵母,然后纤维二糖被胞内β-葡萄糖苷酶水解为D-葡萄糖,从而避免了对D-半乳糖的代谢抑制。与单糖发酵或葡萄糖和半乳糖两段顺序发酵相比,纤维二糖和半乳糖共发酵的乙醇产率显著提高,此外,由于反应中不需要添加β-葡萄糖苷酶,从而降低了酶成本;不过,该实验仅利用上述方法考察了纤维二糖和D-半乳糖的共发酵情况,并未以红藻生物质为底物进行发酵。
3.2.2L-AHG生产的发酵途径改造
L-AHG是红藻水解后主要单糖组分,但能利用L-AHG的微生物极为少见。以红藻作为可再生生物质制备乙醇的关键问题之一就是将不可发酵糖L-AHG生物转化为常见的糖代谢中间体。研究人员发现海洋弧菌Vibriosp. EJY3能够以L-AHG作为唯一碳源生长代谢,通过对Vibriosp. EJY3的代谢物和转录组分析,首次发现了L-AHG的关键代谢中间体,即3,6-脱水半乳糖酸(3,6-anhydrogalactonate,AHGA)和2-酮基-3-脱氧-半乳糖酸(2-keto-3-deoxy-galactonate,KDGal)及其相应的酶,包括AHG脱氢酶和AHGA环异构酶[68-69]。L-AHG的分解代谢途径开始于AHG脱氢酶将L-AHG的醛基氧化为AHGA;然后,AHGA被AHGA环异构酶异构化,形成KDGal,后者是工业微生物中常见的代谢中间体,可以经半乳糖Deley-Doudoroff途径被进一步分解利用(图3)[68-69]。虽然L-AHG是一种在陆地植物中不存在的稀有糖,但它的分解代谢途径相对简单,通过L-AHG脱氢和AHGA环异构化两步酶反应即可汇入常规碳代谢途径。Yun等[69]将上述L-AHG代谢途径导入产乙醇的大肠杆菌KO11中,以富含D-半乳糖和L-AHG的琼脂糖水解液为底物进行发酵,乙醇产量比对照菌株提高了24%。

图3 D-半乳糖的代谢途径[70-72]Fig. 3 Metabolic pathway of D-galactose[70-72]
3.3 有机酸生产
红藻还可用于有机酸的制备,包括琥珀酸、柠檬酸等[73],但目前这方面的研究相对较少。琥珀酸可应用于制药、食品、化工等领域,是一种具有巨大应用潜力的平台化学品。Olajuyin等[74]对红藻Palmaria palmate进行预处理和酶解,得到质量浓度12.6 g/LD-葡萄糖和质量浓度18.0 g/LD-半乳糖的混合水解液,利用重组大肠杆菌KLPPP对其发酵可获得较高的琥珀酸质量浓度(22.4 g/L);值得一提的是,该菌株以D-半乳糖为底物发酵产琥珀酸的得率约是以葡萄糖为底物时的3 倍。柠檬酸也是一种重要的工业有机酸,在食品、制药和金属行业有广泛应用。Ramesh等[75]考察了以红藻Gelidiella acerosa作为碳源生产柠檬酸的可行性,发现利用黑曲霉以添加质量分数10%蔗糖的粗红藻粉(无需水解)生产柠檬酸时,在pH 3.0时发酵所得柠檬酸质量浓度为50 g/L。
4 结 语
长期以来,相较于陆生生物质,以红藻作为可再生生物质进行生物转化利用的研究相对较少。自从红藻中不可发酵糖L-AHG的分解代谢途径被阐明以后,以红藻作为再生生物质来源用于生物燃料或生物基产品的制备,其经济可行性大为提高。挖掘鉴定更多的L-AHG代谢基因/酶,并采用代谢工程的方法改造工业微生物,提升其代谢L-AHG的能力,有望为红藻的高效利用打开新的大门。此外,红藻制备的琼胶寡糖具有多种生物活性,在医药、保健、化妆、食品和饲料添加剂等领域具有较高的应用价值,但其活性机理尚不清楚,有待进一步研究。而关于卡拉胶类红藻生物质利用的报道目前较少,且现有报道表明,还不能从卡拉胶中生产单体糖,需探索更多卡拉胶水解酶,尤其是能够切割新卡拉二糖α-1,3-键连接的酶,以实现更多类型红藻的生物降解与利用。
