高温胁迫下坛紫菜中红藻糖苷及其异构体的含量变化
2019-01-09赵佳丽陈娟娟陈海敏
赵佳丽 杨 怡 赵 倩 钟 琪 陈娟娟 杨 锐 陈海敏
(1宁波大学海洋学院,浙江宁波 315211;2宁波大学食品与药学学院,浙江宁波 315832)
坛紫菜(Pyropia haitanensis)作为我国特有的紫菜种类,是我国浙江和福建地区主要的经济藻种,其味道鲜美、营养丰富,富含人体所需的蛋白质、矿物质及维生素,且低脂肪、低热量,是一种备受人们喜爱的天然海藻功能美食[1]。坛紫菜不仅具有很好的食用价值,还具有药用价值。研究表明,坛紫菜可治疗甲状腺肿、夜盲症等疾病[2],还具有增强免疫功能、防止衰老、降血脂等功效[3-6]。坛紫菜养殖在环境复杂多变的潮间带[7-8],常处于温度、渗透压及辐射的剧烈变化中,其中温度对坛紫菜的生长影响最大[9],其适宜生长温度为16~25℃,但近年来,随着全球气候变暖,每年9-10月的持续高温天气,使紫菜幼苗烂苗或成菜烂菜,导致坛紫菜大面积减产,对其经济发展造成巨大威胁[10]。因此,研究坛紫菜对高温胁迫的应答机制,以指导耐高温紫菜品种的培育,对坛紫菜养殖业的健康可持续发展具有重大意义。
高温胁迫是坛紫菜生长过程中常见逆境之一,坛紫菜会产生特定的应激反应,通过一些相关物质的代谢以应对该逆境。高温胁迫条件下,细胞膜发生损伤,透性发生改变[11],细胞内小分子外泄,导致细胞内渗透调节失衡。研究表明,紫菜中的光合同化产物红藻糖苷可作为渗透调节剂,参与细胞内渗透压的平衡[12-13]。红藻糖苷具有结构清晰、生理活性丰富的特点,且只有3种简单的异构体,即红藻糖苷、D-异红藻糖苷和L-异红藻糖苷[14],广泛分布于各种不同类型的红藻中。红藻糖苷不仅可以调节渗透压,还可作为碳库参与细胞壁的合成、脂类代谢,有着重要的生理作用[15]。据报道,藻类中红藻糖苷和异红藻糖苷的含量随着胁迫环境的不同呈不同的变化趋势,当海藻处于低潮带时,盐浓度增大,暗紫红毛菜(Bangiaatro purpurea)中红藻糖苷的含量随之升高,而异红藻糖苷几乎保持不变[16]。野外养殖的脐型紫菜(Porphyra perforata)从早上到中午红藻糖苷含量增加4倍,到下午和傍晚时又下降[17];从每年的二月到五月,红藻糖苷含量随之增加,但异红藻糖苷的含量变化并不明显[17]。由此说明,红藻糖苷和异红藻糖苷作为光合产物,其含量与光合作用有关的日长、温度变化相关,且在渗透压失衡情况下,也参与了渗透压的调节。目前,针对坛紫菜养殖业遇到的高温问题,红藻糖苷及其异构体具体的作用机制尚未被完全了解。因此,研究高温胁迫条件下坛紫菜中红藻糖苷及其异构体含量的变化,有助于深入了坛解紫菜对高温胁迫条件进行适应和应激的生理过程及机制。
本研究采取35℃作为热激条件,该温度作为急性应激条件,能在短时间内引起坛紫菜氧化代谢[18-20]。利用高效液相色谱-质谱联用(high performance liquid chromatography-mass spectrometry,HPLC-MS)技术,以坛紫菜ME-05为对象,研究35℃高温胁迫和20℃恢复培养条件下,不同生长阶段的坛紫菜中红藻糖苷和异红藻糖苷含量的变化趋势,旨在进一步了解潮间带海藻对高温胁迫的生理反应及化学分子调节机制,同时为提高坛紫菜品质和健康养殖提供理论依据。
1 材料与方法
1.1 材料与试剂
坛紫菜,ME-05品系,2017年采自中国浙江省与福建省的坛紫菜,阴凉处进行风干脱水并于 -80℃保存备用。样品采集信息见表1。
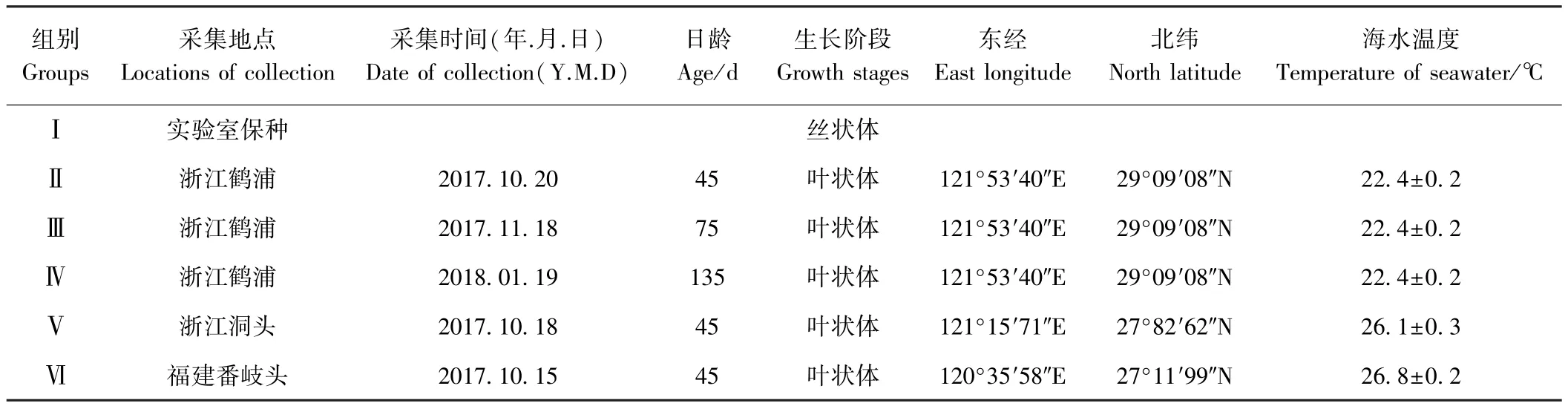
表1 坛紫菜样品采集信息Table1 The collection information of Pyropia haitanensis
甲醇(色谱纯)、乙腈(色谱纯)和醋酸铵(分析纯),美国Sigma-Aldrich公司;乙醇(分析纯)、碘化钾(分析纯),上海国药化工有限公司。
1.2 主要仪器与设备
TSQ Quantum Access液相色谱-三重四极杆质谱联用分析系统,美国 Thermo Fisher Scientific公司;Amide固相萃取小柱(3.0 mm×100 mm,3.5 μm),美国Waters公司;FreeZone冷冻干燥机,美国Labconco公司;CascadaⅡ.Ⅰ超纯水系统,美国 Pall公司;Precellys 24 Dual均质仪,法国Bertin公司。
1.3 试验方法
1.3.1 样品预处理 将整片坛紫菜放入灭菌海水中复苏24 h以上,挑选出健康叶片[21],复苏后坛紫菜叶状体的PSⅡ原初光能转化效率(Fv/Fm)见表2,可知冷冻复苏后的坛紫菜生理现象与新鲜坛紫菜藻体较为接近。仔细刷洗以去除附生杂物,置于含有0.7%KI的灭菌海水中消毒10 min,然后用灭菌海水轻轻洗涤3次。坛紫菜对照组培养条件:温度19±1℃,光照强度 20 μmol·m-2·s-1,光暗比 L ∶D=12 h ∶12 h。 热激处理组培养条件:温度35℃,热激时间30 min;不同恢复时间处理:热激后将坛紫菜取出,置于水温为19±1℃的培养箱内分别恢复1 h和3 h,其他条件与对照组相同。上述3个处理体系的坛紫菜,取出后加液氮于-80℃冰箱保存,冷冻干燥后用液氮研磨。

表2 坛紫菜叶状体中PSⅡ原初光能转化效率(Fv/Fm)Table2 Chlorophyll fluorescence quantum yields of photosystemⅡ(Fv/Fm)of Pyropia haitanensis
1.3.2 红藻糖苷的提取 准确称取100 mg坛紫菜干粉,置于2 mL匀浆管中,然后加入1 mL 70%乙醇,使用直径分别为0.5 mm和3 mm的破碎珠,于均质仪中提取(5 000 r·min-1,30 s×3,每次间隔 15 s,6 个循环)。在完全破碎后进行离心(5 000 r·min-1,10 min),取上清液。将上清液中溶剂蒸发,加入1 mL 50%乙腈,稀释50倍后,经0.22 μm滤膜过滤后用于高效液相色谱-质谱分析技术(HPLC-MS)检测分析。
1.3.3 高效液相色谱-质谱联用分析 色谱条件:色谱柱采用氨基柱(100 mm×3 mm,3.5 μm,美国Waters);流动相为 10 mmol·L-1乙酸铵溶液(A)-乙腈(C),采用等度洗脱法,流动相(A) ∶(C)=10 ∶90,保持30 min;流速 0.3 mL·min-1,柱温 25℃,进样量 10 μL。
质谱条件:采用电喷雾电离源负离子电离模式,喷雾电压2.5 kV,鞘气(N2)流量为 25 L·min-1,辅助气流量(N2)为5 Abs,喷雾室温度为350℃,离子传输毛细管温度为350℃,碰撞气采用氩气,碰撞气压力6×10-6mbar,Q1和Q3分辨率均设定为半峰宽0.7 Da。扫描采用选择反应监测(SRM)模式。红藻糖苷和异红藻糖苷相对应的离子通道和碰撞能量分别为m/z 253—m/z 119(20 eV) 和 m/z 253—m/z 89(21 eV)。
1.3.4 数据分析 所有的质谱数据操作、获取和分析都是由Xcalibur(Thermo Fisher Scientific)软件处理。差异性分析中,数据以平均值±标准差(mean±SD,n=3)表示。利用SPSS(版本11.5)软件进行单因素方差分析,组与组之间差异P<0.05时定义为差异显著,P<0.01时定义为差异极显著。
2 结果与分析
2.1 红藻糖苷定量方法的建立
将红藻糖苷和异红藻糖苷标准品进行HPLC-MS分析,获得准分子离子峰[M-H]-离子m/z 253,再将其进行二级质谱分析,获得二级质谱碎片离子。红藻糖苷与异红藻糖苷的一级和二级质谱图非常类似,因此选择红藻糖苷的质谱结构解析为例进行分析。二级质谱图中可见,母离子m/z 253分别丢失一分子甘油(92 Da)和一分子半乳糖(164 Da)获得碎片离子m/z 161 Da和89 Da。碎片离子m/z 89继续丢失30 Da,即丢失一分子CH2O,获得碎片离子m/z 59;碎片离子m/z 71则是通过碎片离子m/z 89丢失一分子H2O得到的。此外,母离子m/z 253的糖环被打开,丢失134 Da获得碎片离子m/z 119,而后继续丢失32 Da和18 Da,即丢失一分子CH2O和H2O得到糖环碎片离子m/z 87和101。考虑结构信息和离子丰度,m/z 119反映了半乳糖糖环信息,m/z 89反映了甘油信息,因此选择m/z 119和89作为选择反应离子监控模式下的定量离子。红藻糖苷的质谱裂解途径见图1。
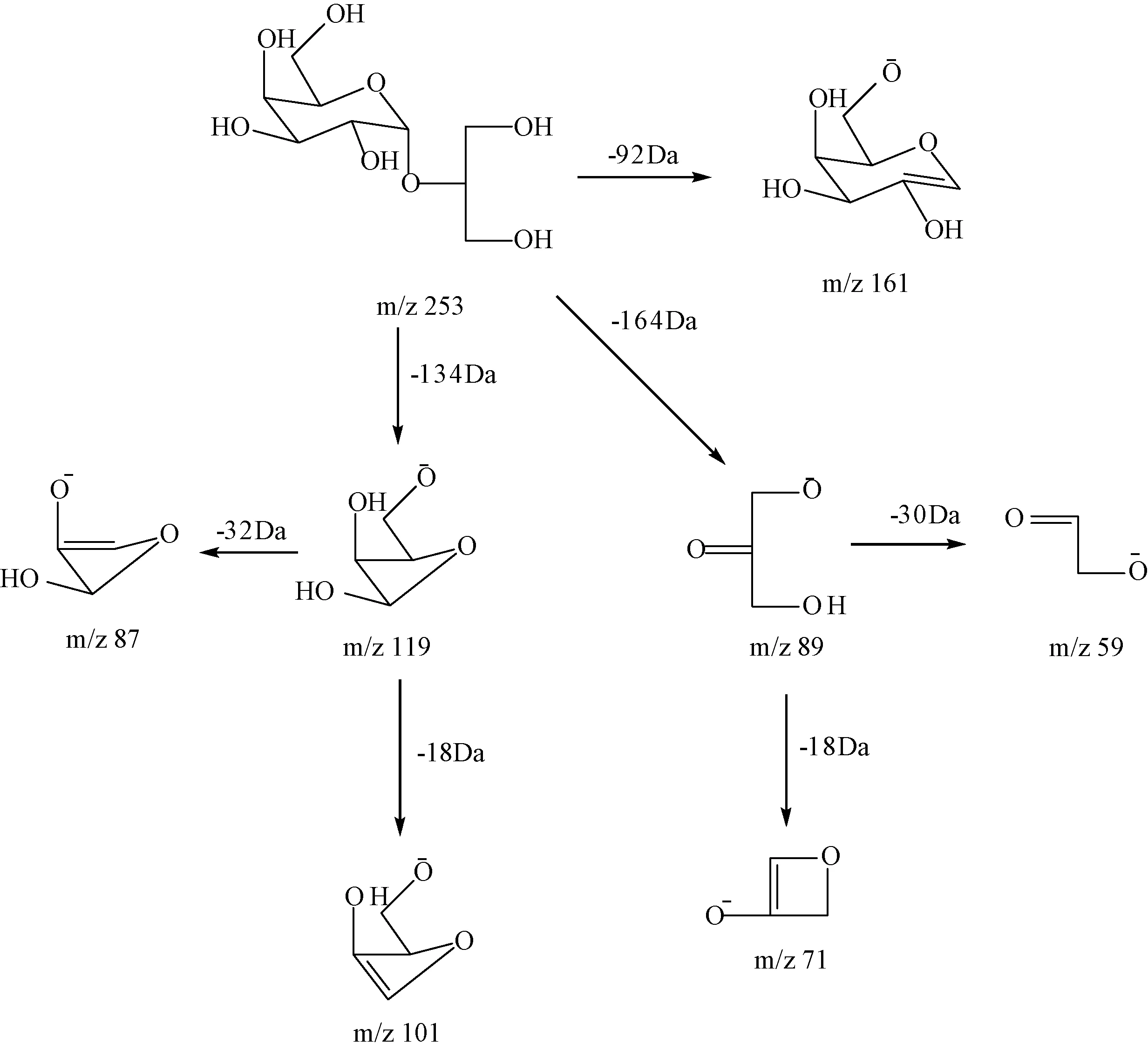
图1 红藻糖苷的结构式及主要碎片离子Fig.1 The structures and product ions of floridoside
结合已建立的液相色谱质谱联用定量方法[22],以选择反应离子模式(SRM)作为定量扫描模式,以m/z 253和m/z 119、m/z 253和m/z 89作为2条离子通道进行定量分析[22],经HPLC-MS扫描分析后,红藻糖苷和异红藻糖苷标准品的出峰时间分别为16.54 min和20.02 min(图2)。 配置 0.2、0.5、1.0、2.0、5.0、10.0、15.0 μg·mL-17种浓度的混合标准品溶液,结果表示,红藻糖苷和异红藻糖苷在该浓度范围内呈良好线性相关,线性回归方程为:红藻糖苷,y=1 079.6x+11 632,相关系数R2=0.999 5;异红藻糖苷,y=1 844.7x+19 991,相关系数R2=0.998 7。
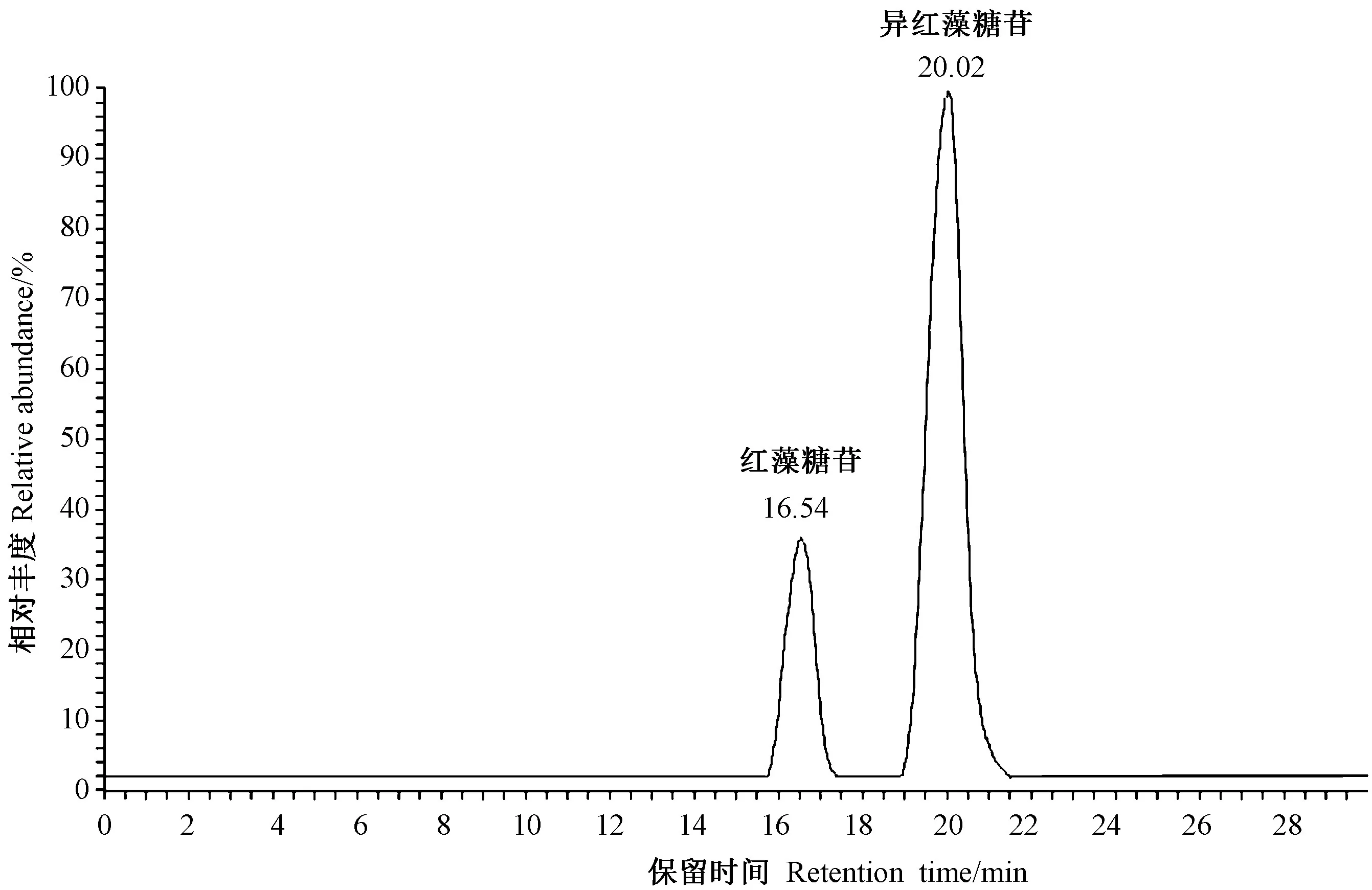
图2 红藻糖苷和异红藻糖苷的离子流图Fig.2 The ionization chromatograms of floridoside and isofloridoside
2.2 不同采集地点的坛紫菜中红藻糖苷和异红藻糖苷含量的分析
由图3可知,随着地理位置连续向南,日龄相近的鹤浦、洞头、番岐头坛紫菜中红藻糖苷含量分别为0.64、0.66、0.61 mg·g-1,无显著差异;异红藻糖苷含量分别为 7.31、6.56、6.14 mg·g-1,差异显著(P<0.05)。鹤浦、洞头、番岐头坛紫菜中异红藻糖苷含量明显高于红藻糖苷含量,其中,在鹤浦采集的坛紫菜中异红藻糖苷含量最高,其次是洞头,最后是番岐头。
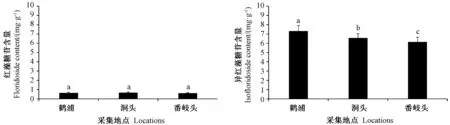
图3 不同采集地点的坛紫菜中红藻糖苷和异红藻糖苷的含量Fig.3 Contents of floridoside and isofloridoside of Pyropia haitanensis in different collection sites
2.3 不同生长阶段坛紫菜中红藻糖苷和异红藻糖苷含量的分析
由图4可知,随生长日龄的增长,坛紫菜中红藻糖苷含量从Ⅰ组到Ⅳ组依次降低,分别为1.12、0.64、0.31、0.21 mg·g-1,其中丝状体(Ⅰ)和幼嫩组(Ⅱ)中红藻糖苷含量极显著高于成熟组(Ⅲ)和完全成熟组(Ⅳ)(P<0.01)。坛紫菜中异红藻糖苷含量从Ⅰ组到Ⅳ组依次为 6.03、8.49、2.49、1.87 mg·g-1,与Ⅰ组相比,Ⅱ组异红藻糖苷含量极显著增加,但在Ⅲ组和Ⅳ组中异红藻糖苷含量减少,且极显著低于Ⅰ组、Ⅱ组(P<0.01)。综上,坛紫菜中红藻糖苷及其异构体含量会随其生理条件发生改变,以适应自然温度的变化。
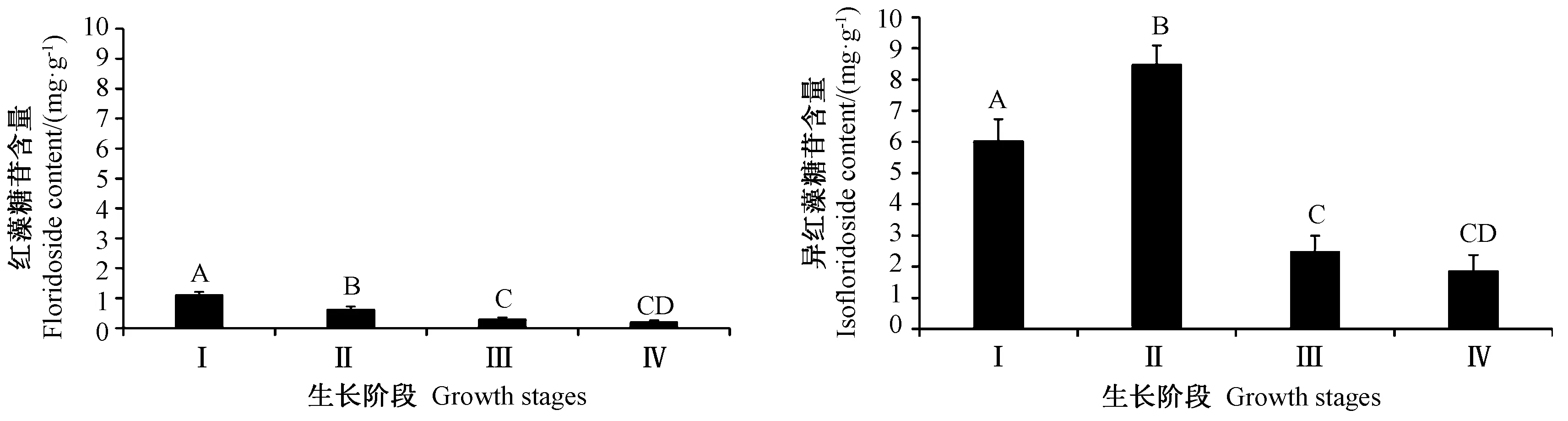
图4 不同生长阶段的坛紫菜中红藻糖苷和异红藻糖苷的含量Fig.4 Contents of floridoside and isofloridoside of Pyropia haitanensis in different growth stages
2.4 热激处理对坛紫菜红藻糖苷及异红藻糖苷含量的影响
坛紫菜Ⅱ组的红藻糖苷和异红藻糖苷总含量相对较高,故选择鹤浦产的坛紫菜Ⅱ组作为高温胁迫试验的材料。以35℃热激30 min作为高温组,高温胁迫后重新置于20℃恢复培养1 h和3 h作为恢复组,以19±1℃培养条件作为对照组,由图5可知,坛紫菜中红藻糖苷和异红藻糖苷含量对热激处理响应类似,在35℃热激30 min后,两者含量均出现降低现象,分别为对照组的0.83倍和0.92倍 (P<0.05)。经1 h恢复培养后,坛紫菜中红藻糖苷含量增加了约1.37倍,但异红藻糖苷含量无明显变化;经3 h恢复培养后,坛紫菜中红藻糖苷含量增加了1.92倍,极显著高于对照组(P<0.01),异红藻糖苷含量增加了0.04倍,显著高于对照组(P<0.05)。因此,选用3 h作为后续研究的关键时间点。
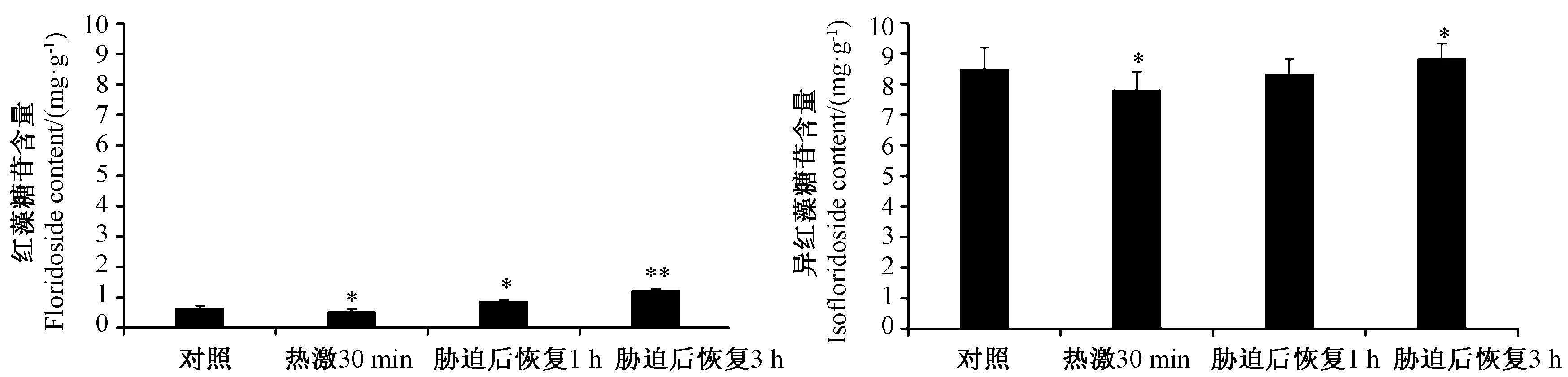
图5 热激应答对坛紫菜中红藻糖苷和异红藻糖苷含量的影响Fig.5 Effect of heat shock on the contents of floridoside and isofloridoside of Pyropia haitanensis
2.5 热激处理对不同生长阶段坛紫菜中红藻糖苷和异红藻糖苷含量的影响
将Ⅰ组至Ⅳ组坛紫菜样品在35℃下刺激30 min,然后20℃条件下再恢复培养3 h。由图6、图7可知,Ⅰ组至Ⅳ组坛紫菜经热激处理并恢复培养后,与对照组相比,其红藻糖苷含量分别增加了1.50倍、1.92倍、3.31倍、3.13倍(P<0.05),异红藻糖苷含量分别增加了0.97倍、1.07倍、1.60倍、1.37倍,其中Ⅰ组坛紫菜中异红藻糖苷含量略低于对照组,但差异不显著。综上,不同生长阶段的坛紫菜中红藻糖苷和异红藻糖苷含量在热激处理后的变化率趋势为:红藻糖苷,Ⅲ组>Ⅳ组>Ⅱ组>Ⅰ组;异红藻糖苷,Ⅲ组≈Ⅳ组>Ⅱ组>Ⅰ组。在不同生长阶段中,坛紫菜红藻糖苷含量的变化幅度均高于异红藻糖苷含量。表明在高温胁迫下,红藻糖苷作为主要渗透调节物,且其应答能力随藻体生理条件而变化。
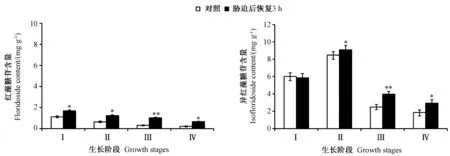
图6 热激处理对不同生长阶段坛紫菜中红藻糖苷和异红藻糖苷含量的影响Fig.6 Effect of heat shock on the contents of floridoside and isofloridoside of Pyropia haitanensis in different growth stages
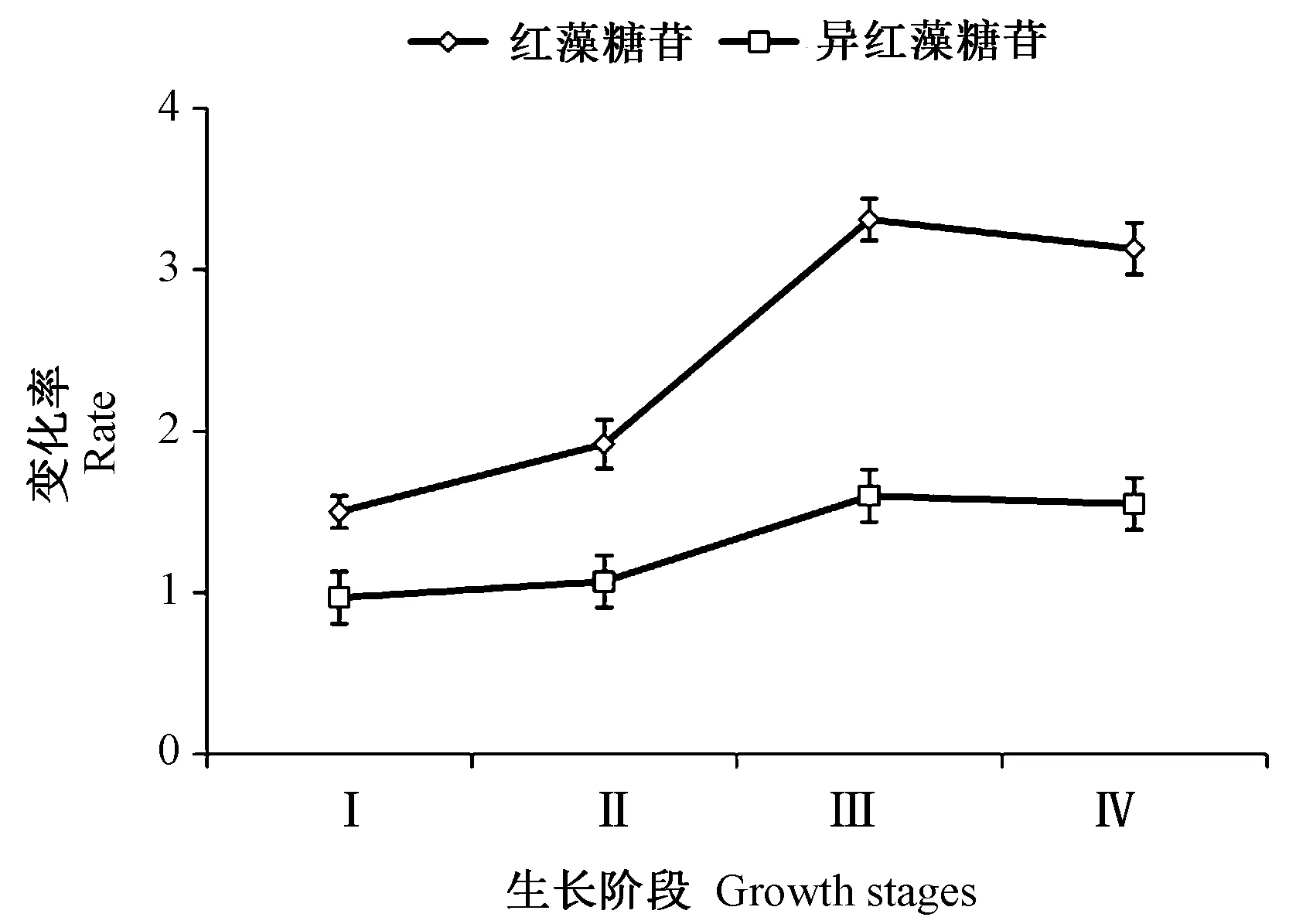
图7 热激处理对不同生长阶段坛紫菜中红藻糖苷和异红藻糖苷含量变化率的影响Fig.7 Effect of heat shock on the variation rates of floridoside and isofloridoside of Pyropia haitanensis in different growth stages
3 讨论
坛紫菜在遇到高温胁迫时,将迅速进行各种热激应答,红藻糖苷作为渗透压调节小分子、细胞壁合成前碳库,承担着重要的生理作用。环境因素如温度、昼夜长短、潮带水平等都会对坛紫菜中红藻糖苷和异红藻糖苷含量产生影响[23-26],但本试验中,随着地理位置不断南移,浙江鹤浦、浙江洞头、福建番岐头3个地点的日龄相近的养殖坛紫菜中红藻糖苷含量差异不显著,但异红藻糖苷含量存在明显差异,说明同种品系且成熟度相似的坛紫菜中红藻糖苷含量比较稳定,不会随着养殖地点的变化而出现较大的变化;而异红藻糖苷含量发生变化可能是因为地理位置从北至南,海水温度由22.4℃逐渐升高至26.8℃,略有增加,但仍处于坛紫菜耐受温度范围内,异红藻糖苷可能转化为其他代谢物以抵抗高温。
坛紫菜的4个不同生长阶段历经夏季至冬季,温度和光照等栽培环境在不停的变化。作为坛紫菜的二倍体生长阶段,丝状体(Ⅰ组)在一年之中温度最高的夏季生长,说明其能够在自然条件下耐受高温[23,27-29]。本试验结果表明,Ⅰ组中坛紫菜红藻糖苷含量为4个生长阶段中最高的,异红藻糖苷含量也处于较高水平。随着温度的升高和白昼的缩短,丝状体成熟且释放壳孢子(单倍体),在八月末和九月初形成叶状体[30]。从九月到次年一月,Ⅱ组至Ⅳ组的海水温度(Ⅱ组 22.4±0.2℃、Ⅲ组 18.3±0.3℃、Ⅳ组 11.8±0.2℃)逐渐降低,当低于栽培的最佳温度(20℃)时,坛紫菜中红藻糖苷和异红藻糖苷含量减少,这是因为在低温环境下坛紫菜的代谢速率和生长速度缓慢,说明坛紫菜中红藻糖苷含量会随其生理适应性发生改变,以适应自然温度的变化。结合2.2试验结果,红藻糖苷可以作为紫菜选育的指标物。
细胞膜是细胞与外部环境交换信息的屏障,也是细胞内分子反应的场所。在高温胁迫环境下,细胞膜最先被破坏,加速了整个细胞结构损伤和渗透压的变化[11]。因此,作为渗透调节物质,35℃高温下坛紫菜红藻糖苷和异红藻糖苷含量下降现象可以解释为:首先,当细胞内渗透平衡被破坏时,红藻糖苷和异红藻糖苷参与代谢调节,降解成其他代谢物以改变渗透压并保持细胞内环境平衡[11];其次,当坛紫菜细胞壁因高温而受损时,红藻糖苷和异红藻糖苷作为储存物质参与细胞壁的合成。这与文献报道一致,即通过使用14C标记的红藻糖苷进行脉冲追踪试验,发现红藻糖苷被作为合成细胞壁多糖的碳前体物[31-32]。当坛紫菜重新培养于合适的温度(20℃)下,生理反应逐渐恢复到正常状态,红藻糖苷和异红藻糖苷作为光合作用的主要产物[15,22]在藻类中积累,显著高于原始含量,并储存在藻类中以保护藻体应对胁迫环境。因此通过35℃高温胁迫和恢复培养试验可知,红藻糖苷和异红藻糖苷被作为前体物质来适应环境变化,两者变化趋势相似,但红藻糖苷的波动比异红藻糖苷更为强烈,说明红藻糖苷的代谢调控较异红藻糖苷更为敏感。
在早期培养阶段(丝状体组Ⅰ组和幼嫩组Ⅱ组),坛紫菜小而脆弱,具有缓慢的代谢过程和较弱的应激能力[33-36],本身便需要较高的贮存量以应对胁迫条件。因此,在受高温刺激并恢复培养后,Ⅰ组和Ⅱ组坛紫菜中红藻糖苷和异红藻糖苷含量的变化最轻微。Ⅲ组样品采集于坛紫菜栽培的第75天,这是坛紫菜的快速生长阶段,具有最高的光合速率,生长情况较好并具有抵御环境压力的最强能力[35-37],此阶段中红藻糖苷和异红藻糖苷可以快速合成以应对逆境[37-39],与本研究结果中Ⅲ组变异率最高的现象一致。Ⅳ组(生长期第135天)坛紫菜生长于冬天,该阶段坛紫菜已完全成熟,但在低温环境下(11.8±0.2℃)坛紫菜的代谢速率和生长速度缓慢,红藻糖苷和异红藻糖苷应答能力弱于Ⅲ组,不过因其藻体已成熟,生长情况优于幼嫩组,且低温环境下本身红藻糖苷及其异构体含量较低,为助坛紫菜抵抗逆境,其变化率仍高于Ⅰ组和Ⅱ组。综上,坛紫菜中红藻糖苷的调节作用比异红藻糖苷更为敏感,这与热激试验结果一致。
4 结论
本研究结果初步证明,逆境胁迫条件下坛紫菜红藻糖苷及其异构体可以作为渗透调节物质参与代谢调节或作为碳前体物以合成细胞壁,当藻体重新置于适宜环境,红藻糖苷含量显著增加并进行贮存,以抵抗下次胁迫。坛紫菜中红藻糖苷的变化更为敏感且具有规律性,其变化率与坛紫菜抗高温能力相关,红藻糖苷含量变化越大,表明坛紫菜的抗逆境能力越强;热激处理前后异红藻糖苷含量未发现明显变化。相同品种、相同日龄的坛紫菜在不同地点栽培,其红藻糖苷含量相对稳定,故可初步认为红藻糖苷能够作为紫菜选育过程中的一个指标物,以进一步探究坛紫菜抗高温胁迫机理且对指导坛紫菜健康栽培具有重要的意义。
