大豆和油菜籽油体形成的天然乳液的稳定性及胃肠道消化特性
2021-07-29何胜华邓乾春
何胜华,邓乾春
(1.许昌学院食品与药学院,河南省食品安全生物标识快检技术重点实验室,河南 许昌 461000;2.农业农村部油料加工重点实验室,湖北 武汉 430062)
冰淇淋、人造黄油、调味品等食品均由分散相(水相或油相)组成,需要添加稳定的乳化剂。许多食物的乳化体系界面都是由磷脂和蛋白质的混合物组成,这些食物中分散体系的形成和稳定性受乳化体系界面相互作用的影响[1]。最近的研究表明,食品工业中某些合成乳化剂的使用与肥胖、代谢疾病、营养不良以及免疫系统疾病的发展密切相关[2-3]。因此,人们正在尝试使用天然乳化剂代替合成乳化剂,而对于人群致敏度较高的动物源成分来说,研究和开发天然植物源乳化剂并将其应用于食品工业已经成为一种新潮流。
许多植物种子储存了大量的中性脂质作为营养物质来源。研究人员已经在多种植物种子和微生物中发现了脂质颗粒,例如:高等植物的种子、花粉和绒毡层,裸子植物的种子,蕨类植物的孢子,真菌和藻类等[4-5]。这些脂质颗粒被限制在离散的球形细胞器中,称为油体[6]。油体是0.5~2 μm的球形液滴,内部的液态基质为三酰甘油酯,表面被单层磷脂-内源性蛋白质组成的生物膜覆盖[7-10]。油体表面的生物膜将三酰甘油酯紧密的包裹在内部,避免被环境中脂肪酶降解破坏[11]。
大豆和油菜籽是中国最重要的两种油料作物,是生产食用植物油和蛋白的主要来源,在提供功能性成分方面发挥着重要作用。研究表明,磷脂单层和蛋白质的组成取决于油料作物的种类,不同油料作物种子油体的外部结构和表面组成存在显著差异[12]。因此不同油料作物种子油体具有不同的特点,可依据各自特点进行不同条件的处理和加工。油体由于其特殊的结构和组成,其天然蛋白质-磷脂层有助于其分散于水相中形成天然水包油(oil in water,O/W)乳液,该天然乳液的形成既不需要额外的乳化剂也不需要均质[13]。同时油体形成的乳液液滴表面有大量的磷酸基团,这些基团带大量的负电荷,可以增加液滴间的静电斥力从而提高油体乳液的分散稳定性[14-15]。油体表面蛋白含量高且种类丰富,是高品质的天然乳化剂和稳定剂,将油体蛋白作为乳化剂掺入食物中可以显著提高食物的营养价值和稳定性[16-17]。来自天然物质的乳化剂具有更安全、更健康的优势。油体表面还吸附着多种蛋白,更易形成稳定的乳液。
大豆和油菜籽油体形成的天然乳液在食品加工过程中会受到各种环境因素的影响,如pH值、盐离子浓度和热处理。这些环境因素(如pH值和盐离子浓度)会改变乳液表面所带电荷,影响液滴之间的静电排斥作用,导致乳液失稳。另外,热处理会导致乳液液滴表面蛋白的变性,也会影响乳液的稳定性。由于不同植物种子油体的蛋白和脂质组成存在差异,其所形成天然乳液的物化特性特别是其稳定性和消化特性也不同。因此本实验通过分析从大豆和油菜籽中提取植物油体的组成,考察了这两种油体所形成天然乳液在环境应力(pH值、盐离子浓度和热处理)下的稳定性以及在胃肠道消化过程中的特性,其目的是通过了解两种天然油体乳液的特点及其在胃肠道的消化特性,为其在食品产品(如色拉调料、调味汁、沙司、蘸料、饮料或甜点)加工过程中替代乳化的大豆油提供理论依据,同时为两种天然油体乳液在运载脂溶性生物活性物质和提高脂溶性生物活性物质的生物利用率方面提供参考。
1 材料与方法
1.1 材料与试剂
大豆和油菜籽购自黑龙江省哈尔滨市种业公司;实验中所用试剂均为分析纯。
1.2 仪器与设备
ALC-210.4电子分析天平、PB-10 pH计 德国Sartorius科技有限公司;HWS24电热恒温水浴锅 上海一恒科学仪器有限公司;TGL-16G离心机 上海市安亭科学仪器厂;3-30K高速冷冻离心机 德国Sigma实验室离心机股份有限公司;Mastersizer 2000激光粒度分析仪、Zetasizer Nano ZS电位分析仪英国Malvern公司;电泳槽 美国BIO-RAD公司;LSM 880激光共聚焦扫描显微镜 德国Carl Zeiss公司。
1.3 方法
1.3.1 大豆、油菜籽油体的提取
大豆和油菜籽油体的提取参照Iwanaga等[18]的方法并稍加修改。将大豆、油菜籽按照料液比1∶5浸泡在蒸馏水中,于4~6 ℃下浸泡20 h,然后将浸泡后的大豆、油菜籽取出沥干,按照料液比1∶5加入含有0.5 mol/L氯化钠和0.4 mol/L蔗糖的Tris-HCl缓冲溶液(50 mmol/L,pH 7.5)中,用组织捣碎机剪切5 min,得到大豆、油菜籽匀浆液。用3 层滤布过滤除去滤渣,滤出液在4 ℃、10 000 r/min的条件下离心45 min,收集上层乳膏状物。将上层的乳膏状物均匀分散在上述含有氯化钠和蔗糖的Tris-HCl缓冲溶液(料液比1∶1)中,在4 ℃、10 000 r/min的条件下离心45 min,再次收集上层乳膏状物。得到的上层乳膏状物均匀分散在50 mmol/L pH 7.5的Tris-HCl缓冲溶液(料液比1∶5)中,4 ℃、10 000 r/min条件下离心,重复此步骤3 次,将每次得到的上层乳膏状物(即大豆、菜籽油体)合并后置于4 ℃冰箱中备用。100 g的大豆约制得25 g的大豆油体(湿基),100 g油菜籽约制得40 g菜籽油体(湿基)。
1.3.2 油体基本成分分析
油体中水分质量分数的测定参照美国谷物化学师协会方法44-15A;油体中蛋白质量分数的测定参照GB 5009.5—2010《食品安全国家标准 食品中蛋白质的测定》;油体中灰分质量分数的测定参照美国谷物化学师协会方法08-01;脂质质量分数为100%减去前3 种成分质量分数的总和。
1.3.3 大豆和油菜籽油体天然乳液的制备
用蒸馏水配制大豆油体质量分数(后同)分别为0.5%、1%、2%、3%、4%和5%的混合液(pH 6.5),于25 ℃下200 r/min搅拌4 h,使油体充分吸水,然后用均质机于12 000 r/min下均质5 min,得到大豆油体天然乳液。
用蒸馏水配制油菜籽油体质量分数分别为1%、2%、3%、4%、5%和6%的混合液(pH 6.5),于25 ℃下200 r/min搅拌4 h,使油体充分吸水,然后用均质机于12 000 r/min下均质5 min,制成油菜籽油体天然乳液。
1.3.4 大豆、油菜籽油体天然乳液粒径的测定
大豆油体乳液和菜籽油体乳液的粒径通过Mastersizer 2000激光粒度分析仪静态光散射法测定,样品手动混合,均匀加入样品池中,达到适宜的遮光度后,测定其粒径。样品池中用于稀释的蒸馏水应调至与样品相同的pH值以避免样品粒径测量时发生改变。样品折射率与水的折射率分别为1.47与1.33,样品的平均粒径用体积平均粒径D(4,3)表示。
1.3.5 大豆、油菜籽油体天然乳液微观结构的观察
取200 μL样品溶液(5%大豆油体乳液或6%菜籽油体乳液)与10 μL尼罗红溶液(尼罗红质量分数0.1%的丙酮溶液)和5 μL快绿FCF溶液(快绿FCF质量分数1%的丙酮溶液)充分混合,染色20 min以上。取5 μL染色样品溶液放在载玻片上,盖上盖玻片,通过激光共聚焦扫描显微镜用60×和100×的油镜观察,尼罗红的激发波长为488 nm,快绿FCF的激发波长为633 nm。
1.3.6 大豆、油菜籽油体天然乳液黏度的测定
5%大豆油体乳液和6%菜籽油体乳液黏度通过旋转流变仪测定,使用杯-圆筒夹具,每次测定时加入17 g样品。测量温度为25 ℃,剪切速率为0.01~100 s-1。使用RheoPlus软件绘图。
1.3.7 大豆、油菜籽油体天然乳液Zeta电位的测定
5%大豆油体乳液和6%菜籽油体乳液的表面电位通过Zetasizer Nano ZS电位分析仪测定,测定前使用与样品相同pH值以及相同离子浓度的水溶液将乳液稀释200 倍,以避免测定过程中产生多重散射效应。
1.3.8 大豆、油菜籽油体天然乳液在不同环境条件下的稳定性分析
选取5%大豆油体乳液和6%菜籽油体乳液,测定不同环境条件下乳液的粒径和Zeta电位,分析pH值、离子浓度、加热时间对乳液稳定性的影响。
1.3.8.1 pH值对乳液稳定性的影响分析
用1 mol/L的HCl或NaOH将乳液的pH值分别调至2、4、6、8、10,室温放置24 h。按照1.3.4节和1.3.7节方法分别对样品进行粒径、Zeta电位测定。
1.3.8.2 离子浓度对乳液稳定性的影响分析
用1 mol/L的NaCl储备溶液(室温放置24 h)将5%大豆油体乳液和6%菜籽油体乳液的离子浓度分别调至0、100、200、300、400、500 mmol/L。按照1.3.4节和1.3.7节分别对样品进行粒径、Zeta电位测定。
1.3.8.3 加热时间对乳液稳定的影响分析
取乳液4 mL分装至6 个5 mL离心管中,在85 ℃下加热90 min,每15 min取样,立即放在4 ℃下冷却待测。按照1.3.4节和1.3.7节分别对样品进行粒径、Zeta电位测定。
1.3.9 大豆、油菜籽油体天然乳液的体外模拟胃肠液消化
选取5%大豆油体乳液和6%菜籽油体乳液模拟体外胃肠液消化,根据Minekus等[19]的方法配制模拟胃、肠消化液储备溶液,配制条件参照表1[19]。

表1 模拟消化液离子储备液的配制[19]Table 1 Preparation of ion stock solutions of simulated digestive fluids[19]
1.3.9.1 模拟胃消化阶段
模拟胃液与乳液以体积比1∶1混合。将450 mL天然乳液倒入烧杯中,放置在37 ℃的恒温振荡水浴锅里。模拟胃消化储备液使用1 mol/L的HCl和NaOH溶液调节至pH 1.5,取360 mL模拟胃消化储备液备用。配制90 mL含0.15 mmol/L CaCl2的胃蛋白酶溶液(胃蛋白酶质量浓度为16 mg/mL),模拟胃消化储备液与胃蛋白酶溶液置于37 ℃水浴锅中。在体外消化的过程中,通过两个蠕动泵加入胃蛋白酶溶液与模拟胃消化液离子储备液,流动速率分别为0.5、2.0 mL/min,模拟胃消化过程持续3 h,振荡速率为100 r/min,每30 min取样一次,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)。同时测定模拟消化前和结束时的乳液粒径分布范围。
1.3.9.2 模拟小肠消化阶段
首先取200 mL胃消化后的溶液,置于烧杯中,然后加入160 mL模拟肠消化液溶液和40 mL胆盐溶液(含250 mg胆盐),将烧杯放入37 ℃恒温水浴锅中。混合后使用1 mol/L的NaOH将混合溶液pH值调至7.5。最后加入120 mg胰酶与800 μL 0.3 mol/L CaCl2开始消化。37 ℃下模拟小肠消化3 h,每30 min取样一次,进行SDS-PAGE,并测定模拟消化前和结束时的乳液粒径分布范围。
1.3.10 SDS-PAGE分析
配制15%分离胶、5%浓缩胶用于模拟胃肠道消化过程中蛋白质的SDS-PAGE。冻干后的样品用上样缓冲液溶解,使其中蛋白终质量浓度约为2 μg/μL,煮沸5 min使蛋白充分变性,然后于4 000 r/min离心15 min,取10 μL上清液用于电泳。设置电泳起始电压80 V,电泳30 min,随后电压增加至120 V,电泳90 min。胶片用质量分数0.01%的考马斯亮蓝R-250染色1 h,使用脱色液(V(冰乙酸)∶V(甲醇)∶V(水)=10∶45∶45)脱色。使用凝胶成像仪拍照。
1.4 数据统计与分析
实验均设置3 个平行,结果以平均值±标准差表示。采用SPSS软件的Tukey法进行显著性分析(P<0.05表示差异显著)。采用Origin 8.5软件绘图。
2 结果与分析
2.1 大豆和油菜籽油体的基本组成
不同油料作物种子油体的组成存在一定的差异,油体组成决定了油体形成天然乳液的特性。大豆油体和油菜籽油体的基本组成如表2所示。大豆油体蛋白质量分数(12.86%)显著高于菜籽油体(7.90%)(P<0.05),而油菜籽油体的脂质质量分数(88.98%)和灰分质量分数(3.12%)显著高于大豆油体中的脂质质量分数(85.63%)和灰分质量分数(1.51%)(P<0.05)。

表2 大豆和油菜籽油体的基本组成(干基)Table 2 Compositions of soybean oil bodies and rapeseed oil bodies (on a dry-mass basis)
2.2 不同质量分数大豆和油菜籽油体天然乳液的粒径
乳液粒径的大小决定了乳液的稳定性和在胃肠道中的消化特性。由图1可知,大豆和油菜籽油体所形成的天然乳液的粒径都随着质量分数的增加而减小。这种结果可能是因为随着油体质量分数的增加,在形成乳液过程中,吸附在油滴界面的油体蛋白和磷脂越多,油体表面所带净负电荷越多,油滴之间的静电排斥作用越强,油滴能更好地分散于水相中,避免聚集和絮凝,所以形成的乳液粒径逐渐减小,乳液更稳定[20]。当大豆油体质量分数为5%时,其形成的天然乳液的粒径约为0.5 μm。该结果与其他学者报道的大豆油体天然乳液粒径范围在0.1~1.0 μm之间[21-22]相一致。油菜籽油体质量分数为6%时,其形成的天然乳液的粒径约为5.0 μm。在相同质量分数下,大豆油体所形成天然乳液的粒径显著低于油菜籽油体所形成天然乳液的粒径(P<0.05)。这种结果与大豆油体和油菜籽油体的组成有关,大豆油体蛋白含量高于油菜籽油体,而油菜籽油体的脂质含量高于大豆油体。蛋白质是良好的乳化剂,具有良好的乳化特性,而且带有大量的负电荷,因此,乳液液滴表面蛋白含量高,有利于乳液保持稳定[22]。虽然脂质特别是磷脂也是良好的乳化剂,具有良好的乳化特性,但是磷脂属于脂类,密度轻而容易上浮,而且在水相的分散性不如蛋白好,所以脂类含量高不利于乳液保持稳定。根据不同质量分数大豆、油菜籽油体天然乳液的粒径,选取5%大豆油体乳液和6%菜籽油体乳液进行后续实验。

图1 不同质量分数大豆和油菜籽油体天然乳液的粒径Fig. 1 Particle sizes of natural soybean and rapeseed oil body emulations in different concentration
2.3 大豆和油菜籽油体天然乳液的微观结构
由图2可以看出,大豆和油菜籽油体所形成天然乳液的油滴都能很好地分散于水溶液中,而大豆油体所形成天然乳液的油滴粒径明显小于油菜籽油体所形成天然乳液,大豆油体所形成天然乳液的油滴在水相中的分散性更好。该结果与2.2节粒径分析结果一致。另外,大豆油体所形成天然乳液的油滴表面吸附了大量的蛋白(绿色),而油菜籽油体所形成天然乳液油滴表面吸附的蛋白含量较少。这与大豆油体含有蛋白含量较高有关。油菜籽油体所形成的天然乳液的油滴有少量聚集发生,这也是其粒径较大的原因。
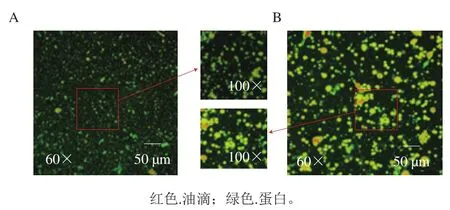
图2 大豆(A)、油菜籽油体(B)天然乳液的激光共聚焦扫描显微镜图Fig. 2 Confocal laser scanning microscopic images of natural soybean (A)and rapeseed (B) oil body emulsions
2.4 大豆和油菜籽油体天然乳液的黏度
乳液的黏度也会影响乳液的稳定性和在胃肠道中的消化特性。乳液的黏度越大,其油滴的沉降速度越慢,乳液越稳定。由图3可知,大豆油体所形成天然乳液的黏度高于菜籽油体所形成天然乳液的黏度,这可能也是大豆油体所形成天然乳液的粒径更小并且更稳定的原因。
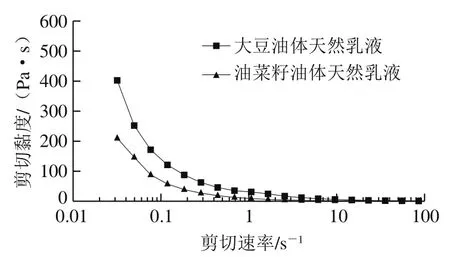
图3 大豆和油菜籽油体天然乳液的黏度Fig. 3 Viscosity versus shear rate curves of natural soybean and rapeseed oil body emulsions
2.5 大豆和油菜籽油体天然乳液的稳定性
尽管油体形成的天然乳液具有良好的稳定性,但对环境应力(例如pH值、离子强度和温度)还是比较敏感[23]。另外,乳液在食品加工及胃肠道消化过程中,都会受到环境应力的影响,如pH值的急剧变化、盐离子浓度改变及各种酶的影响。因此,研究植物油体乳液不同条件下的稳定性很有必要。
2.5.1 乳液在不同pH值下的稳定性
pH值对乳液稳定性最大的影响是改变了乳液液滴表面的电荷,从而影响了乳液液滴之间的静电排斥作用,导致乳液表现不稳定[24]。由图4A可知,大豆油体所形成的天然乳液在pH 4时的粒径为22.8 μm,显著高于其他pH值下的粒径(P<0.05),在pH 4时大豆油体乳液表现出不稳定性。而在pH 2和pH 6~10之间粒径较小,乳液比较稳定。此时天然乳液的pH值远离油体蛋白等电点,乳液液滴表面又带有大量电荷,静电排斥作用较强,乳液液滴不会发生聚集和絮凝,比较稳定,乳液的粒径也较小[24]。
油菜籽油体所形成天然乳液不如大豆油体所形成天然乳液受pH值的影响明显,其在pH 6.0时粒径为7.6 μm,表现不稳定。出现这两种结果与各自油体的组成和油体蛋白的等电点有关。大豆油体所含蛋白质的量较高,因此受pH值的影响较大。另外,大豆油体所形成乳液油滴表面电荷在pH 4.6左右几乎为零(图4B),此时乳液液滴之间的静电排斥作用最弱,油滴之间容易聚集或絮凝,乳液粒径最大,表现不稳定。由此可知,大豆油体蛋白的等电点为4.6左右,乳液中的H+中和了油滴表面的负电荷,使乳液液滴表面电荷为零,静电排斥作用消失,乳液失稳[25]。油菜籽油体所形成的乳液液滴表面的电荷在pH 5.6时为零(图4B),此时液滴之间的静电排斥作用最弱。与在pH 6.0时油菜籽油体所形成的天然乳液粒径较大的结果一致。

图4 pH值对大豆和油菜籽油体天然乳液的粒径(A)和Zeta电位(B)的影响Fig. 4 Effect of pH on the particle size (A) and zeta potential (B) of natural soybean and rapeseed oil body emulsions
2.5.2 乳液在不同NaCl浓度条件下的稳定性
如图5所示,大豆油体所形成天然乳液较油菜籽油体所形成天然乳液受NaCl浓度的影响更明显。当NaCl浓度为100、200 mmol/L时,大豆油体所形成的天然乳液粒径显著高于其他NaCl浓度(P<0.05)。出现这种结果可能是NaCl浓度为100、200 mmol/L时,该浓度的盐与乳液中蛋白质争夺水分子,破坏了油体蛋白所保护乳液界面的水化膜,从而导致乳液失稳。油菜籽油体所形成的天然乳液受NaCl浓度的影响不明显。NaCl浓度对两种油体所形成的天然乳液的Zeta电位影响不显著(P>0.05)。
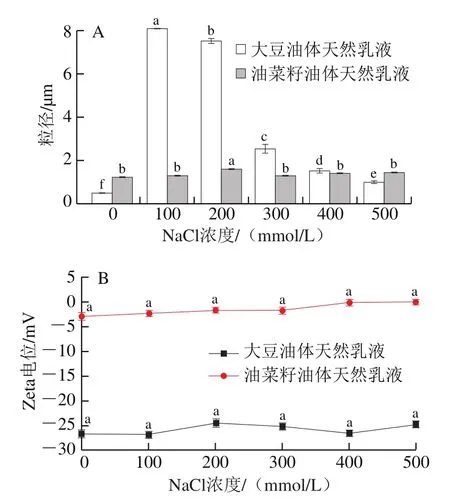
图5 NaCl浓度对大豆和油菜籽油体形成天然乳液的粒径(A)和Zete电位(B)的影响Fig. 5 Effect of NaCl concentration on the particle size (A) and zeta potential (B) of natural soybean and rapeseed oil body emulsions
2.5.3 乳液在不同温度下的稳定性
热处理是食品加工过程中用来确保产品品质、避免食品变质和预防食源性疾病的最常用技术之一。乳液在食品加工过程中,也经常会受到高温处理,因此研究乳液经热处理后的稳定性很重要。由图6可知,大豆油体所形成的天然乳液在85 ℃加热前15 min粒径没有显著性变化(P>0.05)。当加热时间超过15 min时,其粒径随着加热时间的延长逐渐增大,表现出不稳定性(图6A)。而油菜籽油体所形成天然乳液在85 ℃加热15 min时其粒径显著增大,在加热30 min后其粒径变化不显著(P>0.05)。该结果表明油菜籽油体所形成的天然乳液对温度非常敏感,不耐高温。乳液这种在高温长时间处理表现出的不稳定性与乳液液滴界面的蛋白变性有关,蛋白质在高温下变性,导致乳液乳化性能减弱,乳液表现不稳定。热处理对两种乳液液滴表面所带电荷影响不显著(P>0.05)。
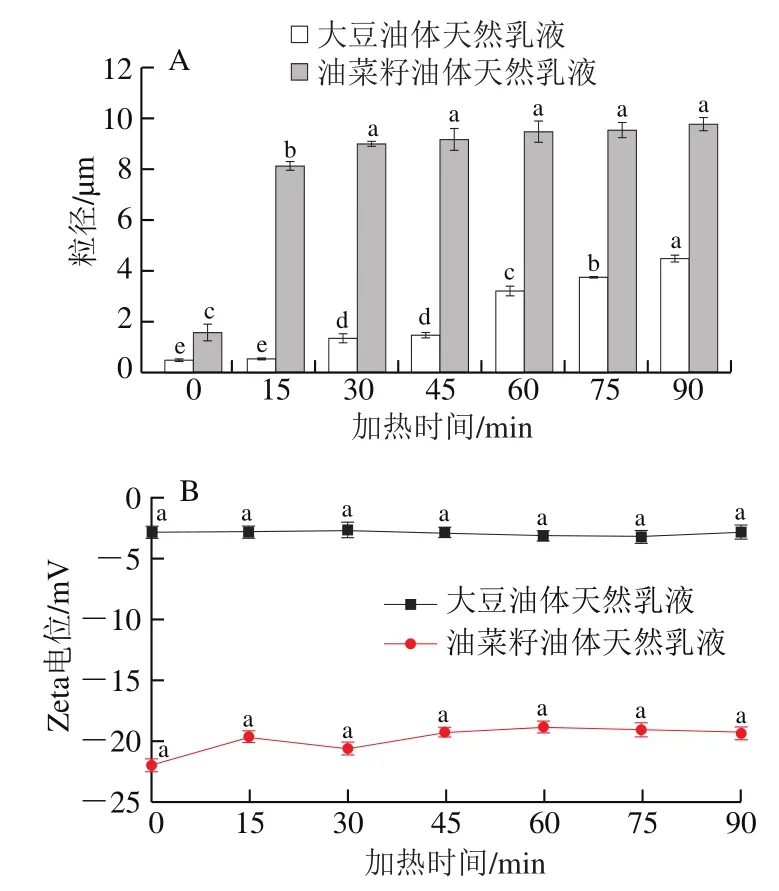
图6 加热时间对大豆和油菜籽油体天然乳液的粒径(A)和Zeta电位(B)的影响Fig. 6 Effect of thermal treatment on the particle size (A) and zeta potential (B) of natural soybean and rapeseed oil body emulsions
2.6 大豆和油菜籽油体天然乳液在模拟胃肠道中的消化特性
乳液在经过胃肠道消化过程中,会经历pH值的显著变化、各种酶的作用以及会与多种盐粒子接触。pH值和酶的作用会对乳液的粒径产生显著变化[26]。5%大豆和6%油菜籽油体在pH 6.5及25 ℃所形成的天然乳液在胃/肠消化180 min内蛋白的变化如图7所示,大豆和油菜籽油体蛋白组成存在一些差异,大豆油体除了含有分子质量18.4~25.0 kDa的油体蛋白外,还含有一些大分子质量的蛋白,而油菜籽油体蛋白的分子质量主要集中在18.4~25.0 kDa之间。
2.6.1 模拟胃肠液消化过程中乳液蛋白的变化
乳液与模拟胃消化液接触后,由于胃液pH值在2.0左右,整个体系随着胃消化时间的延长pH值逐渐降低,胃蛋白酶的活性增加,会不断水解油体乳液表面蛋白。从胃消化过程中油体蛋白的SDS-PAGE结果可以看出,大豆油体所形成的天然乳液在胃消化30 min后,与未消化的起始乳液相比,其条带灰度明显变浅(图7A),说明该乳液蛋白在前30 min消化较快。而在后30 min消化较慢。从图7A还可以看出,大豆油体乳液中油体有一条蛋白条带(分子质量24 kDa左右)在消化前30 min完全消失,该蛋白被胃蛋白酶完全水解。菜籽油体所形成的天然乳液其油体蛋白随着胃消化时间的延长,其蛋白条带颜色逐渐变浅,说明该乳液油体蛋白被逐渐水解。
由图7B可知,进入小肠消化阶段,两种油体蛋白条带几乎消失,说明两种油体所形成天然乳液中的油体蛋白在小肠消化过程中被迅速水解。

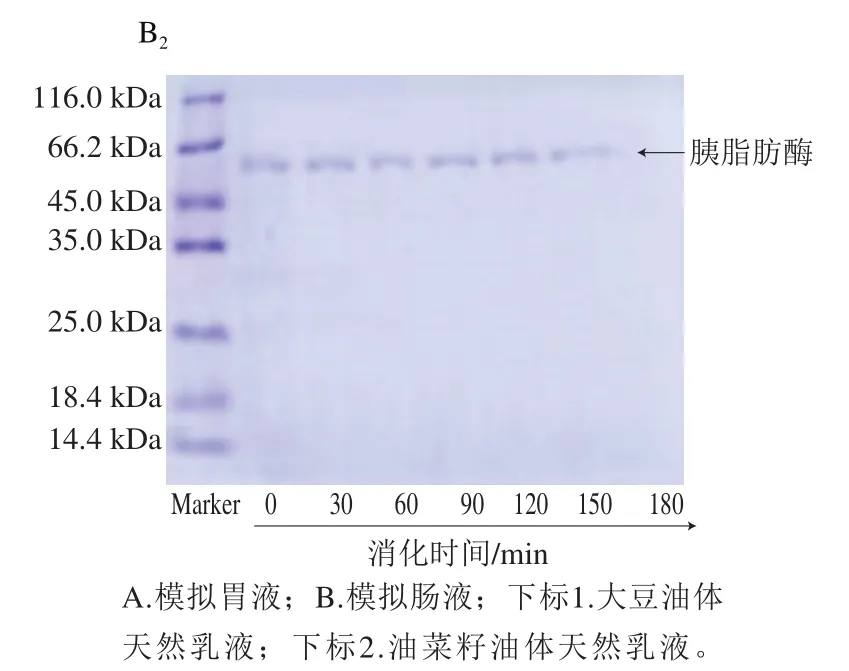
图7 大豆和油菜籽油体形成的天然乳液在模拟胃肠液消化过程中蛋白的变化Fig. 7 Changes in protein profile of natural soybean and rapeseed oil body emulsions during gastrointestinal digestion
2.6.2 胃肠道消化过程中乳液粒径的变化
乳液在胃肠道消化过程中,由于受pH值、酶和盐离子浓度的影响,乳液中的蛋白质和脂质在胃肠道消化过程中会被水解,生成的小分子物质,如氨基酸、肽和游离脂肪酸,这些小分子物质和胆盐一起又会影响乳液的水解[27]。这些过程都会导致乳液的粒径发生显著变化。由图8可知,在胃消化过程中,大豆和油菜籽油体所形成的天然乳液的粒径都高于起始乳液的粒径。出现这种结果的原因为两种油体所形成乳液的油体蛋白在胃消化过程中被水解生成小分子量的氨基酸或肽,导致乳液液滴表面电荷减少,静电排斥作用减弱,乳液发生聚集或絮凝,粒径变大[28-30]。另外一个很重要的因素是乳液在胃消化过程中,其pH值逐渐降低,当pH值降低到乳液液滴表面蛋白的等电点时,乳液失稳,其粒径也会显著增加。因此,在胃消化过程中,乳液pH值的变化也是影响乳液粒径变化的一个主要原因[31]。
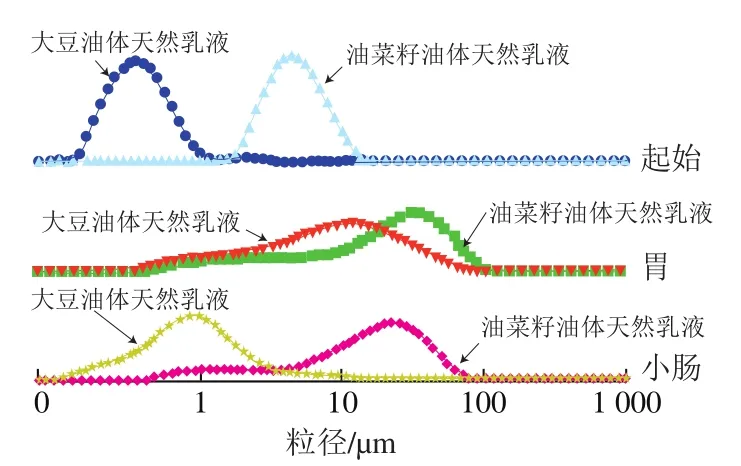
图8 大豆和油菜籽油体形成天然乳液在模拟胃肠道消化180 min后粒径的分布范围Fig. 8 Particle size distribution of natural soybean and rapeseed oil body emulsions during gastrointestinal digestion
当乳液经过胃消化后进入小肠,其pH值会在较短时间升高到7.5左右。乳液液滴表面会带大量负电荷,其静电排斥作用增强,油滴粒径较胃消化阶段减小,特别是大豆油体所形成的天然乳液,其粒径较胃消化过程明显减小(图8)。另一方面,乳液在小肠消化过程中,乳液油滴中的三酰甘油酯会在胰脂肪酶的作用下被酶解生成单甘油酯和游离脂肪酸,一些粒径较大的油滴会被胰脂肪酶酶解,从而也会导致乳液在小肠消化过程中其粒径较胃肠道消化过程变小,但其粒径还是高于初始乳液的粒径[32]。由于油菜籽油体所形成的天然乳液粒径较大,而且部分发生了聚集,酶到达油滴核心三酰甘油酯需要较长时间,所以在小肠消化阶段其酶解速度较慢,其粒径在小肠经180 min消化后较胃消化阶段变化不明显。
3 结 论
本实验利用激光粒度分析仪、旋转流变仪和激光共聚焦扫描显微镜考察了大豆和油菜籽油体形成天然乳液的粒径、黏度和微观结构,同时分析了两种油体天然乳液在环境应力(pH值、离子浓度和热处理)条件下的稳定性和在模拟胃肠液消化过程中蛋白和粒径的变化。研究发现,两种油体所形成天然乳液的粒径都随着油体质量分数的增加而减小,其中大豆油体所形成天然乳液的粒径明显低于油菜籽油体所形成天然乳液的粒径。大豆油体天然乳液液滴表面覆盖了大量的油体蛋白,其黏度高于油菜籽油体乳液的黏度。大豆油体乳液在pH 4.0和NaCl浓度为100、200 mmol/L时粒径较大,表现不稳定。油菜籽油体乳液在pH 6.0不稳定,受NaCl浓度的影响较小。大豆油体乳液在85 ℃热处理前15 min比较稳定,而油菜籽油体乳液对温度比较敏感。大豆油体乳液在胃消化的前30 min蛋白分解较快,然后逐渐趋于平缓,油菜籽油体乳液在整个胃消化过程中蛋白逐渐被分解。大豆油体乳液和油菜籽油体乳液在180 min胃消化过程中其粒径都比初始乳液粒径大。大豆油体乳液在180 min小肠消化过程中其粒径较胃消化过程中明显减小,而油菜籽油体乳液粒径变化不明显。
