烹饪熟度对牛肉肌原纤维蛋白结构特性和氧化特性的影响
2021-07-29万红兵李海鹏雷元华张松山丰永红孙宝忠
万红兵,李海鹏,雷元华,谢 鹏,张松山,丰永红,刘 璇,王 欢,孙宝忠
(中国农业科学院北京畜牧兽医研究所,畜产品质量安全研究室,北京 100193)
牛肉具有多种烹调方式,其中煎制牛排深受肉食消费者的青睐,并逐渐成为高档餐饮产品的代表[1]。熟度是指食物烹煮到可吃的一种程度,是形成菜肴风味的重要保障措施,同时也是影响消费者满意度和消费黏性的重要指标。烹饪界常用成熟度或成熟程度来表示菜肴的烹饪终点,与中式烹饪相比,西式烹饪对肉制品的成熟度,特别是对牛排的成熟度进行了详细的描述。为保证牛排特有的嫩度,根据熟制程度的不同,西餐通常将牛排分为一分熟、三分熟、五分熟、七分熟、全熟和过熟6 种成熟度,并对其终点温度进行了严格的规定,分别为52~55、55~60、60~65、65~69、70~80 ℃和大于90 ℃[2-3]。近年来,随着我国肉牛产业的发展和东西方饮食文化交流的日益深入,欧美国家所崇尚的三分熟、五分熟牛肉逐渐被我国消费者接受,但目前我国居民对牛肉的烹调方式仍以炖煮为主[4-5]。
肌原纤维蛋白是肌肉中一类重要的结构蛋白质,主要由肌球蛋白、肌动蛋白、肌动球蛋白、原肌球蛋白、肌钙蛋白等多种蛋白组成,约占肌肉蛋白质总量的50%~55%[6],除了参与肌肉收缩、影响肌肉嫩度外,其对肉品品质和功能特性都有重要的影响。加热是使生肉变熟的关键环节,是食品加工过程中的重要工艺。加热过程是一个杀菌过程,不仅可以延长产品货架期,同时还可赋予产品特有的色泽和风味,决定产品质地和出品率,而这些品质的变化主要取决于肌原纤维蛋白的热变化。近年来,国内外对肌原纤维蛋白在加热过程中的特性研究多集中在火腿肠、鱼糜等肉糜类产品,而在烹饪熟度对牛肉制品及其肌原纤维蛋白结构的影响研究方面鲜有报道。本研究以牛背最长肌肌原纤维蛋白为研究对象,通过研究烹饪熟度对蛋白聚集特性、氧化程度及其分子结构的影响,探究肌原纤维蛋白结构在烹饪过程中的变化规律,以期为西餐牛排煎制的烹饪工艺优化和品质控制提供参考。
1 材料与方法
1.1 动物、材料与试剂
挑选6 头36 月龄相同方式饲养的本地黄牛,按照GB/T 19477—2018《畜禽屠宰操作规程 牛》进行屠宰。宰后在0~4 ℃的冷库中吊挂排酸48 h,然后取左半胴体背最长肌,剔除多余的脂肪和结缔组织,而后切成100 g左右的肉块,真空包装后放入-28 ℃以下的冷库中,使肉块的中心温度在48 h内达到-18 ℃以下,最后冰运至实验室,贮存于-18 ℃低温冰箱中备用。肌原纤维蛋白提取前,肉样在0~4 ℃下解冻12 h。
氯化钠、氯化钾、尿素、磷酸二氢钠、磷酸氢二钠、溴酚蓝、乙酸、三羟甲基氨基甲烷(Tris)、乙二醇二乙醚二胺四乙酸(ethylene glycol bis(2-aminoethyl ether) tetraacetic acid,EGTA)、2,4-二硝基苯肼、三氯乙酸、甘氨酸、盐酸胍、5,5’-二硫代双-(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)(均为分析纯) 国药集团化学试剂有限公司;丙烯酰胺、四甲基乙二胺、N,N-亚甲基双丙烯酰胺、β-巯基乙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、考马斯亮蓝R-250 美国Sigma公司。
1.2 仪器与设备
TENSOR 27傅里叶变换红外光谱仪 德国布鲁克光谱仪器公司;Avanti J-26S XP高速冷冻离心机 美国贝克曼库尔特商贸有限公司;UltraTurraxT25 BASIS高速匀浆机 德国IKA公司;HI99163酸度计 意大利Hanna仪器设备公司;SIM-F124制冰机 日本三洋公司;BS214D型电子天平 北京赛多利斯仪器系统有限公司;HH-4型可调恒温数显水浴锅 江苏省金坛市荣华仪器制造有限公司;DYCZ-24EN双垂直电泳仪 北京六一生物科技有限公司;GS-900校准型光密度仪 美国Bio-Rad公司;S3500激光粒度仪 美国麦奇克仪器有限公司;UV-6100型紫外-可见分光光度计上海元析仪器有限公司;F-2500荧光分光光度计 日本日立公司。
1.3 方法
1.3.1 牛肉肌原纤维蛋白的提取与热处理
肌原纤维蛋白提取参考Doerscher等[7]的方法并作适当修改。取一定质量的牛肉,剔除脂肪和结缔组织,切碎,加入4 倍体积缓冲液(0.1 mol/L KCl、2 mmol/L MgCl2、1 mmol/L EGTA、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0),匀浆60 s,用60 目滤布过滤,除去结缔组织,2 000×g冷冻离心15 min,弃上清液,取沉淀重复上述步骤两次,得到粗提的肌原纤维蛋白。然后取此沉淀加入4 倍体积的0.1 mol/L NaCl,匀浆30 s,2 000×g冷冻离心15 min,重复两次,最后一次用4 层纱布过滤,收集滤液,用0.1 mol/L HCl溶液调节pH值至6.0,2 000×g冷冻离心15 min,沉淀即为提纯的肌原纤维蛋白。以上操作均在4 ℃下进行。蛋白质量浓度采用双缩脲法进行测定,提取的蛋白质在4 ℃下保存,24 h内用完。
用0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4。pH 7.0的缓冲溶液将肌原纤维蛋白调至需要的质量浓度,取10 mL加入到试管中,室温下保持2 h,而后分别置于54(一分熟)、58(三分熟)、63(五分熟)、68(七分熟)、72(全熟)、100 ℃(过熟)的水浴锅中保温15 min,以未经加热处理的样品作为对照,保温结束后,立即取出置于0~4 ℃的冰浴中存放过夜,第二天进行后续实验。
1.3.2 熟度对肌原纤维蛋白聚集特性的影响分析
1.3.2.1 肌原纤维蛋白浊度测定
用0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0的缓冲溶液将肌原纤维蛋白溶液质量浓度调整为1 mg/mL,按1.3.1节方式加热处理后,参考孔保华等[8]的方法,于600 nm波长处测定吸光度,以0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0的缓冲溶液为空白。
1.3.2.2 肌原纤维蛋白粒径测定
用0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0的缓冲溶液将蛋白质量浓度调整为10 mg/mL,按1.3.1节方式加热处理后,用激光粒度仪对不同加热处理的肌原纤维蛋白进行粒径测定。采用体积分布法进行数据统计,分别选取d0.1、d0.5、d0.9平均粒径及分布宽度进行表示,其中,d0.1、d0.5、d0.9分别表示样品的累计粒径分布数达到10%、50%、90%时所对应的粒径,峰的分布宽度为(d0.9-d0.1)/d0.5。
1.3.3 熟度对肌原纤维蛋白氧化程度的影响分析
1.3.3.1 肌原纤维蛋白表面疏水性测定
用0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0的缓冲溶液将肌原纤维蛋白溶液质量浓度调整为1 mg/mL,按1.3.1节方式加热处理后,参考Chelh等[9]的方法进行测定。取1 mL悬浮液加入40 μL 1 mg/mL的溴酚蓝溶液,空白对照为1 mL该缓冲液加入40 μL 1 mg/mL的溴酚蓝溶液,漩涡振荡混匀10 min,4 ℃、4 000×g离心15 min,取上清液稀释10 倍后,测定595 nm波长处的OD值,按公式(1)计算溴酚蓝结合量,以溴酚蓝结合量表示表面疏水性。

1.3.3.2 肌原纤维蛋白羰基含量测定
用0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0的缓冲溶液将肌原纤维蛋白溶液质量浓度调整为10 mg/mL,按1.3.1节方式加热处理后,参考赵冰等[10]的方法,采用2,4-二硝基苯肼法进行测定。从不同熟度的肌原纤维蛋白溶液中取1 mL加入到50 mL离心管中,再加入4 mL含10 mmol/L 2,4-二硝基苯肼的2 mol/L HCl溶液,以不含2,4-二硝基苯肼的2 mol/L HCl溶液为空白,25 ℃反应1 h。然后每个样品中加入5 mL质量分数为20%的三氯乙酸溶液,振荡混合均匀,在4 ℃条件下,于11 000×g离心5 min,弃上清液,沉淀部分用2 mL体积比为1∶1的乙醇-乙酸乙酯溶液洗涤4 次,以完全洗去未反应的2,4-二硝基苯肼,氮吹除去残留的有机溶液,然后加入2 mL 6 mol/L的盐酸胍溶液(pH 2.3),37 ℃保温30 min,然后在370 nm波长处测定吸光度,蛋白质溶液的质量浓度采用双缩脲法测定,用于计算蛋白质羰基含量的摩尔吸光系数为22 000 L/(mol·cm)。
1.3.3.3 肌原纤维蛋白巯基含量测定
用0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0的缓冲溶液调整肌原纤维蛋白溶液质量浓度为10 mg/mL,按1.3.1节方式加热处理后,参照Ellman[11]的试剂法并稍作修改测定活性巯基含量:取1 mL不同熟度的肌原纤维蛋白溶液加入5 mL Tris-甘氨酸溶液(pH 8.0),然后加入50 μL含质量浓度4 mg/mL DTNB的Tris-甘氨酸溶液,25 ℃放置60 min,2 000×g冷冻离心15 min,取上清液,在412 nm波长处测定吸光度。蛋白质溶液的质量浓度采用双缩脲法测定。按照公式(2)计算活性巯基含量。

式中:X为活性巯基含量/(nmol/mg),即每毫克蛋白质中所含巯基物质的量;A为吸光度;ρ为待测液蛋白质量浓度/(mg/mL);C为摩尔吸光系数(13 600 L/(mol·cm));DF为稀释倍数。
总巯基含量测定:取1 mL不同熟度的肌原纤维蛋白溶液加入5 mL含8 mol/L尿素的Tris-甘氨酸溶液(pH 8.0),然后加入50 μL含质量浓度4 mg/mL DTNB的Tris-甘氨酸溶液,25 ℃放置60 min,2 000×g冷冻离心15 min,取上清液,在412 nm波长处测定吸光度。蛋白质溶液的质量浓度采用双缩脲法测定。按公式(2)计算总巯基含量。
1.3.3.4 二酪氨酸荧光强度测定
用0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0的缓冲溶液将肌原纤维蛋白溶液质量浓度调整为0.5 mg/mL,按1.3.1节方式加热处理后参考Davies等[12]的方法并稍作修改。将不同加热处理的肌原纤维蛋白溶液11 000×g离心10 min,取上清液,采用荧光分光光度计检测二酪氨酸的荧光强度。测定条件:发射波长420 nm,狭缝宽度10 nm;激发波长325 nm,狭缝宽度10 nm。最终结果用荧光强度除以蛋白质量浓度,表示为相对荧光强度。
1.3.4 熟度对肌原纤维蛋白结构的影响分析
1.3.4.1 肌原纤维蛋白内源荧光光谱分析
用0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0的缓冲溶液将肌原纤维蛋白溶液质量浓度调整为1 mg/mL,按1.3.1节方式加热处理后参考康怀彬等[13]的方法并稍作修改。将不同加热处理的肌原纤维蛋白溶液11 000×g离心10 min,取上清液进行分析。测定条件:以0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0的缓冲溶液作为空白,采用荧光分光光度计进行光谱扫描,光谱激发波长295 nm、发射波长300~400 nm、波长扫描范围300~500 nm、激发和发射狭缝宽度均为5 nm。
1.3.4.2 肌原纤维蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
用0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0的缓冲溶液将肌原纤维蛋白溶液质量浓度调整为10 mg/mL,按1.3.1节方式加热处理后参考倪娜[14]的方法进行SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)。电泳条件:分离胶质量分数12%、浓缩胶质量分数4%、上样量10 μL。采用直流恒压电源,浓缩胶电压80 V、分离胶电压120 V。电泳结束后用考马斯亮蓝R-250染色30 min,然后用脱色液脱色,直至背景为无色,使用扫描仪扫描并通过Quantity one 4.6.2软件分析图像。
1.3.4.3 衰减全反射傅里叶变换红外光谱分析
用0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0的缓冲溶液将肌原纤维蛋白溶液质量浓度调整为10 mg/mL,按1.3.1节方式加热处理后,参考Gangidi等[15]的方法并稍作修改。取适量不同加热处理的肌原纤维蛋白溶液置于衰减全反射附件上进行扫描,通过扣除0.6 mol/L NaCl、0.05 mol/L Na2HPO4/NaH2PO4,pH 7.0的缓冲溶液背景进行基线校准,扫描范围4 000~400 cm-1、信号扫描累加64 次、扫描分辨率4 cm-1,每种处理图谱重复扫描3 次。
图谱处理:首先采用仪器自带的OPUS 7.0软件对图谱进行预处理,然后采用PeakFit 4.12软件对酰胺I带(1 700~1 600 cm-1)图谱进行分析,估计各叠加子峰个数及峰位,确定各子峰归属,根据各子峰积分面积计算二级结构相对含量。
1.4 数据处理与分析
采用Excel 2010软件处理实验数据,采用Origin 8.5软件进行图表绘制,采用SAS 8.1统计分析软件进行单因素方差分析,显著性差异使用Duncan’s新复极差法进行多重比较,以P<0.05表示差异显著。
2 结果与分析
2.1 熟度对肌原纤维蛋白聚集特性的影响
2.1.1 熟度对肌原纤维蛋白浊度的影响
由图1可知,熟度对肌原纤维蛋白浊度影响显著(P<0.05),随着熟度的增加,浊度整体呈升高趋势。蛋白熟度从对照到七分熟时,溶液浊度显著增大(P<0.05),表明蛋白发生聚集,浊度越大其聚集程度就越大;从七分熟开始,随着熟度的增加,溶液浊度显著下降(P<0.05),表明聚集的蛋白在热作用下开始发生解聚,导致浊度下降。上述变化主要与肌原纤维蛋白的组成有关。肌原纤维蛋白主要由肌球蛋白和肌动蛋白组成,不同的蛋白质具有不同的变性温度,其中,肌球蛋白的变性温度为50~60 ℃;肌动蛋白的变性温度为70~80 ℃[16-17]。在七分熟时,蛋白的终点温度为68 ℃左右,此时的肌球蛋白已完全变性,分子之间发生了充分聚集,导致浊度上升,这与Boyer[18]、李清正[19]和潘锦锋[20]等研究结果相一致。随着熟度的继续增加,肌原纤维蛋白已完全变性,变性的蛋白破坏了凝胶聚集体网络结构的完整性,在热的作用下蛋白聚集体发生了明显的降解,形成大量的小分子蛋白片段,从而导致浊度下降[21]。

图1 熟度对肌原纤维蛋白浊度的影响Fig. 1 Effect of degree of doneness on the turbidity of myofibrillar protein
2.1.2 熟度对肌原纤维蛋白粒径的影响
由表1可知,从一分熟到全熟,随着熟度的增加,肌原纤维蛋白d0.1、d0.5、d0.9和平均粒径均总体呈现先增后减的变化趋势,并在五分熟时,各项指标达到最大;而后呈现随熟度的增加而减小的趋势,上述现象与图1蛋白浊度的变化趋势相似,进一步说明在烹饪过程中,蛋白在热的作用下首先发生了聚集;此外,在熟制后期,随着蛋白熟度的增加,蛋白聚集体发生部分解聚,从而导致粒径变小,峰分布宽度变窄。

表1 熟度对肌原纤维蛋白粒径的影响Table 1 Effect of degree of doneness on particle diameter of myofibrillar protein
2.2 熟度对肌原纤维蛋白氧化程度的影响
2.2.1 熟度对肌原纤维蛋白表面疏水性的影响
由图2可知,熟度对肌原纤维蛋白表面疏水性影响显著(P<0.05),其中,一分熟与过熟,五分熟与全熟之间表面疏水性差异不显著(P>0.05)。从对照组到过熟,随着熟度的增加,蛋白表面疏水性逐渐增大,并在七分熟时达到最大,而后又随熟度的增加而减小,这与李清正[19]、吕彤[22]和Promeyrat[23]等的研究结果相一致。有研究指出,大多数表面疏水性基团位于肌球蛋白的头部,且加热过程中肌原纤维蛋白疏水性均呈上升趋势[24]。本研究发现,从对照组到七分熟,表面疏水性持续升高,继续升温则表面疏水性降低,其原因可能在于从对照组到七分熟,随着熟度的增加,蛋白疏水性侧链暴露程度增大,使蛋白水溶环境转变为疏水性环境,从而导致表面疏水性升高;随着熟度进一步增加,肌球蛋白会发生变性而肌原纤维蛋白会发生聚集和侧链间的反应,出现沉淀,随着蛋白聚集程度增加,少量疏水基团又被重新包埋于肌球蛋白内部而导致其表面疏水性降低[19,25]。
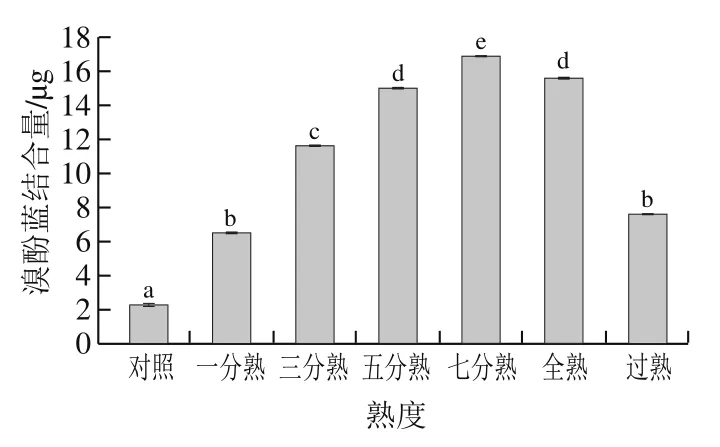
图2 熟度对肌原纤维蛋白表面疏水性的影响Fig. 2 Effect of degree of doneness on surface hydrophobicity of myofibrillar protein
2.2.2 熟度对肌原纤维蛋白羰基含量的影响
蛋白质中羰基含量是蛋白氧化的重要指标之一,羰基的形成是蛋白质发生氧化的明显标记,反映了蛋白质氧化破坏的程度,一般来说,羰基含量越高,蛋白氧化程度越大。由图3可知,熟度对蛋白羰基含量影响显著(P<0.05),随着熟度的增加,蛋白羰基含量呈逐渐增大趋势,其中,七分熟与全熟的蛋白羰基含量差异不显著(P>0.05)。Srinivasan等[26]研究表明,通常蛋白质氧化会同时伴随脂肪的氧化,而脂肪的氧化反过来又会促进蛋白质发生氧化。本研究所提取的肌原纤维蛋白,不可避免地会含有少量脂肪。有研究发现,肌原纤维蛋白中残余脂肪约占其干质量的0.49%,主要来源于肌肉细胞膜中的磷脂[27]。磷脂中富含的不饱和脂肪酸极易发生氧化而生成醛、酮、醇、酸等物质,其中,醛类物质可进一步与蛋白氨基酸侧链发生化学反应,诱导蛋白质氧化。

图3 熟度对肌原纤维蛋白羰基含量的影响Fig. 3 Effect of degree of doneness on carbonyl group content of myofibrillar protein
2.2.3 熟度对肌原纤维蛋白巯基含量的影响
肌原纤维蛋白富含巯基,其暴露于氧化条件下易转化为二硫键,导致巯基含量降低,因此巯基含量也是表征蛋白氧化程度的重要指标。由图4可知,随着蛋白熟度的增加,活性巯基、总巯基含量均呈现先上升后下降的变化趋势(P<0.05)。研究表明,加热温度显著影响肌动球蛋白的解离程度,较低的加热温度(50~60 ℃)对肌动球蛋白的解离有不同程度的促进作用,其中60 ℃是促进肌动球蛋白解离的最佳温度[28-30]。本研究发现,肌原纤维蛋白从对照组到三分熟,活性巯基含量上升,表明肌动球蛋白分子发生解离,原因在于三分熟时,蛋白的终点温度为58 ℃左右,正好位于肌动球蛋白解离的最佳温度范围;随着熟度增加,肌动球蛋白构象发生改变,活性巯基被氧化成二硫键,从而导致巯基含量减少。

图4 熟度对肌原纤维蛋白活性巯基和总巯基含量的影响Fig. 4 Effect of degree of doneness on active sulfhydryl and total sulfhydryl contents of myofibrillar protein
2.2.4 熟度对二酪氨酸荧光强度的影响
酪氨酸是自由基氧化攻击的敏感氨基酸,易被氧化形成二酪氨酸,因此,检测二酪氨酸荧光强度的变化可以反映蛋白质的氧化程度[31]。由图5可知,熟度对肌原纤维蛋白二酪氨酸荧光强度的影响显著(P<0.05)。与对照组相比,随着熟度的增加,二酪氨酸荧光强度呈现先升高后降低、然后又升高的变化趋势,且在一分熟时达到最高,七分熟时达到最低,恰与前文表面疏水性、羰基含量和巯基含量的变化趋势相反,这可能与熟制过程中蛋白的聚集状态有关。熟制初期(一分熟)蛋白终点温度为54 ℃左右,此时肌动球蛋白受热发生解离[28-30],蛋白分子结构逐渐展开,使酪氨酸侧链基团的暴露程度增大,增加自由基攻击的概率,产生较多的酪氨酰自由基和酪氨酸残基,形成较多的二酪氨酸,导致二酪氨酸荧光强度较大;随着烹饪熟度的增加,七分熟时蛋白终点温度为68 ℃左右,肌原纤维蛋白在热的作用下会发生变性、聚集并形成凝胶网络,此时部分酪氨酸侧链和生成的二酪氨酸被包埋于蛋白内部,不仅降低了自由基攻击概率,而且也减弱了二酪氨酸的荧光强度,从而使检测结果降低;在熟制后期,从七分熟到过熟,此阶段蛋白终点温度较高,蛋白体系中产生较多的自由基,此外,蛋白聚集体在热的作用下发生裂解,破坏了蛋白空间结构的完整性[8,13,21],增加自由基攻击酪氨酸侧链的概率,从而导致二酪氨酸荧光强度上升。

图5 熟度对肌原纤维蛋白二酪氨酸荧光强度的影响Fig. 5 Effect of degree of doneness on fluorescence intensity of dityrosine from myofibrillar protein
综上所述,肌原纤维蛋白在熟制过程中,随着蛋白熟度的增加,羰基含量呈逐渐增大的趋势,表面疏水性、巯基含量呈现先升高后降低的变化趋势,二酪氨酸荧光强度呈现先升高后降低而后又升高的U字型变化趋势。综合分析表面疏水性、羰基含量、巯基含量和二酪氨酸荧光强度等指标在熟制过程中的变化趋势发现,熟制过程对肌原纤维蛋白的氧化程度影响显著。
2.3 熟度对肌原纤维蛋白结构的影响
2.3.1 内源荧光光谱分析结果
蛋白质的内源荧光主要来源于芳香族氨基酸残基,主要是色氨酸残基,采用295 nm作为激发波长,可以只激发色氨酸残基,排除酪氨酸残基的干扰;因此,将该激发波长处的内源荧光全部归于色氨酸残基的贡献[32]。色氨酸荧光发射光谱主要反映色氨酸微环境极性的变化,是监测蛋白质分子三级结构的重要技术手段之一[33]。由图6和表2可知,熟度对肌原纤维蛋白最大吸收波长(λmax)影响明显(P<0.05)。对照组的肌原纤维蛋白的λmax位于334 nm波长附近,当蛋白熟度达到一分熟时,λmax向长波方向红移至335 nm波长附近,最大荧光强度由1 177 AU升高至1 353 AU,说明在此阶段,蛋白分子受热伸展,色氨酸残基暴露程度增大;从一分熟到三分熟,λmax红移2 nm至337 nm附近,此时最大荧光强度下降至1 031 AU,这可能是由于肌球蛋白受热发生凝集[34],蛋白分子表面性质发生改变,导致蛋白荧光发射减弱,荧光强度减小;从三分熟到五分熟,荧光强度下降至840 AU,由于λmax未发生变化,故无法确定蛋白结构的变化[35];从五分熟到七分熟,λmax蓝移2 nm至335 nm波长处,最大荧光强度由840 AU升高至865 AU,表明蛋白分子受热发生聚集,构象发生改变,色氨酸残基逐渐暴露;从七分熟到全熟,λmax红移2 nm至337 nm波长处,最大荧光强度继续增大,这可能是蛋白分子受热发生降解,增加了色氨酸残基的暴露程度,导致荧光强度增大;继续增加熟度至过熟,蛋白完全变性且构象趋于稳定,λmax保持不变,蛋白分子降解程度增加[8,13,21],使色氨酸残基暴露程度增大,从而导致荧光强度进一步增大。

表2 熟度对肌原纤维蛋白λmax和最大荧光强度的影响Table 2 Effect of degree of doneness on λmax and fluorescence intensity of myofibrillar protein

图6 熟度对肌原纤维蛋白荧光光谱的影响Fig. 6 Effect of degree of doneness on fluorescence spectrum of myofibrillar protein
2.3.2 肌原纤维蛋白二级结构含量变化
由表3可知,对照组的肌原纤维蛋白二级结构以β-折叠为主,相对含量约为36.37%,其次是α-螺旋(29.43%)、无规卷曲(20.32%)、β-转角(13.88%)。随着熟度的增加,β-折叠相对含量呈现逐步降低而后又升高的变化趋势,其中在五分熟时,相对含量达到最低;无规卷曲相对含量在五分熟之前保持相对稳定,然后随熟度增加而逐渐下降;α-螺旋相对含量在五分熟之前也保持相对稳定,从五分熟到全熟,相对含量逐渐增大,到过熟时,其相对含量开始下降;β-转角相对含量在熟制过程中一直保持相对增加的趋势。

表3 不同熟度肌原纤维蛋白二级结构相对含量变化Table 3 Changes in secondary structure relative contents of myofibrillar protein with different degrees of doneness
α-螺旋结构是通过分子内氢键维持的蛋白质分子内的有序排列;β-折叠是通过分子间氢键维持的蛋白质分子间的有序排列。在加热条件下,α-螺旋相对含量降低表示蛋白质分子内氢键作用减弱,蛋白质分子展开程度增加;β-折叠相对含量增加表明蛋白质分子间氢键作用增强,蛋白质分子间聚集程度增加[36]。上述结果表明,五分熟是肌原纤维蛋白二级结构相对含量变化的拐点。蛋白从对照到五分熟,β-折叠相对含量降低,α-螺旋相对含量保持稳定,推测此时蛋白分子主要靠分子内氢键维持;从五分熟开始,β-折叠相对含量逐渐增加,α-螺旋相对含量先增加后降低,表明蛋白分子间聚集程度逐渐增大。这可能与肌原纤维蛋白的解离及其凝胶机制有关。肌动球蛋白是肌原纤维蛋白的主要成分,肉品加热会引起肌动球蛋白发生解离[37],当蛋白达到五分熟时,终点温度为63 ℃左右,能够促进肌动球蛋白的解离[29],肌球蛋白分子此时发生变性,尾部结构全部消失,相互凝集成球状,熟度继续增加至全熟,终点温度超过了肌球蛋白的变性温度,分子结构变得松散,暴露出活性基团并使之交联[38];此外,肌动蛋白开始发生变性会促进蛋白分子进一步聚集,此时蛋白凝胶效果最好[8,39],从全熟以后,蛋白分子开始发生分解。
2.3.3 肌原纤维蛋白组分的变化
为了分析熟度对蛋白组分的影响,对不同熟度的肌原纤维蛋白溶液进行离心,然后对上清液进行SDS-PAGE,结果见图7。在不同熟度肌原纤维蛋白泳道上存在多条共同的条带,主要包括肌钙蛋白T、原肌球蛋白、肌球蛋白轻链1、肌钙蛋白I亚基、肌球蛋白轻链2和肌球蛋白轻链3共6 种,说明这6 种蛋白均未参与热诱导凝胶的形成。而肌球蛋白重链、α-肌动素和肌动蛋白3 种蛋白只在对照组和一分熟的泳道对应位置出现条带,在其他熟度相应位置均未发现条带,说明这3 种蛋白参与了热诱导凝胶的形成,这与文献[40-41]研究结果相一致。由图7、8可知,随着蛋白熟度的增加,肌球蛋白重链和肌动蛋白的灰度均呈现先升高后下降的变化趋势,其中,从对照组到三分熟,肌球蛋白重链和肌动蛋白灰度缓慢上升,表明肌原纤维蛋白受热发生聚集,继续加热到过熟状态,蛋白分子完全变性,在热的作用下蛋白聚集体开始降解,导致灰度缓慢下降;而对于α-肌动素来说,在烹调过程中,其灰度整体呈增大趋势,具体原因未知。
3 结 论
本研究以牛背最长肌肌原纤维蛋白为研究对象,研究了蛋白在熟制过程中聚集特性、氧化特性和结构特性的变化规律,结果表明:烹饪过程显著影响肌原纤维蛋白的聚集特性、氧化特性和结构特性。从对照组到过熟,肌球蛋白重链、α-肌动素和肌动蛋白3 种蛋白参与了肌原纤维蛋白的热聚集行为,随着烹饪熟度的增加,肌原纤维蛋白在溶液中的状态逐渐由聚集向解聚转化;在烹饪过程中,蛋白羰基含量逐渐增大,表面疏水性、巯基含量呈现先升高后降低的变化趋势;二酪氨酸荧光强度、内源荧光强度随熟度的增加呈现先升高后降低然后又升高的U型变化趋势;五分熟是肌原纤维蛋白二级结构相对含量发生变化的拐点,蛋白从对照组到五分熟,β-折叠相对含量降低,α-螺旋相对含量保持稳定,蛋白主要以分子内聚集为主,从五分熟到过熟,β-折叠相对含量逐渐增加,α-螺旋相对含量先增加后降低,蛋白以分子间聚集为主。本研究结果可为西餐牛排煎制工艺优化和品质控制提供理论依据。
