丁香酚复合保鲜剂对腐败希瓦氏菌的抗菌作用机制
2021-07-29张家涛徐赵萌
王 明,张家涛,周 斌,丁 洁,徐赵萌,孙 彤,*
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.润盈生物工程(上海)有限公司,上海 201306;3.浙江新银象生物工程有限公司,浙江 台州 318000)
水产品优势腐败菌的生长繁殖是引起水产品腐败的主要因素之一,腐败希瓦氏菌是水产品优势腐败菌之一[1]。丁香的主要化学成分为挥发油类和黄酮等,挥发油相对含量为14%~20%,其中丁香酚的相对含量为78%~95%。丁香酚具有抗癌、抗氧化、抗衰老和抗菌性能[2-4]。周倩倩[5]和Devi[6-7]等研究发现,丁香酚对革兰氏阳性菌和革兰氏阴性菌均表现出很好的抗菌活性。麝香草酚又称百里(香)酚,化学名为5-甲基-2-异丙基酚,是一种单萜酚,主要存在于百里香属植物中,也是百里香属植物挥发油的主要成分[8]。其具有抗菌、消炎等功效[9-11],对革兰氏阳性菌和革兰氏阴性菌均具有很好的抗菌活性[12-13]。逄炳栋[14]的研究表明,麝香草酚分布在细胞膜的多聚糖层,通过抑制主要活性成分的合成及蛋白质的形成,从而抑制细菌的生长繁殖。乳酸菌在代谢过程中会生成乳酸等有机酸,降低环境中的pH值,此过程对乳酸菌自身生长无明显影响,但可抑制有害菌增殖,未解离的有机酸通过自由扩散进入细菌细胞膜内,在菌体内解离释放质子,降低了菌体内环境的pH值,破坏了细菌内部的酸碱平衡,造成菌体死亡[15]。溶菌酶广泛存在于动植物和微生物等体内,由18 种129 个氨基酸残基构成,分子质量约14 000 Da,是一种天然的稳定蛋白酶[16]。溶菌酶具有很好的抗菌性能,其对革兰氏阳性菌的抗菌性能优于革兰氏阴性菌[17-18]。
应用于食品保鲜的复合生物保鲜剂备受关注,它不仅可以减少单一保鲜剂的使用量,也可拓宽其抑菌谱,发挥其广谱抑菌作用。王叶青等[19]研究发现,菊花精油和金盏花精油复配对枯草芽孢杆菌具有协同抑菌作用。Zhang Jiatao[20]和Yang Hua[21]等分别发现茶多酚与溶菌酶复合保鲜剂、茶多酚与ε-聚赖氨酸盐酸盐复合保鲜剂对腐败希瓦氏菌均有协同抗菌作用。而对丁香酚复合保鲜剂的抗菌性能和抗菌机理的研究鲜有报道。
本研究以水产品优势腐败菌——腐败希瓦氏菌为抗菌对象,选用丁香酚、丁香酚/麝香草酚、丁香酚/乳酸和丁香酚/溶菌酶(食品级和生物级)为保鲜剂,研究其抗菌性能及作用机制。采用抑菌圈法表征丁香酚及其复合保鲜剂对腐败希瓦氏菌的抗菌性能,通过扫描电子显微镜(scanning electron microscope,SEM)和透射电子显微镜(transmission electron microscope,TEM)观察菌体的微观形态变化,测定腐败希瓦氏菌菌体细胞膜的通透性、完整性、损伤程度以及菌体内Na+、K+-腺苷三磷酸酶(adenosine triphosphatase,ATPase)和碱性磷酸酶(alkaline phosphatase,AKPase)活性变化,分析丁香酚及其保鲜剂的抗菌机制。
1 材料与方法
1.1 菌株、材料与试剂
腐败希瓦氏菌(ATCC 8071) 美国微生物菌种保藏中心。
半乳糖苷酶释放法和正苯基萘胺摄入法细菌膜损伤荧光检测试剂盒、细菌可溶性总蛋白质制备试剂盒 上海杰美基因医药科技有限公司;超微量Na+、K+-ATPase测定试剂盒、AKPase测定试剂盒、考马斯亮蓝试剂盒 南京建成生物工程研究所;L-乳酸(纯度为90%) 上海阿拉丁生化科技股份有限公司;溶菌酶(食品级,18 U/mg) 上海鼎盛生物科技有限公司;溶菌酶(生物级,20 000 U/mg)上海麦克林生化科技有限公司;LB肉汤、LB营养琼脂北京奥博星生物试剂有限公司;去离子水(电导率小于20 μS/cm)为实验室自制;其他试剂均为分析纯。
1.2 仪器与设备
MLS-3030CH型立式高压蒸汽灭菌锅 日本三洋有限公司;LQ-C5001型电子天平 上海瑶新电子科技有限公司;LRH-150型生化培养箱、DK-8D型恒温水浴锅上海一恒科技有限公司;THZ-D型台式恒温振荡箱太仓市实验设备厂;X1R型高速冷冻离心机、Legend Micro21R型台式微量离心机 赛默飞世尔科技(中国)有限公司;Victor X3型酶标仪 上海珀金埃尔默仪器有限公司;S-4800型场发射SEM 日本日立公司;Jem-2100F型场发射TEM 日本电子公司;FE38-Meter型电导率仪 瑞士梅特勒-托利多公司;UV-2550型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;Scientz-IID型超声波细胞破碎机 宁波新芝生物科技股份有限公司;ZD-9556型脱色摇床 常州市凯航仪器有限公司。
1.3 方法
1.3.1 丁香酚复合保鲜剂抗菌性能测定
以体积分数30%乙醇溶液为溶剂,分别配制0.3%(质量分数,下同)丁香酚、0.1%麝香草酚、1.0%乳酸、2.4%溶菌酶(食品级)、2.4%溶菌酶(生物级)和0.15%+0.05%丁香酚/麝香草酚、0.15%+0.50%丁香酚/乳酸、0.15%+1.20%丁香酚/溶菌酶(食品级)和0.15%+1.20%丁香酚/溶菌酶(生物级)的保鲜剂溶液,并以30%乙醇溶液为对照组。参照王梦如等[22]的方法并作适当修改,采用牛津杯法,分别加入200 μL上述一定质量分数的抗菌剂,于28 ℃培养24 h后,测定各保鲜剂作用后腐败希瓦氏菌的抑菌圈直径。
1.3.2 腐败希瓦氏菌微观形态观察
取适量新鲜菌悬液于50 mL离心管中,于3 000 r/min离心10 min,弃上清液,用磷酸缓冲液(0.1 mol/L、pH 7.4)稀释并调节菌悬液浓度至OD600nm≈0.5。取10 mL菌悬液,加入保鲜剂至所需添加水平,于28 ℃振荡培养。12 h后取出部分菌悬液,参照杨丽丽[23]的方法对腐败希瓦氏菌样品进行后续处理,采用离子溅射仪于20 kV下喷金3 min,再采用场发射SEM观察保鲜剂处理前后菌体的微观形态。经染色、切片处理后,采用场发射TEM观察保鲜剂处理前后菌体内部的微观形态。
1.3.3 腐败希瓦氏菌细胞膜通透性、完整性和损伤程度测定
细胞膜通透性测定:菌体培养和抗菌过程参考1.3.1节和1.3.2节。之后每间隔一段时间测定菌悬液的电导率,至电导率不再变化为止。
细胞膜完整性测定:参考李元政等[24]方法,每20 min取0.5 mL的菌悬液,经0.22 μm滤膜过滤,采用酶标仪测定滤液在260 nm波长处的吸光度,至吸光度不再变化为止。
细胞膜损伤程度测定:参照正苯基萘胺摄入法细胞膜损伤荧光检测试剂盒说明书,采用Victor X3型酶标仪测定细胞膜外膜损伤程度;参照半乳糖苷酶释放法细胞膜损伤荧光检测试剂盒说明书,采用Victor X3型酶标仪测定细胞膜内膜损伤程度。
1.3.4 腐败希瓦氏菌Na+、K+-ATPase、AKPase活力测定
在菌体培养、抗菌12 h后,参照超微量Na+、K+-ATPase活力测定试剂盒说明书进行菌体样品处理、酶促反应及定磷实验并测定Na+、K+-ATPase活力;参照AKPase活力测定试剂盒说明书测定AKPase活力。
1.4 数据统计与分析
每个实验做3 次平行,结果均以平均值±标准偏差表示。采用Origin 9.0软件作图。采用SPSS 19.0软件处理实验数据,并采用Duncan检验进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 丁香酚复合保鲜剂抗菌性能分析结果
丁香酚复合保鲜剂对水产品优势腐败菌——腐败希瓦氏菌的抗菌性能如表1所示。丁香酚、麝香草酚、乳酸、食品级的溶菌酶作用于腐败希瓦氏菌后,均表现出较好的抑菌性能,而生物级别的溶菌酶无抑菌性能。与单一保鲜剂相比,丁香酚复合保鲜剂的抑菌性能更优。说明丁香酚与其他保鲜剂复配后,对腐败希瓦氏菌有协同抗菌作用。
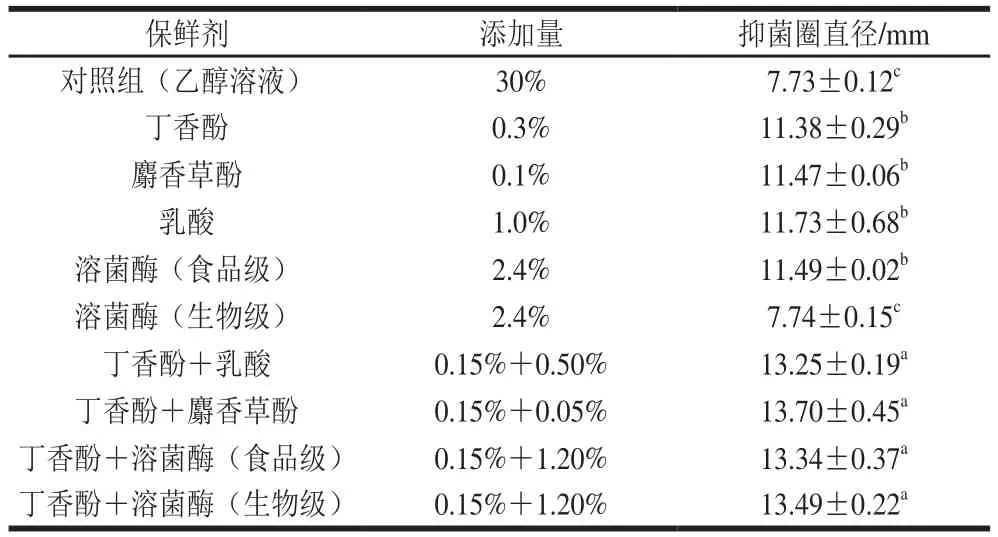
表1 丁香酚复合保鲜剂的抑菌圈直径Table 1 Inhibitory zone diameters of eugenol-containing composite preservatives
2.2 丁香酚复合保鲜剂对腐败希瓦氏菌微观形态的影响
经丁香酚复合保鲜剂处理前后的腐败希瓦氏菌微观形貌如图1所示。对照组的腐败希瓦氏菌呈杆状,表面光滑且个体饱满,无形变损伤,菌体内部结构完整,细胞壁边缘较清晰,细胞膜包裹着细胞质,细胞质比较均匀地分布在细胞内(图1A1、A2)。由图1B1、B2可见,经丁香酚处理后,腐败希瓦氏菌稍有扭曲变形,菌体中间部位的细胞壁膜破损裂开、有明显凹陷。菌体内部的细胞壁膜变薄甚至消失,细胞质流失较多,菌体结构发生明显改变。分析认为,丁香酚可与细胞膜的磷脂反应,增加细胞膜通透性,使细胞出现孔洞甚至破裂,导致细胞内容物渗漏,使细胞死亡,这与Devi等[7]的研究结果一致。由图1C1、C2可见,经丁香酚/麝香草酚处理后,腐败希瓦氏菌出现了质壁分离现象,细胞壁膜溶解,细胞质内容物分布不均,且有部分流失。分析认为,可能是麝香草酚中共同存在疏水性很强的苯环和亲水性较强的酚羟基,使其能够很快融入细菌的细胞膜中,因此,丁香酚与麝香草酚复配后可增加细胞膜通透性,使膜电位降低,细菌细胞膜上的离子通道被打开或被溶解损坏,细胞破裂,菌体内容物发生泄露[12-13,25]。由图1D1、D2可见,经丁香酚/乳酸处理的腐败希瓦氏菌菌体出现褶皱、部分凹陷,细胞壁不完整,有溶解消失现象,造成细胞质内容物分布不均匀,饱满感缺失。丁香酚对腐败希瓦氏菌细胞膜能产生一定损伤,与乳酸复配后,未解离的乳酸更多地通过自由扩散进入细菌细胞膜内,在菌体内解离并释放质子,破坏细菌内部的酸碱平衡,进一步干扰细胞膜的正常代谢,从而对细菌的破坏进一步加强[15]。
由图1E1、E2可见,经丁香酚/溶菌酶(食品级)处理后,腐败希瓦氏菌菌体细胞严重变形,褶皱加深,细胞部分萎缩,细胞壁膜损伤程度较重,造成内容物流出,密度下降,这是丁香酚与溶菌酶协同抗菌作用的结果。丁香酚首先与腐败希瓦氏菌细胞壁脂多糖层作用,使细胞壁肽聚糖层暴露,进而导致溶菌酶将暴露于表面的肽聚糖中的N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1,4-糖苷键水解,引起细胞裂解死亡[26]。由图1F1、F2可见,经丁香酚/溶菌酶(生物级)处理后,腐败希瓦氏菌的菌体结构完全遭到破坏,细胞壁膜溶解严重,壁膜消失,细胞内容物严重流失,胞内物质向细胞膜一侧集中,并出现空腔。这可能是由于生物级溶菌酶比食品级溶菌酶纯度更高,活力更强。
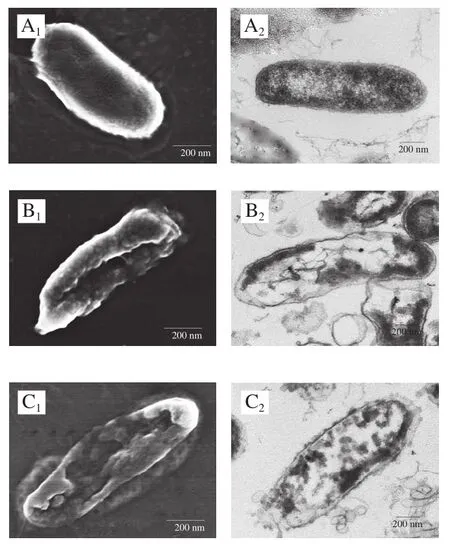
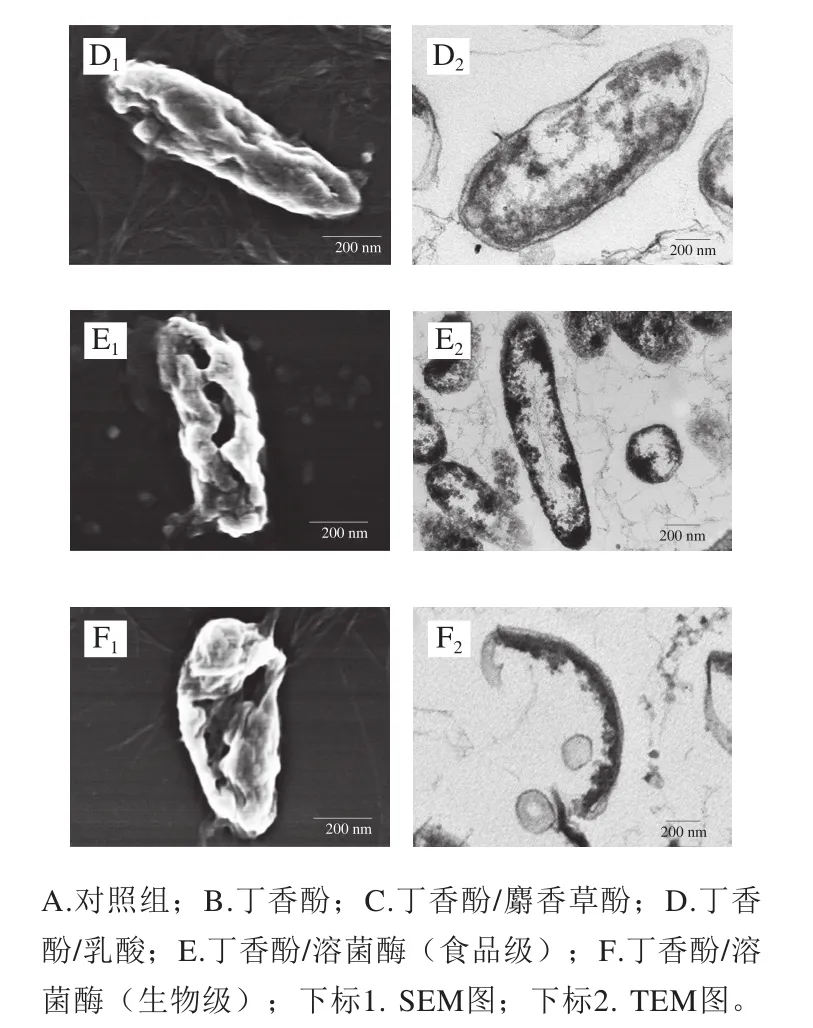
图1 丁香酚复合保鲜剂处理前后腐败希瓦氏菌的SEM和TEM图Fig. 1 SEM and TEM images of S. putrefaciens before and after treatment with eugenol-containing composite preservative
2.3 丁香酚复合保鲜剂对腐败希瓦氏菌细胞膜通透性及完整性的影响
细胞膜是细菌的保护屏障,保鲜剂破坏细菌的细胞膜后,会引起内部电解质如K+、Ca2+、Na+等小分子离子外泄至培养液,导致其电导率上升,因此,菌悬液电导率的变化可以反映细菌细胞膜通透性变化[20]。由图2A可知,随着保鲜剂对腐败希瓦氏菌处理时间的延长,菌悬液的电导率逐渐上升直至趋于平稳。经丁香酚复合保鲜剂处理后,菌悬液的电导率明显高于同期未处理样品。说明丁香酚提高了菌体细胞膜的通透性,导致菌体细胞内电解质泄漏。与单一丁香酚相比,经丁香酚/麝香草酚复合保鲜剂处理的腐败希瓦氏菌菌悬液的电导率略高,说明丁香酚与麝香草酚复配后,对腐败希瓦氏菌细胞膜流动性的破坏能力略有增强,加速了胞内电解质的流失,两者具有协同抗菌作用;而经丁香酚/乳酸复合保鲜剂处理后,腐败希瓦氏菌菌悬液电导率与单一丁香酚处理样品无明显差异。这是由于丁香酚与乳酸复配并作用于菌体后,丁香酚首先破坏细菌外膜的磷脂、糖脂成分,打开离子通道,随后未解离乳酸通过自由扩散由细胞外膜进入菌体内,释放质子,干扰细菌正常代谢,而对细菌细胞膜组分无直接的破坏作用。经丁香酚/溶菌酶复合保鲜剂处理后,腐败希瓦氏菌菌悬液的电导率高于单一丁香酚和丁香酚/麝香草酚处理的样品。这是由于丁香酚与腐败希瓦氏菌细胞壁脂多糖层作用后,使细胞壁肽聚糖层暴露,而后溶菌酶水解暴露于表面的肽聚糖中的β-1,4-糖苷键,因两者具有协同增效作用,加速了细胞内电解质的流失[17]。在处理初期,经丁香酚/溶菌酶(食品级)处理后的腐败希瓦氏菌菌液电导率明显高于丁香酚/溶菌酶(生物级)处理样品,这可能是因为食品级溶菌酶中含有部分其他抗菌剂,发挥了较好的抗菌性能。在处理后期,丁香酚/溶菌酶(生物级)处理的菌悬液电导率最高,这可能是因为丁香酚作用后,使腐败希瓦氏菌细胞壁的肽聚糖层充分暴露,溶菌酶的作用就更加出色。同时,生物级溶菌酶的纯度和酶活性较高,对菌体细胞壁的破坏能力更强。
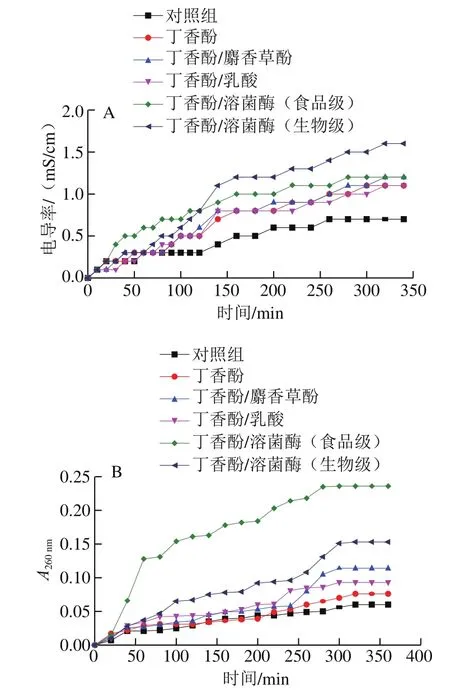
图2 丁香酚复合保鲜剂对腐败希瓦氏菌细胞膜通透性(A)及完整性(B)的影响Fig. 2 Effect of eugenol-containing composite preservatives on cell membrane permeability (A) and cell membrane integrity (B) of S. putrefaciens
通常情况下,细菌细胞膜控制细胞内外物质自由进出,细菌细胞壁膜的微孔道只能透过粒径小于1 nm的分子,而蛋白质和核酸等大分子无法透过细胞壁和细胞膜,在细胞膜遭受损伤后,细胞内的物质极易发生外渗,包括K+、PO43-等小分子物质和DNA、RNA等大分子物质,由于DNA和RNA在260 nm波长处具有很高的摩尔吸光系数,因此被称为260 nm吸收物质,可通过测定260 nm吸收物质吸光度确定细菌细胞膜的完整性[27]。由图2B可见,随着保鲜剂作用时间的延长,腐败希瓦氏菌菌悬液的吸光度逐渐上升。对照组菌悬液的吸光度上升较慢;经丁香酚处理初期,菌悬液的吸光度上升速率增加缓慢,而在200 min后,其上升速率加快,明显高于未处理的腐败希瓦氏菌,说明丁香酚对细菌细胞膜具有一定的破坏能力,但作用于菌体后不能立刻使细胞膜破坏,而作用一定时间后才能破坏菌体细胞膜,使细胞内DNA、RNA等大分子物质流出。采用丁香酚复合保鲜剂处理后,菌悬液的吸光度上升加快,其中丁香酚/溶菌酶(食品级)处理的菌悬液吸光度上升最快,丁香酚/溶菌酶(生物级)和丁香酚/麝香草酚次之,丁香酚/乳酸较慢,但高于单一丁香酚处理的样品,说明麝香草酚、溶菌酶和乳酸与丁香酚复配后对腐败希瓦氏菌细胞膜的破坏能力增强,具有协同破坏能力。经分析认为乳酸以未解离的有机酸分子形式通过自由扩散进入细菌,在细菌体内解离并释放出质子,降低了细菌内的pH值,破坏了细菌内部的酸碱平衡,造成菌体死亡[15]。同时,乳酸解离后,引起细胞内酸性离子增多,增大细菌细胞内的渗透压,导致细菌破裂死亡[28],此外,乳酸解离会使细胞内某些酶钝化或变性,影响细菌体内大分子物质的合成,进而使细菌的生长、繁殖和代谢受到抑制,甚至死亡[29],故丁香酚与乳酸复配后可加速菌体内DNA、RNA等大分子物质流出。同时,乳酸是在丁香酚破坏细胞外膜后才大量进入细胞内部的,所需的作用时间较长,故其菌悬液的吸光度上升较慢。由于丁香酚和麝香草酚复配后可使膜电位差降低,增加细胞膜通透性,打破了菌体原有的保护屏障,从而导致胞内物质的泄漏增加[7,12-13]。因此,采用丁香酚/麝香草酚处理后,腐败希瓦氏菌菌悬液的吸光度高于同期丁香酚处理的样品。而溶菌酶可水解经丁香酚作用后暴露于细菌表面的细胞壁肽聚糖中的β-1,4-糖苷键,增加了对细菌细胞膜的破坏程度,从而导致胞内大分子物质泄漏增加。因此,采用丁香酚/溶菌酶处理后,菌悬液的吸光度较高。又由于食品级溶菌酶中含有其他抑菌剂,对腐败希瓦氏菌膜的损伤能力更大,因此采用丁香酚/溶菌酶(食品级)处理后,菌悬液的吸光度最高。
2.4 丁香酚复合保鲜剂对腐败希瓦氏菌细胞膜损伤程度的影响
当细胞膜遭到损害时,正苯基萘胺能够进入外膜磷脂层,可通过其产生的蓝色荧光评价细菌外膜的损伤程度。由图3A可见,经丁香酚处理后,腐败希瓦氏菌的外膜通透性增加。经丁香酚/麝香草酚和丁香酚/乳酸处理后,菌体的外膜通透性进一步增加,经丁香酚/溶菌酶(食品级)处理后,菌体的外膜通透性低于单一丁香酚处理的样品。而经丁香酚/溶菌酶(生物级)处理后,菌体的外膜通透性增加最显著。分析认为,麝香草酚、乳酸与丁香酚一样具有对细胞膜外膜的破坏能力,且与丁香酚复合后其破坏能力增强。此外,生物级溶菌酶在丁香酚作用后,对细胞膜外膜的破坏能力更强,两者具有协同增效作用。
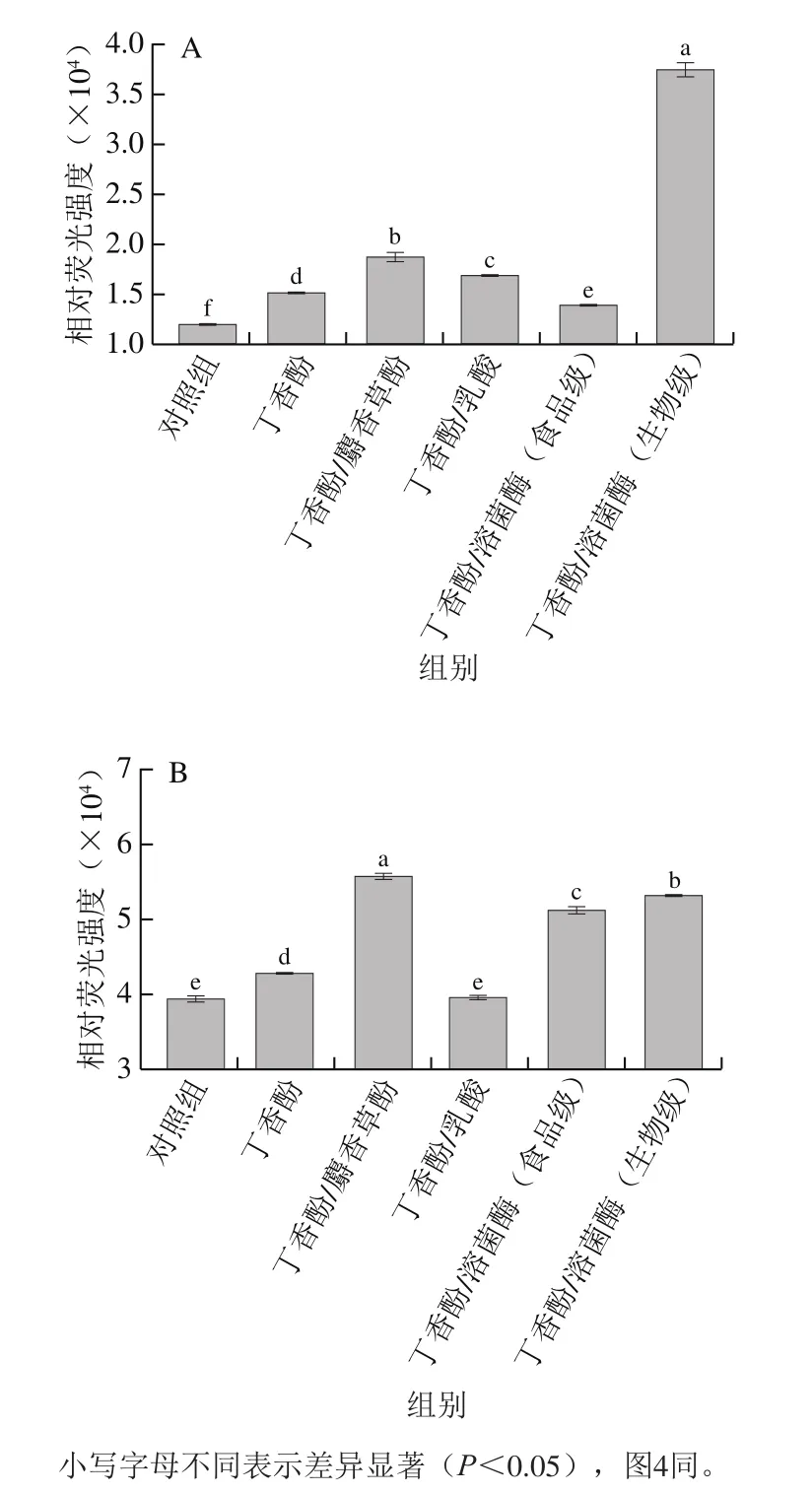
图3 丁香酚复合保鲜剂对腐败希瓦氏菌细胞外膜(A)、内膜(B)通透性的影响Fig. 3 Effect of eugenol-containing composite preservatives on extracellular membrane (A) and intracellular membrane (B) integrity of S. putrefaciens
菌悬液中β-半乳糖苷酶的荧光强度与细菌内膜的破损程度呈正相关。由图3B可见,经丁香酚处理后,腐败希瓦氏菌的内膜被破坏。与丁香酚相比,丁香酚与麝香草酚或溶菌酶复配后,腐败希瓦氏菌的内膜损伤更严重,且丁香酚/麝香草酚对菌体细胞内膜的损伤程度最大。这是由于在麝香草酚的疏水性和亲水性基团共同作用下,对菌体细胞膜的内膜破坏能力更强,且二者发挥了协同增效作用。而丁香酚和溶菌酶在协同破坏细胞外膜之后,两者也会共同作用于细胞内膜,促进了菌体内膜的破坏。用丁香酚/乳酸处理后,对腐败希瓦氏菌内膜的破坏没有显著差异,这可能是由于丁香酚含量较少,且乳酸对细胞内膜无破坏能力。
2.5 丁香酚复合保鲜剂对腐败希瓦氏菌体内Na+、K+-ATPase和AKPase活力的影响
由图4A可见,经丁香酚处理后,腐败希瓦氏菌的Na+、K+-ATPase活力显著降低,说明丁香酚能够降低菌体的Na+、K+-ATPase活力。与丁香酚相比,经丁香酚/麝香草酚和丁香酚/溶菌酶(食品级)处理后,腐败希瓦氏菌的Na+、K+-ATPase活力显著提高,这可能是由于麝香草酚和食品级溶菌酶中的活性抗菌成分主要作用于细菌壁膜,而对菌体Na+、K+-ATPase的活性影响较小。经丁香酚/乳酸和丁香酚/溶菌酶(生物级)处理的腐败希瓦氏菌的Na+、K+-ATPase活力远低于单一丁香酚处理的样品,说明乳酸进入细胞后可作用于Na+、K+-ATPase,使其活性降低。而生物级溶菌酶在丁香酚破坏细胞外膜脂多糖层后,与其协同破坏细胞膜其他组分,使菌体被严重破坏,菌体内的Na+、K+-ATPase失去正常发挥作用的环境,表现出Na+、K+-ATPase活力总体降低。
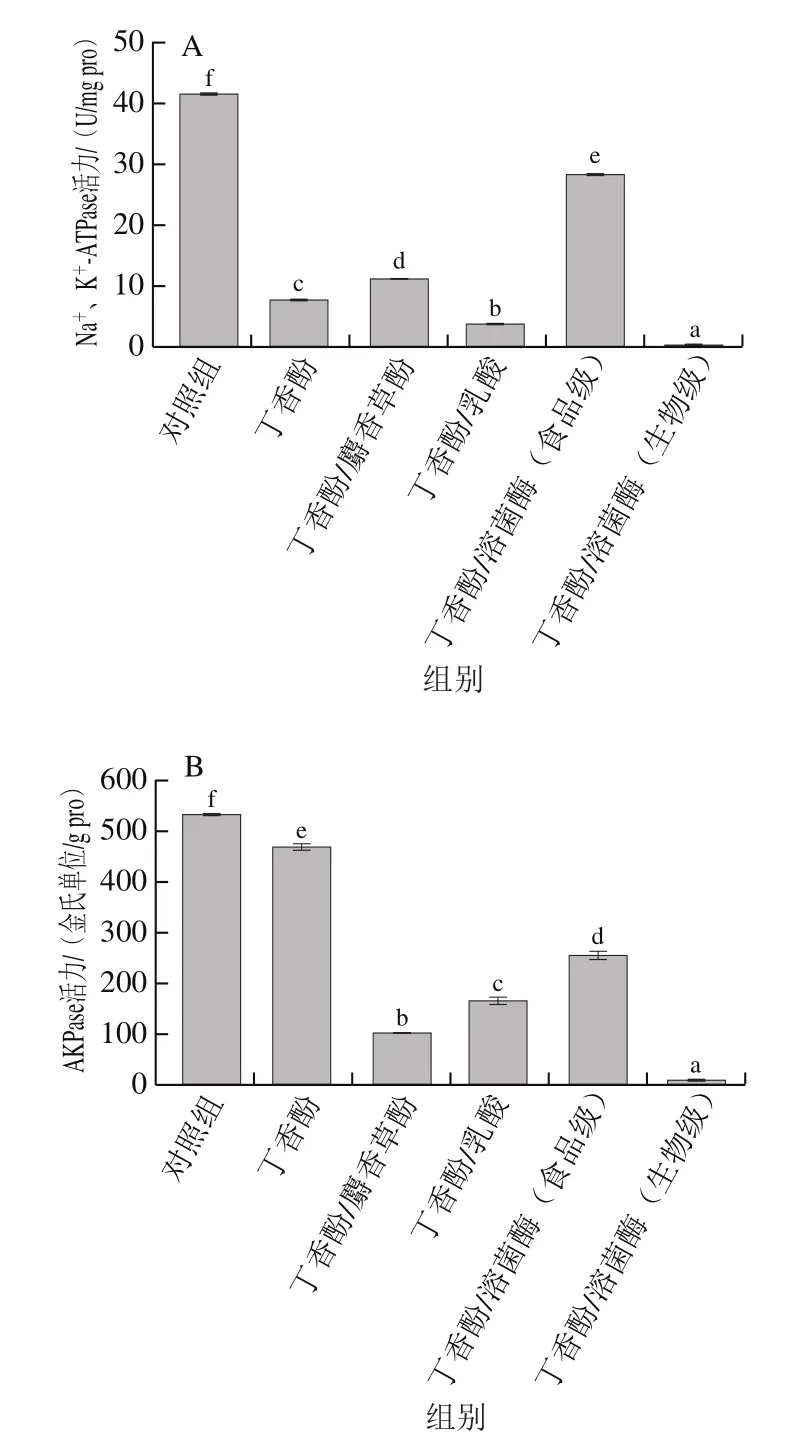
图4 经丁香酚复合保鲜剂处理对腐败希瓦氏菌Na+、K+-ATPase(A)、AKPase(B)活力的影响Fig. 4 Effect of eugenol-containing composite preservatives on Na+,K+-ATPase (A) and AKPase (B) activities of S. putrefaciens
由图4B可见,经丁香酚处理的腐败希瓦氏菌AKPase活力显著降低,说明丁香酚能显著抑制菌体AKPase活性,这与仪淑敏[30]的研究结果相似。分析认为,丁香酚在破坏菌体细胞壁膜后进入内环境,作用于AKPase,降低了AKPase活性,从而抑制了菌体的生长和代谢。与丁香酚相比,丁香酚复合保鲜剂对AKPase活性的抑制能力更强,说明麝香草酚、乳酸和溶菌酶菌与丁香酚存在协同效应,使其对AKPase活性的抑制能力增强。
3 结 论
丁香酚分别与麝香草酚、乳酸和溶菌酶复配后,对腐败希瓦氏菌均具有协同抗菌作用,使菌体结构损伤加剧。丁香酚及其复合保鲜剂对菌体的作用机制略有不同。丁香酚与溶菌酶(生物级)复配后,对细胞质膜的破坏能力最大。丁香酚与乳酸复配后,对Na+、K+-ATPase活力的抑制更加显著。丁香酚与不同级别溶菌酶复配后,可严重破坏细胞膜完整性,显著增加细胞膜通透性。而由于两种级别溶菌酶的纯度和酶活性存在差异,丁香酚/溶菌酶(生物级)复合保鲜剂可显著增加细菌内、外膜的通透性,且对Na+、K+-ATPase、AKPase活性的抑制作用最强,而丁香酚/溶菌酶(食品级)复合保鲜剂主要增加细胞内膜通透性,而对细胞外膜通透性的影响较弱。本实验研究了丁香酚复合保鲜剂对水产品优势腐败菌——腐败希瓦氏菌的抗菌性能,并阐明了其抗菌机理,可为提高丁香酚复合保鲜剂的性能并减少其使用量、降低生产成本提供参考。本研究结果可广泛应用于水产品保鲜方面,具有广阔的市场前景。
