血清25羟维生素D与2型糖尿病周围神经病变的相关性
2021-07-29杨晓瑞
杨晓瑞 ,向 茜 ,邱 娅 ,栾 艳 ,张 弦 ,郭 燕
(1)昆明医科大学第五附属医院/红河州滇南中心医院内分泌科;2)神经电生理室;3)科教科,云南 个旧 661000)
近年来,随着人们生活方式的改变、人口老龄化的增加,糖尿病(diabetes mellitus,DM)患病率不断上升,与此同时,DM并发症的患病率也随之增加[1]。糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)作为DM最常见的微血管并发症之一,是导致DM患者发生足部溃疡和截肢的常见原因[2]。严重影响患者的生活质量,给患者家庭和社会带来沉重的经济负担。DPN的发病机制较为复杂,研究认为DPN是糖脂代谢紊乱、微血管病变、氧化应激、胰岛素抵抗、生长因子缺乏、免疫机制等多种因素共同作用的结果[3]。
维生素D作为一种类固醇激素,除调节钙磷代谢外,还可维持血糖稳态、促进胰岛素分泌、改善胰岛素抵抗、抑制炎症反应、改善血管内皮功能、抗氧化应激[4]。近年来,维生素D与2型糖尿病(type 2 diabetes mellitus,T2DM)微血管并发症的相关性受到业内学者广泛的关注。李冬梅等[5]研究发现,维生素D缺乏是T2DM肾病的独立危险因素,并且其水平与尿白蛋白排泄率呈负相关(r=-1.783,P<0.001)。He等[6]研究发现维生素D缺乏是糖尿病视网膜病变的独立危险因素。然而,目前维生素D与DPN的相关性研究相对较少,且结论尚不统一。本文探讨T2DM患者血清25羟维生素D[25-HydroxyitaminD,25(OH)D]与DPN的相关性,旨在为DPN的防治提供新的线索和方法。
1 资料与方法
1.1 研究对象
选取2015年01月至2019年12月昆明医科大学第五附属医院内分泌科就诊的40岁以上的汉族T2DM患者138例,所有患者均符合根据1999年WHO糖尿病诊断标准[7]。DPN的诊断标准:(1)明确的糖尿病病史;(2)存在周围神经病变的临床症状/体征和(或)电生理的证据;(3)排除导致周围神经病变的其他原因[8]。按是否合并DPN分为单纯糖尿病组(SDM组)47例和DPN组91例,根据临床症状进一步将DPN组分为DPN1组(无临床症状且体格检查正常,神经传导检查异常)和DPN2组(有临床症状,且体格检查和/或神经传导检查异常)。排除标准:1型糖尿病、特殊类型糖尿病及妊娠糖尿病;近3月内补充维生素D制剂或有代谢性骨病史;心、肝、肾功能不全;其他原因引起的周围神经病变:慢性炎性脱髓鞘性多发性神经根周围神经病、营养缺乏、中毒、异常球蛋白血症、甲状腺功能减退、恶性肿瘤、结缔组织病、感染性疾病以及遗传病等[8]。本研究经昆明医科大学第五附属医院伦理委员会审批,均完成知情同意。
1.2 资料收集
1.2.1 一般资料收集所有研究对象的性别、年龄、就诊季节、糖尿病病程、吸烟史、血压、身高、体重、体重指数(Body Mass Index,BMI);对所有患者进行足部触压觉(10 g尼龙丝)、温度觉、痛觉、振动觉、踝反射等体格检查。
1.2.2 实验室检查资料所有患者禁食8~12 h,次日早晨8点空腹取肘静脉血,应用美国BECKMAN COULTER AU5800全自动生化分析仪检测血钙(serum calcium,Ca)、血磷(serium phosphorus,P)、高密度脂蛋白胆固醇(high density lipoproteinc cholesterol,HDL-C)、低密度脂蛋白胆固 醇(low density lipoprotein cholesterol,LDL-C)、总胆固醇(total cholesterolemia,TC)、三酰甘油酯(triglyceride,TG)、血尿酸(serum uric acid,SUA)、血尿素氮(blood usea nitrogen,BUN)、血肌酐(serum creatinine,Scr)、空腹血糖(fasting plasma glucose,FPG)、餐后2 h血糖(2 hours postprandial glucose,2 h PG)、尿微量白蛋白(urine microalbumin,UMA)等临床生化指标;测定尿白蛋白与肌酐比(urinary albumin creatinine ratio,UACR);采用罗氏cobas c 111分析仪测定糖化血红蛋白(glycosylated hemoglobinA1C,HbA1c);采用德国LIAISON全自动化学发光免疫分析仪检测空腹C肽(Fasting c-peptide,FC)。采用意大利索灵诊断医疗设备集团公司全自动免疫化学发光分析仪及其配套试剂测定血清25(OH)D。
1.2.3 神经电生理检查应用丹麦Dantec KEYPOINT型肌电图诱发电位仪,由专人在室温25 ℃条件下,患者皮肤温度保持在32 ℃以上,测定双侧正中神经、尺神经、胫神经、腓神经运动传导速度(moter conduction velocity,MCV)、感觉传导速度(sensory conduction velocity,SCV)。
1.3 统计学处理
应用SPSS22.0统计软件进行统计学分析,所有指标进行正态性检验,连续性变量符合正态分布以均数±标准差()表示,多组间比较用单因素方差分析,偏态分布的连续性变量以中位数M(P25,P75)表示,组间比较用非参数检验,率的比较用χ2检验,血清25(OH)D与其他变量之间的关系采用Spearman相关分析,应用二元Logistic回归分析DPN发生的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料及各项临床生化指标比较
所有住院T2DM患者血清 25(OH)D平均为16.25(12.88,19.90)ng/mL。
3组资料在性别、吸烟史、年龄、DM病程、FPG、2 h PG、HbA1c、BUN间有统计学差异(P<0.05),在就诊季节、SBP、DBP、BMI、25(OH)D、Ca、P、FC、TC、TG、HDL-C、LDL-C、SUA、SCr、UMA、UACR间无统计学差异(P>0.05),见表1。
表1 3组一般资料比较及各项临床生化指标比较[/n(%)]Tab.1 Comparison of clinical and biochemical data among three groups [/n(%)]

表1 3组一般资料比较及各项临床生化指标比较[/n(%)]Tab.1 Comparison of clinical and biochemical data among three groups [/n(%)]
与SDM相比,#P<0.05;与DPN1相比,△P<0.05,*P<0.05。
2.2 3组25(OH)D状态比较
138例T2DM患者中25(OH)D缺乏、不足、充足的比例分别为76.09%(105/138)、21.01%(29/138)、2.90%(4/138),25(OH)D 缺乏的比例在DPN2组最高,不足及充足的比例在SDM组最高,但组间比较差异无统计学意义(P>0.05),见表2。

表2 3组25(OH)D状态比较[n(%)]Tab.2 Comparison of 25(OH)D status among three groups [n(%)]
2.3 Spearman相关性分析
在所有T2DM患者中,25(OH)D与FPG、2 hPG、HbA1c呈负相关(P<0.05),与右正中神经MCV及SCV、左正中神经SCV、左尺神经SCV、左胫神经SCV呈正相关(P<0.05),见表3。在DPN患者中,25(OH)D与SBP、FPG、HbA1c呈负相关(P<0.05),与右正中神经MCV、左正中神经SCV、右尺神经MCV及SCV、左尺神经SCV呈正相关(P<0.05),见表4。

表3 T2DM患者中25(OH)D 与各个指标的Spearman相关性分析Tab.3 Spearman's correlation analysis of 25(OH)D and other index in T2DM
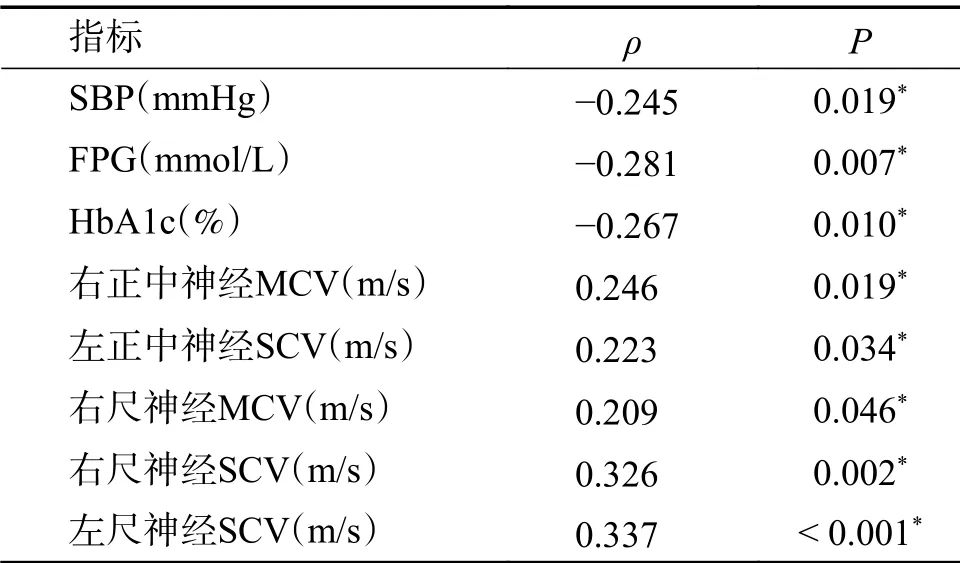
表4 DPN患者中25(OH)D 与各个指标的Spearman相关性分析Tab.4 Spearman's correlation analysis of 25(OH)D and other index in DPN
2.4 DPN发生的危险因素分析
138例T2DM患者中,以是否发生DPN(无=0,有=1)为因变量,以性别、年龄、就诊季节、DM病程、吸烟史、SBP、DBP、BMI、25(OH)D、Ca、P、FPG、2 h PG、HbA1c、FC、血脂、SUA、BUN、SCr、UMA、UACR作为自变量进行多因素logistic回归分析,结果显示,25(OH)D是DPN的保护因素(P<0.05),吸烟史、年龄≥65岁、2 h PG≥10 mmol/L、高尿酸血症(hyperuricemia,HUA)是DPN发生的危险因素(P<0.05),见表5。
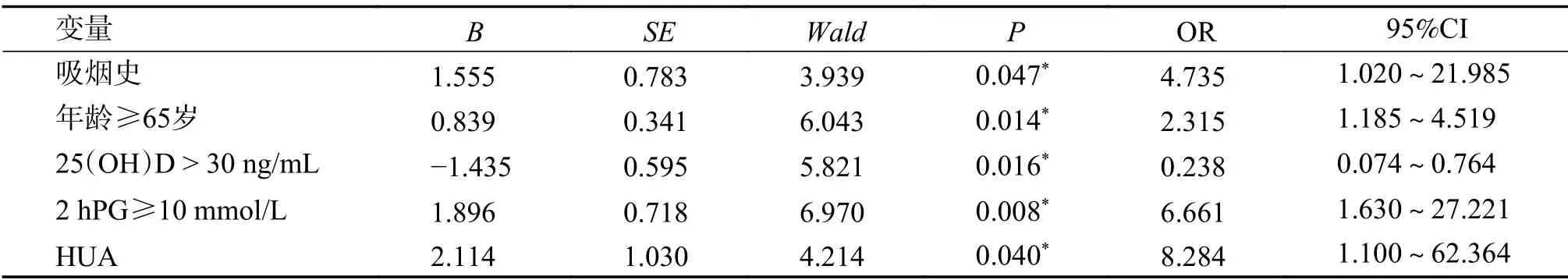
表5 138例T2DM患者DPN发生危险因素的Logistic回归分析Tab.5 The Logistic regression analysis of risk factors related to DPN occurrence in 138 patients with T2DM
3 讨论
目前,维生素D缺乏是一个全球性的健康问题,影响了大约10亿人口[9]。人体内的维生素D主要是维生素D3,大部分来源于皮肤7-脱氢胆固醇,经紫外线(290~315 nm)照射后合成,小部分来源于油性鱼、蛋黄、乳制品等食物。维生素D3进入血液后,在肝脏25-羟化酶作用下转变为25(OH)D,后者作为维生素D在血液循环中的主要形式,稳定性好、半衰期长,因此临床上常测定血清25(OH)D水平来评价维生素D营养状况[10]。
既往研究发现25(OH)D水平与T2DM发病率呈负相关,并且这种相关性不受性别、研究规模、随访时间、诊断标准和25(OH)D测量方法的影响[11]。维生素D可直接与胰岛β细胞上的维生素D受体(Vitamin D receptor,VDR)结合,激活胰岛素转录基因,促进胰岛素分泌[12]。还可间接调节胰岛β细胞中Ca2+浓度来影响胰岛素分泌和释放[13]。本研究138例T2DM患者血清25(OH)D总体水平为16.25(12.88,19.90)ng/mL,不足/缺乏的比例高达97.10%,25(OH)D水平与FPG、2 h PG、HbA1c呈负相关(P<0.05),提示T2DM患者普遍存在维生素D不足/缺乏,与既往研究结果类似[14]。分析原因可能为:(1)研究对象年龄相对较大,皮肤合成维生素D能力下降,且暴露于紫外线辐射较少,其来自皮肤后合成的内源性维生素D减少;(2)多数DM患者低脂饮食,且山区居民缺乏深海鱼类等富含维生素D饮食,外源性维生素D摄入相对较少;(3)维生素D不足/缺乏与T2DM患者血糖控制不佳有关,与既往研究结果类同[15]。
Alamdari等[16]发现,DPN患者血清25(OH)D更低,低水平25(OH)D可能导致T2DM患者发生大纤维神经病变的风险增加。本研究T2DM患者25(OH)D水平普遍存在维生素不足/缺乏。虽然SDM组与DPN1组、DPN2组患者25(OH)D水平及25(OH)D缺乏、不足的比例组间未出现统计学差异(P>0.05),但与SDM组相比,DPN组患者25(OH)D水平有下降趋势,且DPN2组较DPN1组下降趋势更为明显(P>0.05)。校正性别、年龄后,多因素回归分析显示充足的25(OH)D是DPN的保护因素(OR=0.238,P<0.05)。维生素D可能通过某些途径参与DPN的发生:(1)影响糖代谢:维生素D可增加胰岛素对葡萄糖刺激的反应,诱导新合成的胰岛素原向胰岛素转化,而不影响基础胰岛素的分泌[17];(2)改善微血管病变:维生素D可通过抑制肾素基因转录和血管紧张素原基因的表达改善微血管病变[18];(3)抗炎、抗氧化应激:维生素D可负向调控白介素-6、肿瘤坏死因子-α等炎症因子的表达,抑制内源性免疫反应而发挥抗炎作用[19];还能抑制诱导型一氧化氮合酶表达,减少一氧化氮产生,减轻神经毒性作用[20];(4)参与神经营养因子:维生素D直接参与神经营养因子、神经生长因子、胶质细胞源性神经营养因子的合成,此类物质在神经细胞生长、成熟、分化和修复等方面具有保护和免疫调节作用[21]。以上可能是本研究25(OH)D不足或缺乏趋势较为明显的DPN2组患者较DPN1组患者FPG及HbA1c相对较低,而2 h PG较高的可能原因。由于DPN患者临床特点复杂,其发生可能是包含维生素D水平在内的多因素共同作用的结果,在DPN发生、发展的不同阶段,维生素D交互作用影响的大小可能也不尽相同。
综上所述,血清25(OH)D在T2DM患者中普遍较低,DPN组较SDM组有降低趋势。多因素logistic回归分析提示25(OH)D>30 ng/mL是DPN发生的保护因素,吸烟史、年龄≥65岁、2 h PG≥10 mmol/L、HUA为DPN发生的危险因素,提示DPN发生是以上多因素交互作用,相互影响的结果。在DM的临床治疗中,除积极调控血糖外,还需兼顾改善不良嗜好及生活习惯,尽早戒烟,减少被动吸烟,避免高脂、高嘌呤饮食过多摄入,合理降压、调脂,定期筛查DM相关并发症,尽早规范化干预并控制达标。充足的25(OH)D可能是DPN发生的保护因素,但目前维生素D干预治疗对DPN患者治疗和预后研究较少,结果普遍缺乏一致性,这可能是由于研究方法、纳入标准、受试者人群、干预时间、维生素D补充形式及随访时间存在异质性。未来需大量的前瞻性、安慰剂对照、随机干预研究来确定维生素D对DPN的保护作用。
