近红外光响应性多烯紫杉醇主动靶向脂质体的制备及其体外抗肿瘤活性*
2021-07-29祝侠丽李玲华王莎莎王白燕关延彬贾永艳
祝侠丽,李玲华,王莎莎,王白燕,关延彬,贾永艳
(河南中医药大学 1.药学院;2.基础医学院,郑州 450046)
脂质体(liposomes,Lip)具有靶向性、良好的生物相容性和生物可降解性[1],被认为是目前最成熟与最具前景的纳米递药系统[2]。但是,如何提高脂质体的肿瘤靶向效率,确保药物在肿瘤细胞内的有效浓度仍是目前研究的重点[3]。研究证明,以甘草次酸(glycyrrhetinic acid,GA)修饰的目标化合物可通过细胞内吞作用与细胞膜上的甘草次酸受体特异性结合进入细胞内而发挥药理作用[4]。肿瘤光热治疗(photothermal therapy,PTT)是在临床上继手术、放射治疗(放疗)和化学治疗(化疗)之后的又一具有很大潜力的肿瘤治疗新手段[5],是目前肿瘤治疗领域研究的热点[6]。本课题以亲水性纳米硫化铜(PVP/CuS)为光敏剂,GA为肿瘤靶向分子,多烯紫杉醇(DTX)为模型药物,制备近红外光响应性多烯紫杉醇主动靶向脂质体(GA-DTX-PVP/CuS-Lip),并对其理化性质、体外释药特性及抗肿瘤活性等进行研究。
1 仪器与试药
1.1仪器 BSA224S-CW型天平(感量:0.1 mg,赛多利斯科学仪器有限公司);N-1100-OSB-2100型旋转蒸发仪(上海爱郎仪器有限公司);92-llN型超声波细胞粉碎机(宁波新芝生物科技股份有限公司);Waters e2695高效液相色谱仪(美国Waters公司,Nano-ZS90电位及粒度分析仪(英国Malvern公司);JEM-1400型透射电镜(日本电子);MW-GX-808/3000mW型激光器(中国科学院长春激光所);SHA-C型水浴振荡器(巩义市予华仪器有限责任公司);E191型细胞培养箱(美国Corning公司);CKX41型倒置显微镜(日本Olympus公司);22331 Hamburg小型台式高速冷冻离心机(德国艾本德股份公司);iMark BIO RAD型酶标仪(北京友华照钦医疗器械有限公司)。
1.2试药 甘草次酸(GA,含量>98%,武汉远成共创科技有限公司,批号:405310);多烯紫杉醇(DTX,含量>98%,上海瀚香生物科技有限公司,批号:C338774);豆磷脂(天津市光夏精细化工研究所,批号:20180417);胆固醇(郑州奇华顿化工产品有限公司,批号:20150527);亲水性纳米硫化铜(PVP/CuS,本课题组制备,批号:20180317);甘珀酸十八醇酯(18-GA-Suc,课题组制备,批号:20190112);RPMI-1640 培养基(上海索莱宝生物科技有限公司,批号:20190124);无噬菌体胎牛血清(北京四季青生物科技有限责任公司,批号:18090506);3-(4,5-二甲噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,美国Sigma公司,批号:298-93-1);细胞培养级二甲亚砜(DMSO,北京鼎国昌盛生物科技有限公司,批号:8A800160);甲醇、乙腈、聚山梨酯-80、超纯水等均为分析纯。
1.3细胞 SMMC-7721人肝癌细胞(中国科学院细胞库)。
2 方法与结果
2.1GA-DTX-PVP/CuS-Lip的制备与表征 本实验采用薄膜分散法制备近红外光响应性多烯紫杉醇主动靶向脂质体[7],具体步骤如下:精密称取磷脂、胆固醇、18-GA-Suc和DTX置于250 mL茄形瓶中,加入氯仿10 mL使其全部溶解。40 ℃下旋转减压蒸发以除去有机溶剂,至形成均匀的薄膜。然后加入PVP/CuS的pH值7.4的磷酸盐缓冲液(PBS)5 mL,超声(功率500 W,频率40 KHz)水合15 min,后再探头超声处理60 s(功率250 W,频率25 KHz)每次超声3 s,间歇3 s,即得近红外光响应性多烯紫杉醇主动靶向脂质体。
2.2GA-DOX-PVP/CuS-Lip的表征
2.2.1分散性及形态观察 采用透射电镜(TEM)法观察GA-DTX-PVP/CuS-Lip的微观形态,具体方法如下[8]:取适量空白脂质体、GA-DTX-PVP/CuS-Lip,加纯化水探超1 min。经稀释10倍后,取适量滴至TEM 专用铜网上,用3%磷钨酸染色2 min,自然干燥。然后置于透射电镜下观察,并记录结果(图1)。
由图1-A可见,GA-PVP/CuS-Lip(左)和GA-DTX-PVP/CuS-Lip(右)水分散性及稳定性良好。由图1-B和图1-C可见,GA-PVP/CuS-Lip和GA-DTX-PVP/ CuS-Lip均呈圆球形结构,大小较为均匀,平均粒径约200 nm。
2.2.2粒径及电位 分别取空白脂质体GA-PVP/CuS-Lip、GA-DTX-PVP/CuS-Lip适量,用超纯水稀释后[9],采用Nano-ZS90型电位及粒度分析仪测其粒径和电位,结果见图2。
由图2A-B所知,GA-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip的平均粒径分别为(114.3±0.35) nm 和(226.7±0.17)nm。由图2A-B所知,GA-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip的平均Zeta电位分别为(-13.8±0.27)mV和(-4.05±0.57)mV。结果表明制备的GA-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip稳定性良好。
2.2.3包封率和载药量 采用超滤离心法测定GA-DTX-PVP/CuS-Lip的包封率,具体操作如下[10]:将GA-DTX-PVP/CuS-Lip置于超滤管(截留相对分子质量30 000),5000 r·min-1离心15 min,HPLC法测定滤液中游离药物量,记为W游。高效液相色谱(HPLC)条件如下[11],色谱柱:Venusil XBP C18(4.6 mm×250 mm,5 μm),检测波长:230 nm;流动相:乙腈-水(50:50),流速:1 mL·min-1;柱温:25 ℃;进样量:10 μL。GA-DTX-PVP/CuS-Lip中总的药量记为W总,载体GA-PVP/CuS-Lip的质量记为W载体。按照下列公式计算包封率和载药量:包封率(%) =[(W总-W游)/W总]×100%;载药量 (%) =[(W总-W游)/(W总+W载体)]×100%。测定结果显示GA-DTX-PVP/CuS-Lip的包封率和载药量分别为(96.33±0.21)%和(6.63±0.39)%。
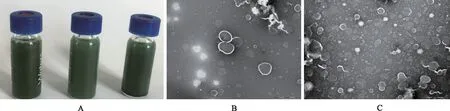
A.GA-PVP/CuS-Lip(左)和GA-DTX-PVP/CuS-Lip(右)的外观照片;B.GA-PVP/CuS-Lip的透射电镜照片;C.GA-DTX-PVP/CuS-Lip的透射电镜照片。
图1 不同制剂的外观照片及透射电镜照片(×25 000)
A.The appearance of GA-PVP/CuS-Lip (left) and GA-DTX-PVP/CuS-Lip (right);B.TEM photo of GA-PVP/CuS-Lip;C.TEM photo of GA-DTX-PVP/CuS-Lip.
Fig.1 The appearance and TEM photos of different preparations(×25 000)

A-B.GA-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip 粒径分布图;C-D.GA-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip 电位分布图。
2.3GA-DOX-PVP/CuS-Lip的光热转换试验 取所制备的GA-DTX-PVP/CuS-Lip,用超纯水稀释成药物浓度分别为0.1,0.3,0.5 mg·mL-1的溶液,分别取出3 mL置于样品池中[12],采用808 nm[2.50 W·(cm2)-1]的激光照射,每0.5 min记录一次温度。同时设纯化水为空白对照组。以时间作为横坐标,温度作为纵坐标来绘制光热转换曲线,如图3所示。
由图3可知,与纯化水比较,GA-DTX-PVP/CuS-Lip的温度随时间的延长而明显上升,且浓度越大,温度上升越快,说明GA-DTX-PVP/CuS-Lip具有浓度时间依赖性的光热转换特性。
2.4GA-DOX-PVP/CuS-Lip的体外释放度试验 采用透析法进行GA-DTX-PVP/CuS-Lip的体外释放度试验,具体方法如下[13]:精密量取DTX溶液或GA-DTX-PVP/CuS-Lip 1 mL,分别置于透析袋(截留相对分子质量3000)中,进行释放度试验。释放介质为pH值7.4的PBS 50 mL(含0.5%聚山梨酯-80),转速100 r·min-1,温度37 ℃或45 ℃,取样点0.5,1,2,4,6,8,12,24,48 h,取样体积0.5 mL,每次取样后及时补充同温同体积的空白介质。HPLC法测定样品中的药物浓度,计算累积释放百分率,以时间为横坐标,累积释放百分率为纵坐标绘制释药曲线。
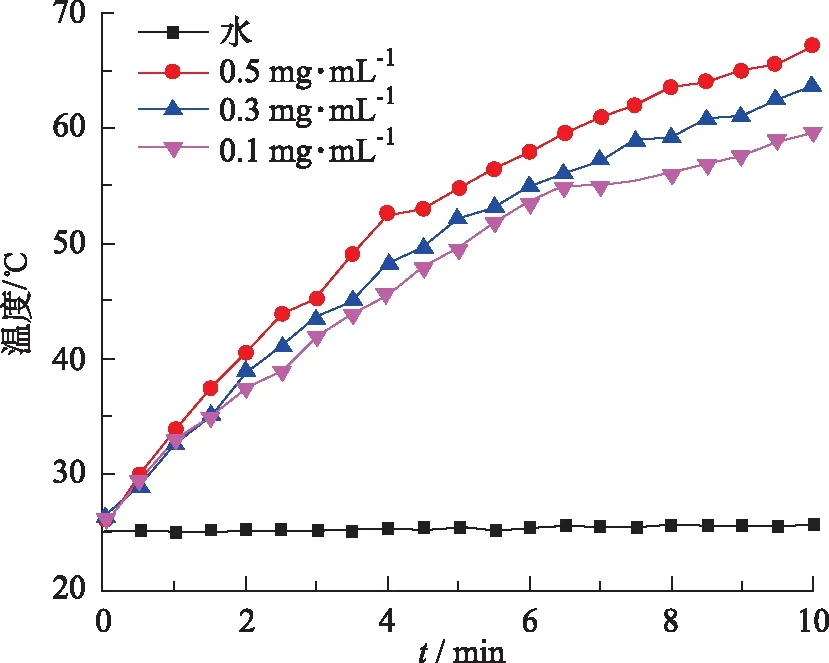
图3 GA-DTX-PVP/CuS-Lip的光热转换曲线
由图4-A可见,37 ℃条件下,DTX溶液释药速度较快,12 h时累积释放百分率已达到98.56%;DTX-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip释药速度较为缓慢,12 h的累积释放百分率分别为23.63%和28.94%。表明与DTX溶液比较,DTX-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip均具有明显的缓释作用。数学模型拟合结果显示DTX-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip 均符合 Korsmeyer-Peppas模型,相关系数r分别为0.959 1和0.992 7。
由图4-B可见,DTX-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip在45 ℃释放速度高于37 ℃释放速度。如24 h,DTX-PVP/CuS-Lip在37 ℃和45 ℃累积释放百分率分别为33.49%和57.47%,GA-DTX-PVP/CuS-Lip在37 ℃和45 ℃累积释放百分率分别为35.41%和51.29%。说明高温可促进DTX-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip中药物的释放。可为其结合近红外光照射进行肿瘤光热化联合治疗提供一定的理论基础。
2.5GA-DTX-PVP/CuS-Lip的细胞抑制率试验 选择SMMC-7721肝癌细胞作为细胞模型,采用MTT法测定不同浓度空白载体GA-PVP/CuS-Lip、DTX 溶液、DTX-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip对细胞生长的影响[14]。将处于对数期的SMMC-7721细胞接种到96孔板(每孔8×103个),置于37 ℃、5%二氧化碳(CO2)培养箱中培养24 h。
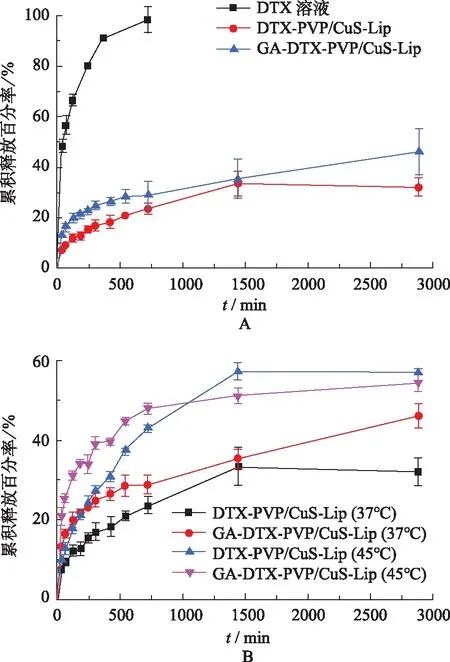
A.37 ℃下的释药曲线;B.37 ℃和45 ℃下的释药曲线。
每孔加入50,25,10,0.5 μg·mL-1GA-PVP/CuS-Lip或100,50,20,1 μg·mL-1DTX-PVP/CuS-Lip、GA-DTX-PVP/CuS-Lip 200 μL,每个浓度设6个复孔,激光组加药后立即用808 nm激光[2.5 W·(cm2)-1]照射3 min[15],空白对照组加培养基。继续培养24,48或72 h,每孔加5 mg·mL-1MTT溶液20 μL,继续培养4 h,弃去培养液,每孔加DMSO 150 μL,置摇床上振荡10 min。然后用酶标仪在490 nm处测量吸光度(A值)。按照下列公式计算细胞存活率和细胞抑制率[16]:细胞存活率(%) =(实验组A值/空白组A值)×100%;细胞抑制率(%) =[(实验组A值-空白组A值)/空白组A值]×100%。
不同制剂组孵育24 h对SMMC-7721细胞生长活性的影响如图5所示。
由图5-A可知,随着GA-PVP/CuS-Lip空白载体的浓度增加,SMMC-7721细胞的生存率呈降低趋势。但是当其中PVP/CuS浓度在10 μg·mL-1以下时,对SMMC-7721细胞生长的影响较小。由图5-B可知,GA-DTX-PVP/CuS-Lip浓度越高,对SMMC-7721细胞的生长抑制作用越强(P<0.01),同时各浓度结合808 nm激光照射后对SMMC-7721细胞的生长抑制作用增强。

图5 GA-PVP/CuS-Lip(A)和GA-DTX-PVP/CuS-Lip(B)孵育24 h后对SMMC-7721细胞生长的影响(n=6)
另外,DTX 溶液、DTX-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip孵育24,48或72 h对SMMC-7721细胞生长的影响如图6所示。
由图6-A(24 h)和图6-B(48 h)可知,相同浓度下,GA-DTX-PVP/CuS-Lip组SMMC-7721的细胞抑制率均高于DTX溶液(P<0.01),表明将DTX制成GA-DTX-PVP/CuS-Lip可增加其对SMMC-7721细胞的生长抑制作用。图6-C为DTX-PVP/ CuS-Lip和GA-DTX-PVP/CuS-Lip孵育72 h 时的细胞抑制率,由图6-
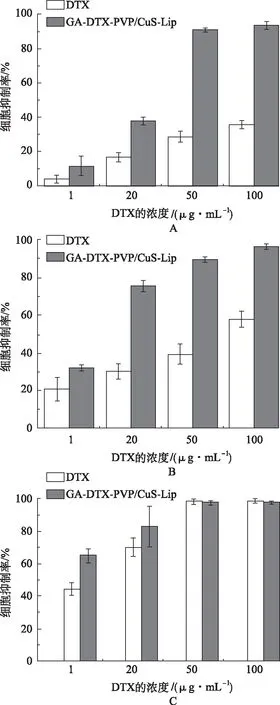
A.24 h;B.48 h;C.72 h。
C可见,当DTX浓度为1 μg·mL-1和20 μg·mL-1时,GA-DTX-PVP/CuS-Lip组对SMMC-7721细胞的抑制率高于DTX-PVP/CuS-Lip组(P<0.01),表明相对于DTX-PVP/CuS-Lip普通靶向制剂,GA-DTX-PVP/CuS-Lip主动靶向制剂对SMMC-7721细胞的生长抑制作用更强。当DTX浓度为50和100 μg·mL-1时,DTX-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip两组的细胞抑制率差异无统计学意义(P>0.05),均接近于100%。
3 讨论
本实验以亲水性PVP/CuS为光敏剂,GA为肿瘤靶向分子,DTX为模型药物,采用薄膜分散法制备了近红外光响应性多烯紫杉醇主动靶向脂质体(GA-DTX-PVP/CuS-Lip)。透射电镜下观察到GA-DTX-PVP/CuS-Lip为类圆球形结构,平均粒径和电位分别为(226.73± 0.17)nm 和(-4.05±0.57)mV,包封率和载药量分别为(96.33±0.21)%和(6.63±0.39)%,符合纳米制剂设计要求。结合808 nm激光照射进行了光热转换实验,结果显示GA-DTX-PVP/CuS-Lip具有浓度时间依赖性的光热转换特性。
GA-DTX-PVP/CuS-Lip的体外释放度试验中,进行了37 ℃和45 ℃两个温度的释放度试验,分别模拟人体生理环境和结合外加热条件下制剂的释药特性。实验结果显示,与DTX溶液比较,GA-DTX-PVP/CuS-Lip具有明显的缓释特征,45 ℃时释药速度明显高于37 ℃释药速度。表明GA-DTX-PVP/CuS-Lip给药后结合局部高温可促进其中药物的释放。因DTX水溶性较差,参考文献[17],选择含有0.5%聚山梨酯-80的磷酸盐缓冲液(pH值7.4)为释放介质。
GA-DTX-PVP/CuS-Lip的体外细胞抑制率试验中,除进行了GA-PVP/CuS-Lip空白载体对SMMC-7721细胞毒性试验以外,还设计进行不同实验组不同浓度下的试验,并作两两对比分析[18]。如DTX溶液组和GA-DTX-PVP/CuS-Lip制剂组,GA-DTX-PVP/CuS-Lip和GA-DTX-PVP/CuS-Lip+激光组,DTX-PVP/CuS-Lip普通制剂组和GA-DTX-PVP/CuS-Lip 主动靶向制剂组。实验结果显示,与DTX溶液比较,GA-DTX-PVP/CuS-Lip具有较强的细胞抑制作用,并具有浓度和时间依赖性。结合808 nm激光照射,GA-DTX-PVP/CuS-Lip对SMMC-7721细胞的抑制率增高。综上,本实验制备的GA-DTX-PVP/CuS-Lip 的工艺稳定、可行,可为进一步进行肿瘤光热化联合治疗提供一定的理论依据。
