circZBTB44通过调控AKT通路促进肾透明细胞癌增殖和迁移的研究
2021-07-29钟启宇谢文练
钟启宇,谢文练
肾细胞癌(renal cell carcinoma,RCC),简称肾 癌,是泌尿系统最常见的恶性肿瘤之一,其全球发病病例数约占成人恶性肿瘤新发病例数的4%,且发病率和死亡率均不断上升[1]。在肾癌中,肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是最常见的病理类型,病例数约占肾癌病例的75%[2]。肾癌多为偶发,临床症状不明显,有高达17%的肾癌患者在初次就诊时便已发生远处转移[3]。肾癌对放、化疗均不敏感,手术是目前治疗局限性肾癌和局部进展性肾癌的主要方法[3,4],但仍有近30%的肾癌患者在术后再次出现肿瘤复发和转移[5]。因此,深入探究肾癌发生、发展的相关关键分子,并挖掘相关作用机制,对临床上肾癌的治疗具有十分重要的科学意义。
环状RNA(circular RNAs,circRNAs)是一类广泛存在于真核细胞中的内源性共价闭合环状的非编码RNA。circRNAs表达丰富,广泛存在于细胞、组织、体液中,其半衰期长、结构稳定、耐RNA酶,是较为理想的生物标志物[6,7]。研究发现,circRNAs在多种人类肿瘤中异常表达,环上富含miRNA结合位点、蛋白结合位点、开放阅读框等,可通过作为miRNAs吸附海绵、结合RNA相关蛋白、编码相关蛋白等方式,调控基因表达,在肿瘤发生、发展中起着重要调控作用[8]。
目前虽已有部分研究发现circRNAs在ccRCC中异常表达,并在ccRCC的增殖、迁移和侵袭中发挥着一定作用[6-9]。但circRNAs在ccRCC中的研究仍较少,有待进一步探索。本研究对GEO数据库circRNA芯片数据表达谱进行差异分析,筛选出在ccRCC组织中高表达的circRNA circZBTB44,进一步探究circZBTB44在ccRCC中的表达情况,鉴定相关特征,探究其生物学功能,探索可能的分子机制,希望能为ccRCC的诊断和治疗提供新的生物标志物和治疗靶点。
1 材料与方法
1.1 肾透明细胞癌组织标本
31对肾透明细胞癌组织和配对癌旁组织标本均取自2018年至2020年于中山大学孙逸仙纪念医院接受手术的肾透明细胞癌患者,患者术前均未行化疗或放疗。患者组织的收集与使用均已从每个患者处获得其书面知情同意。所有新鲜的组织收集后,立即使用液氮速冻,后续保存在-80°C冰箱。肾透明细胞癌和癌旁组织均经两名病理科医师确认。本研究已得到中山大学孙逸仙纪念医院伦理委员会的审批。
1.2 肾透明细胞癌细胞系的培养
人肾透明细胞癌细胞株786-O、ACHN和正常肾小管上皮细胞细胞株HK-2均购买于美国ATCC细胞库。其中,786-O和ACHN细胞使用PRMI 1640培养基(Gibco)培养,HK-2细胞使用DMEM/F-12K培养基(Gibco)培养。所有细胞均使用完全培养基(含10%胎牛血清(Gibco)和1%青霉素/链霉素(Hyclone)培养于5%CO2的湿润的37℃细胞培养箱,取处于对数生长期的细胞进行实验。
1.3 细胞转染
取处于对数生长期的细胞以1.1×105细胞每孔的密度接种于六孔板中,培养过夜。次日按照说明书的步骤使用Lipofectamine RNAiMax(Invitrogen)将阴性对照和circZBTB44的siRNAs转染至细胞中。转染48 h后可进行下一步功能实验,同时可提取RNA进行qRT-PCR验证转染效率。
1.4 RNA的提取及实时荧光定量PCR(qRT-PCR)
按照说明书的步骤使用RNAiso Plus(Takara)提取标本组织或转染后细胞的总RNA,使用Evo M-MLV RT Premix for qPCR(艾科瑞生物)将总RNA逆转录为cDNA,再使用SYBR®Green Premix Pro Taq HSqPCR Kit(艾科瑞生物)按说明书步骤在荧光定量PCR仪LightCycler96(Roche)上进行qRT-PCR反应得到目的RNA逆转录的cDNA及内参GAPDH的Cq值,通过2-ΔΔCq的方法计算相对表达量。本研究使用的引物由上海捷瑞生物工程有限公司合成,引物序列为:circZBTB44-F:TCCCAGCCTGTCAGTGCATC,circZBTB44-R:GGCTGTGGGAAGAGGAGCTAT;ZBTB44 mRNA-F:CGAGTGCAAAACATGTGGC,ZBTB44 mRNA-R:CACCTCTTGGAATTCATTCTCCG;GAPDH-F:GGAGCGAGATCCCTCCAAAAT,GAPDH-R:GGCTGTTGTCATACTTCTCATGG。
1.5 放线菌素D实验
取处于对数期生长的细胞接种于六孔板中,每孔7×104个细胞,并置于细胞培养箱中培养24 h后,加入含2μg/mL放线菌素D的新鲜完全培养基,分别于处理后的4 h、8 h、12 h、24 h提取细胞RNA,并逆转录,行qRT-PCR法检测放线菌素D处理后,circRNA和mRNA丰度的变化。
1.6 RNase R实验
提取细胞总RNA,按照说明书步骤,将10 U RNase R(20 U/μL,广州吉赛生物)加入到3μg总RNA中,对照组则将等量DEPC水加入到3μg总RNA中,于37℃孵育30 min后逆转录,并进行qRTPCR。
1.7 核浆分离实验
采用PARISTM试剂盒(Invitrogen)按照说明书步骤,取1×107细胞,加入预冷的500μL Cell Fractionation Buffer冰上裂解,并4℃500×g离心5 min,上清即为胞浆裂解液,沉淀物为细胞核沉淀。细胞核沉淀中加入预冷的500μL Cell Disruption Buffer,用力吹打或涡旋振荡使细胞核充分裂解。往胞浆裂解液和胞核裂解液中加入500μL常温的2×Lysis/Binding Solution,充分混匀后分别过吸附柱提取RNA。
1.8 MTS细胞增殖实验
取siRNA转染48 h后的细胞以每孔1×103个细胞接种于96孔板后,放入37℃,5%CO2培养箱中孵育。在孵育0、24、48、72、96和120小时后,加入20μL MTS溶液(CellTiter 96®AQueous One Solution细胞增殖试剂盒,Promega),37℃温箱孵育2 h,使用酶标仪测定490 nm的OD值。根据测得的OD值绘制MTS细胞增殖曲线。
1.9 克隆形成实验
取siRNA转染48 h后的细胞以每孔1×103个细胞接种于六孔板后,放入37℃,5%CO2培养箱中孵育培养约2周,并观察细胞存活状态和克隆形成情况,每3~4天用换液一次,直到菌落清晰可见。使用PBS洗涤细胞后,使用4%多聚甲醛溶液室温固定25 min,再使用0.1%结晶紫溶液室温染色20 min,流水冲洗晾干后对六孔板进行拍照并计数。
1.10 Transwell细胞迁移实验
取siRNA转染48 h后的细胞,用无血清培养基重悬,配成200μL 8×104个细胞,加入到已提前使用无血清培养基润膜的Transwell小室的上室中,下室加入新鲜的完全培养基600μL,放入培养箱培养4 h(786-O)或3 h(ACHN)后,使用4%多聚甲醛溶液室温固定30 min,再使用0.1%结晶紫溶液室温染色25 min,拍照并计数穿过膜的细胞个数。
1.11 蛋白免疫印迹实验
取siRNA转染48 h后的细胞,使用RIPA蛋白裂解液(北京康为世纪)(含1%蛋白酶抑制剂(北京康为世纪)和1%磷酸酶抑制剂(Roche))裂解细胞获得蛋白制品。使用BCA试剂盒(上海碧云天)测定蛋白浓度,加入蛋白上样缓冲液(Invitrogen)混匀后100℃煮沸5 min。使用恒压80 V或120 V进行SDS-PAGE凝胶电泳,使用恒流250 mA转膜,使用5%BSA封闭后,一抗4℃慢摇孵育过夜,二抗室温慢摇孵育1 h后,使用ECL发光液在化学发光成像系统中显影,并保存图片。
1.12 统计分析
所有实验均重复三次,并使用软件SPSS 20.0.0和GraphPad Prism 8.0进行统计分析和作图。数据采用均值±SD表示。两组定量资料之间比较采用独立样本t检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 circZBTB44在肾透明细胞癌组织和细胞株786-O和ACHN中明显高表达
本研究通过对GEO数据库GSE100186数据集(4对肾透明细胞癌和配对癌旁组织)的circRNA芯片数据表达谱进行差异分析,发现circZBTB44(hsa_circ_0002484)在肾透明细胞癌组织中明显高表达。通过提取收集的本院31对肾透明细胞癌组织和配对癌旁组织标本及肾透明细胞癌细胞株786-O和ACHN的总RNA,进行qRT-PCR检测circ-ZBTB44的表达水平,我们发现,相较癌旁组织,circZBTB44在肾透明细胞癌组织中的明显高表达(图1A)。相较永生化的正常肾小管上皮细胞株HK-2细胞,circZBTB44在肾透明细胞癌细胞株786-O和ACHN中明显高表达(图1B),与数据库结果一致。
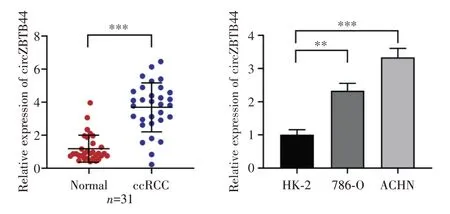
图1 circZBTB44在肾透明细胞癌组织和细胞中明显高表达 A:qRT-PCR法检测31对肾透明细胞癌组织与癌旁组织中circZBTB44的表达水平;B:qRT-PCR法检测正常肾小管上皮细胞系HK-2细胞和肾透明细胞癌细胞系786-O和ACHN中circZBTB44的表达水平;**P<0.05,***P<0.001
2.2 circ ZBTB44在肾透明细胞癌细胞中的鉴定和特征
通过查询数据库,了解到circZBTB44位于chr11:130130750-130131824,由ZBTB44基因的15、16、17、18号外显子通过首尾相接共价闭合成环,circZBTB44全长1074 bp。
为了验证circZBTB44的环状RNA相关特征,我们用放线菌素D作用于肾透明细胞癌细胞株786-O和ACHN并设置了不同的作用时间,结果提示,circZBTB44的半衰期超过24 h,而线性ZBTB44 mRNA的半衰期约为12 h,表明circZBTB44的结构比线性ZBTB44 mRNA稳定(图2A)。我们进一步从细胞系786-O和ACHN中提取总RNA并利用RNase R消化,然后进行qRT-PCR,结果提示circZBTB44的表达量基本不受RNase R影响,而ZBTB44 mRNA则显著降低,提示circZBTB44在一定程度上能够耐受核酸外切酶的作用(图2B)。
为了进一步明确circZBTB44在786-O和ACHN中的定位,以U6(定位于细胞核)和18SrRNA(定位于细胞浆)为内参,通过核浆分离实验,我们发现circZBTB44在细胞浆的水平明显高于细胞核水平(图2C),提示circZBTB44主要定位于肾透明细胞癌细胞的胞浆内。

图2 circ ZBTB44在肾透明细胞癌细胞中的鉴定和特征A:qRT-PCR法检测不同时间的放线菌素D作用下,786-O和ACHN的circZBTB44和ZBTB44 mRNA的表达水平;B:qRT-PCR法检测RNaseR作用下,786-O和ACHN的circZBTB44和ZBTB44mRNA的表达水平;C,核浆分离实验提示circZBTB44主要分布在细胞浆中;*、**P<0.05,***P<0.001
2.3 siRNAs能有效下调circZBTB44的表达水平
为了探究circZBTB44在肾透明细胞癌细胞中的生物学功能,我们设计合成了两条circZBTB44特异性siRNAs(si#1和si#2)。利用siRNAs转染技术,向肾透明细胞癌细胞株786-O和ACHN转染si#1和si#2或阴性对照序列。通过qRT-PCR方法检测转染效率,发现与对照组(NC组)相比,si#1和si#2能有效下调circZBTB44的表达水平,而对ZBTB44 mRNA的表达无明显影响(图3)。

图3 si#1和si#2能有效下调circZBTB44的表达水平qRTPCR法检测转染circZBTB44特异性siRNAs(si#1和si#2)后,786-O和ACHN的circZBTB44和ZBTB44mRNA的表达水平;***P<0.001
2.4 下调circZBTB44抑制肾透明细胞癌细胞的增殖和迁移能力
通过MTS细胞增殖实验,发现与NC组相比,通过si#1和si#2下调circZBTB44可明显抑制肾透明细胞癌细胞株786-O和ACHN细胞增殖(图4A)。通过克隆形成实验,发现si#1和si#2组细胞形成克隆数目低于NC组(图4B)。以上结果表明,下调circZBTB44明显抑制肾透明细胞癌细胞的增殖能力。
进一步探究下调circZBTB44对肾透明细胞癌细胞迁移能力的影响,利用Transwell小室进行体外迁移实验。结果表明,与NC组相比,si#1和si#2组细胞迁移能力明显被抑制(图4C)。综上结果,circZBTB44在肾透明细胞癌中发挥着促癌作用,下调circZBTB44抑制肾透明细胞癌细胞的增殖和迁移能力。
2.5 circZBTB44可能通过调控AKT通路促进肾透明细胞癌细胞的增殖和迁移
上述结果证明circZBTB44在肾透明细胞癌中发挥着促癌作用。进一步探究circZBTB44可能的分子作用机制,通过对circZBTB44的亲本(host)基因进行基因富集分析(GESA)。我们发现一些肿瘤相关的信号通路有富集,如P53通路、AKT通路、TGF-β通路(图5A)。通过对这些通路的关键蛋白进行蛋白免疫印迹检测,我们发现,与对照组相比,通过si#1和si#2下调786-O和ACHN细胞circ-ZBTB44的表达后,p-AKT表达量明显减少,而PI3K表达量及P53、TGF-β通路未见明显变化(图5B),提示circZBTB44可在一定程度上促进AKT的磷酸化。综上结果,circZBTB44可能通过调控AKT通路促进肾透明细胞癌细胞的增殖和迁移。

图4 下调circZBTB44抑制肾透明细胞癌细胞的增殖和迁移能力 A:MTS细胞增殖实验检测细胞转染siRNAs后的增殖能力;B:克隆形成实验检测细胞转染siRNAs后的克隆形成能力;C:Transwell小室检测细胞转染siRNAs后的迁移能力;**P<0.005
3 讨论
近年来,随着高通量测序技术的快速发展,越来越多的circRNAs被发现,逐渐成为科学探究的热点。circRNAs表达丰富,结构稳定,是较为理想的生物标记物[10,11]。越来越多的研究发现,circRNAs在人类多种肿瘤组织中异常表达,并可通过作为miRNAs吸附海绵、结合RNA相关蛋白、编码相关蛋白等方式,调控肿瘤细胞的基因表达,进而影响肿瘤发生、发展[12]。如Has_circ_100395通过吸附miR-1228调控TCF21通路调控肺癌的进展[13]。circFoxo3直接结合p21、CDK2,共同形成三元复合物,进而调控细胞周期进程[14]。顺式circCTNNB1通过调控DDX3介导的YY1转录激活,调控Wnt/β-catenin信号通路,进而调控肿瘤的进展[15]等。目前circRNAs在肾透明细胞癌中的研究仍较少,其在肾透明细胞癌中的生物学功能和具体调控机制尚不明确,仍待进一步探索。PI3K/AKT信号通路是一条十分重要的信号通路,在细胞的生理、病理变化中都起着重要的作用。PI3K/AKT信号通路是肾透明细胞癌中最常见的反复突变的信号通路之一[16],PI3K/AKT信号通路被各种因素异常激活或失活,引起下游通路的改变,进而影响肾透明细胞癌的增殖、迁移、侵袭、EMT等能力[17]。如PTPN3基因通过抑制肾透明细胞癌细胞的PI3K/AKT信号通路,抑制肾透明细胞癌的增殖和转移[18]。酰基甘油激酶可通过激活PI3K/AKT/GSK3β信号通路促进肾透明细胞癌的生长和转移[19]等。

图5 circZBTB44可能通过调控AKT通路促进肾透明细胞癌细胞的增殖和迁移 A:基因富集分析(GESA)探究circZBTB44可能的分子作用机制;B:蛋白免疫印迹实验检测细胞转染siRNAs后PI3K/AKT通路、P53通路、TGF-β通路的关键蛋白表达量的变化。
本研究通过分析GEO数据库中肾透明细胞癌与癌旁组织circRNA芯片数据的差异表达,发现circZBTB44在肾透明细胞癌组织中明显高表达,并在本院31对肾透明细胞癌组织及细胞系786-O和ACHN得到了验证。通过放线菌素D实验和RNase R实验验证了circZBTB44结构较ZBTB44 mRNA稳定的特征,并通过核浆分离实验确定circZBTB44定位于胞浆。体外实验中,通过下调circZBTB44的表达水平,发现786-O和ACHN细胞的增殖和迁移能力均被明显抑制。进一步探究发现,下调circZBTB44的表达可抑制AKT的磷酸化,提示circZBTB44可能通过促进AKT的磷酸化,激活PI3K/AKT信号通路,进而发挥其促癌作用,促进肾透明细胞癌细胞的增殖和迁移。然而circZBTB44具体调控PI3K/AKT信号通路的分子机制仍不明确,本研究验证了circZBTB44主要分布于细胞浆,通过数据库发现circZBTB44环上有较多miRNA和RNA相关蛋白结合位点,后续将结合生物信息学分析预测并进行验证,继续深入探索circZBTB44的分子机制。
综上所述,本研究发现circZBTB44在肾透明细胞癌组织和细胞中均高表达,circZBTB44可能促进AKT的磷酸化,激活AKT信号通路,促进肾透明细胞癌的增殖和迁移能力,有望成为肾透明细胞癌治疗的潜在新靶点。
