乳腺癌肝转移特征及诊疗
2021-07-29杨文倩林婉宜龚畅
杨文倩,林婉宜,龚畅
根据世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的2020年全球最新癌症数据[1]:乳腺癌首次超过肺癌成为全球“第一大癌”;仅在2020年一年内,我国就有新发乳腺癌约42万,约12万患者死于乳腺癌。乳腺癌死亡主要原因为肿瘤转移。
越来越多研究显示,多数恶性肿瘤都存在远处转移风险。乳腺癌早期即可发生转移,晚期乳腺癌常见转移部位:骨、肺、肝、脑[2],转移发生率约为骨转移:85%~70%;肝转移:50%~61%[3],其中肝脏为唯一转移灶的患者较少,只占约5%~12%[3]。尽管肝脏不是转移概率最高的器官或部位,但相关研究证实,相较于骨转移等因素,肝脏受累是乳腺癌患者总生存(overall survival,OS)恶化的独立预测因素[2]。一旦发生肝转移(liver metastasis,LM),患者通常预后较差,如果不治疗,中位生存期仅4~8个月左右。即使对于全身治疗有反应的患者,自诊断之日起,转移性肝癌患者的中位生存期仅为18~24个月,大部分患者经过约1~2年的治疗稳定期后病情基本都出现进展[4],5年和10年生存率分别低至27%和13%[5,6]。
国际学术组织和很多国家、地区的乳腺癌组织先后出台了不少晚期乳腺癌及乳腺癌骨转移和脑转移诊疗指南、规范和共识,但晚期乳腺癌肝转移患者的局部治疗是否能够获益尚需前瞻性随机对照临床试验证明,目前尚无针对晚期乳腺癌肝转移患者的治疗指南。对于晚期乳腺癌肝转移患者是否可先进行局部治疗,局部治疗选择手术或射频消融以及如何制定患者全身治疗方案等这些问题,国内外专家尚未达成共识,本文对乳腺癌肝转移临床特点、发病机制的研究现状与治疗进展进行综述,旨在为乳腺癌肝转移的临床诊疗、药物研究提供一定的思路和依据。
1 肝转移特点及机制
尽管随着乳腺癌筛查的普及,新发乳腺癌中晚期患者占比逐年降低,但目前仍有约6%~7%的新诊断乳癌患者在诊断初期即发现转移灶[7],约20%~30%最初诊断为早期乳腺癌的患者最终进展为晚期乳腺癌[8]。肝转移风险与多种因素相关,一项纳入544名晚期乳腺癌患者的研究显示:激素受体阴性且人表皮生长因子受体2(HER2)阳性亚型乳腺癌患者肝转移率较高,风险为Luminal A型患者的3.61倍(P=0.01,95%CI:1.36~9.58)[2]。
乳腺癌肝转移(liver metastasis of breast cancer,BCLM)常伴其它部位的复发、转移;多不伴有肝硬化,患者肝储备功能一般较好;早期BCLM可以不表现任何临床不适症状,随病情进展,可继而出现发热、纳差、腹胀,腹水、黄疸、肝大等症状和体征;常提示预后差、生存时间短。
同其他脏器或中枢神经、骨骼系统肿瘤转移机制类似,BCLM是肿瘤细胞与微环境之间发生的多步骤、多基因、多信号通路共同作用的结果[9]。乳腺癌转移至肝脏的途径为血行转移和淋巴转移,经肝动脉转移为主,占58%~65%;主要分为三个步骤:肝组织中转移前微环境形成,肿瘤细胞定植,转移灶形成。
原发肿瘤细胞通过分泌、招募等作用在特定器官组织部位形成利于肿瘤细胞定植增殖的微环境,如招募造血干细胞至转移部位并表达血管内皮生长因子受体1、血管生成素等,促进血管形成,并通过分泌炎症因子TNF-α、IL-6在局部引起炎症反应使血管通透性增强,肿瘤细胞通过血管内皮或淋巴管内皮细胞进入循环,进入血循环后CD8+细胞、单核细胞、NK细胞等被激活,杀灭肿瘤细胞,但同时骨髓衍生抑制细胞、M2型巨噬细胞、Treg细胞等免疫抑制细胞也被激活促进肿瘤免疫逃逸,通过诱导免疫抑制、促进肿瘤细胞侵袭[10],见图1。
肿瘤细胞通过血循环进入肝窦,肝窦特殊的结构:缺乏内皮基底膜,有助于肿瘤细胞侵入,同时一些黏附分子在此过程中发挥作用使肿瘤细胞定植,如L1-细胞黏附分子、钙黏蛋白-2等介导了乳腺癌细胞与肝细胞间的相互作用,使肿瘤细胞能够成功定植于肝组织[11],见图1。肿瘤成功定植后通过促进血管形成、纤维蛋白分泌等重塑转移肝脏局部组织结构[12],影响肝脏细胞正常代谢等作用。
2 乳癌肝转移的诊断
美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南[13]指出肝转移确诊主要依据乳腺癌病史及经皮肝活检和/或放射学检查。临床常规诊疗过程中,对于已诊断乳腺癌的早期患者(Ⅰ、Ⅱ期患者)应常规以B超检查排除肝脏转移,对于局部晚期乳癌患者或初诊Ⅳ期患者考虑行腹部CT或MR来进一步诊断是否有肝转移,诊断流程见图2。一项分析了311 573名乳腺癌患者及1 728名乳腺癌肝转移患者数据的研究显示:年龄小,浸润性导管癌,较高的病理学等级以及三阴型和人类表皮生长因子受体2阳性的亚型是发生肝转移的危险因素[14]。对于符合上述高危因素的乳腺癌患者一定要警惕其肝转移可能。对于已出现症状进展、肿瘤标志物上升、上腹部疼痛、肝功能异常、腹水等表现的患者一定要进行进一步检查。

图1 乳腺癌肝转移相关因素
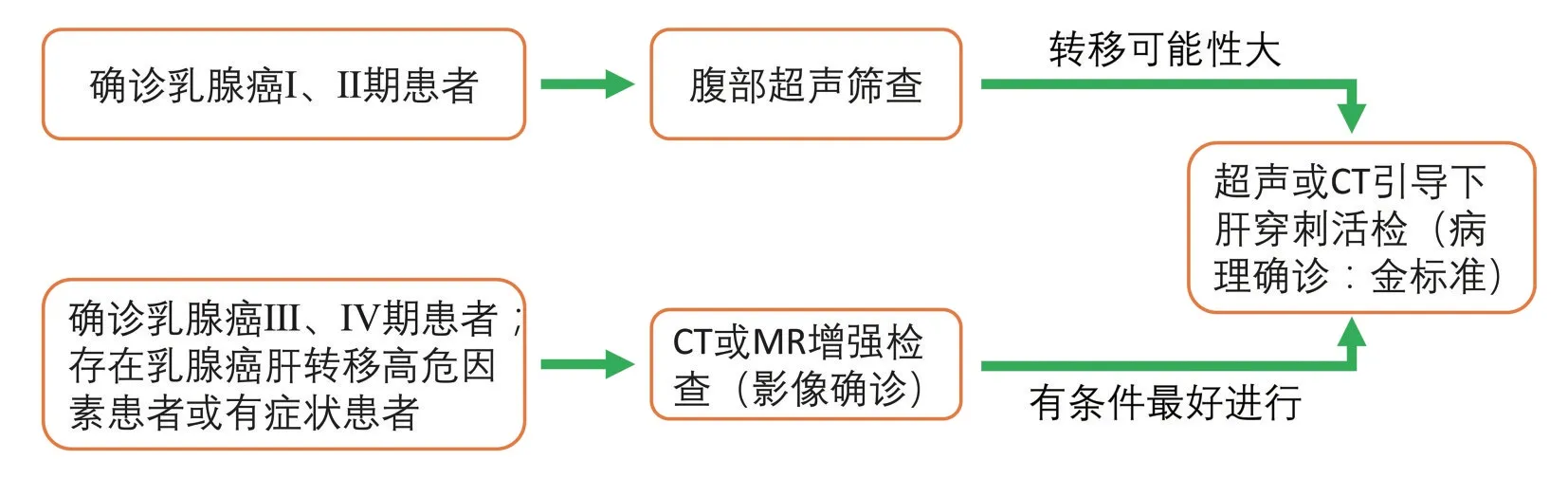
图2 乳腺癌肝转移的诊断
3 乳腺癌肝转移灶治疗
根据2020年第5版ESO-ESMO(欧洲肿瘤学院-欧洲医学肿瘤学会)国际晚期乳腺癌共识指南(ABC5)[15]:转移性乳腺癌的总体诊治原则:①多学科/跨学科的团队参与诊治MBC;②个体化诊治;③绝大多数MBC的治疗是姑息性治疗,主要治疗目的是改善生活质量;④根据肿瘤分子分型进行治疗;⑤部分局限性病灶可通过手术方式切除(原发灶和转移灶)。当第一次发现患者出现复发或转移性病灶时应尽量对复发转移性病灶进行病理活检,以确保能尽量准确评估激素受体状态(雌激素受体(ER)和孕激素受体(PR))和HER2状态。这样可尽量避免因原发灶ER和PR分析假阴性/假阳性或原发性与转移性肿瘤之间异质性导致的治疗效果不佳可能性,因既往研究统计,原发灶与转移灶之间ER状态评估结果不同比例甚至可高达60%。
3.1 乳腺癌肝转移全身治疗
全身治疗包括全身化疗、内分泌治疗和靶向治疗等。BCLM的全身治疗主要还是根据患者的分子亚型和疾病负荷选择方案。根据第5版ESOESMO国际晚期乳腺癌共识指南(ABC5):全身治疗决策与转移灶部位无明显相关,根据分子分型选择治疗方案;只要原发灶或转移灶任一存在HR+或HER2+,即按照该分子分型进行全身治疗方案的选择。
对于HR+性患者,CDK4/6抑制剂联合芳香酶抑制剂(aromatase inhibitors,AI)一线治疗显著改善乳腺癌远处转移患者的无进展生存期(progress free survival,PFS),如PALOMA-2试验结果[16]显示晚期肝转移乳腺癌患者一线应用来曲唑+哌柏西利治疗方案PFS可延长至13.7个月,MONARCH-3试验[17]中CDK4/6抑制剂阿贝西利联合AI患者平均PFS达15.02月,两项实验对照组单纯应用AI,PFS显著低于实验组。对于内分泌治疗耐药的患者,PALOMA-3[17]试验结果显示CDK4/6抑制剂联合氟维司群能显著改善乳腺癌肝转移内分泌治疗进展患者的PFS,对比单纯应用氟维司群,PFS可延长4.1个月。
对于HER2阳性患者,PHOEBE试验[18]数据显示对于既往接受过曲妥珠单抗及紫杉类治疗的患者,吡咯替尼联合卡培他滨相较于拉帕替尼联合卡培他滨可将乳腺癌内脏转移患者的PFS由8.2~11个月延长至12.5个月。DESTINY-Breast01研究[19]显示DS8201在乳腺癌内脏转移患者后线治疗中表现优秀,中位PFS达16.4个月,且HER2低表达患者也可获益。遗憾的是以上试验未列出肝转移患者客观缓解率(objective response rate,ORR)及PFS,无法更加准确地对比两组肝转移患者的反应率及获益。
3.2 乳腺癌肝转移灶的局部治疗
多项研究表明,晚期肝转移患者中的寡转移人群可从局部治疗中获益。根据第5版ESO-ESMO国际晚期乳腺癌共识指南(ABC5)[15]:对于仅有肝脏寡转移、全身一般情况良好的晚期乳腺癌患者,有可能通过局部治疗配合全身治疗来实现病灶的长期缓解[15]。尽管目前尚未建立可获得共识的BCLM患者局部治疗后风险预测模型,但相关研究已揭示:BCLM患者局部治疗后复发风险与患者早期就诊时原发肿瘤状态相关:较小肿瘤负荷、较低分级与区域引流淋巴结阴性的患者复发风险较低[20-22]。
目前,虽然没有前瞻性临床研究数据显示哪种局部治疗方式更佳,例如:局部手术、立体定向放疗、肝内介入治疗等[15],在全身治疗失败或停止的情况下,手术切除BCLMs目前被视为治疗标准[3],治疗方式选择见图3。尽管暂无前瞻性随机对照研究数据,目前已有多篇相关研究结果发表,认为如能成功施行完全性转移灶切除手术,患者术后生存率将获得提升[23,24]。2020年2月27日,《美国外科杂志》在线发表复旦大学附属肿瘤医院等发起的研究报告[25],对于中国人群乳腺癌肝转移的肝转移切除术或非手术治疗方法能否改善生存结局进行了比较。该多中心回顾研究将2008年1月~2018年10月连续384例乳腺癌肝转移患者分为两组,其中肝转移切除组65例、非手术组319例。由于两组患者部分临床病理特征相差悬殊,故通过倾向评分匹配减少选择偏倚和混杂因素的影响,对临床结局进行比较。该研究结果显示:肝转移切除组与非手术组相比:平均1年总生存率:92.6%vs.79.2%,平均3年总生存率:54.7%vs.45.6%,平均5年总生存率:54.7%vs.21.9%,以上三组生存率对比均存在统计学差异;多因素分析表明,显著影响生存结局的独立因素包括:激素受体阳性、根治性肝切除术,激素受体阳性、肝切除的BCLM患者预后更好。
另有文献显示:早期阶段新辅助治疗效果[6,26]、是否完整切除病灶[6,20,26,27]、是否为肝局限性疾病(孤立性肺转移和骨转移除外)[28-30]、乳腺癌诊断到乳腺癌转移的时间间隔(是否超过1年)[31,32]和BCLM是否为PR和/或ER阳性[33,34],是否为孤立性BCLM[21]等也为BCLM患者预后独立预测因素。但从另一个方面来讲,对于可接受手术的患者,研究数据也显示仍有许多患者出现术后复发[30],术后出现肝脏复发和肝外复发的平均时间间隔分别为肝脏转移灶切除术后15个月和22个月[32]。此外手术切除会对患者带来较大创伤,因此应严格把握手术适应证。
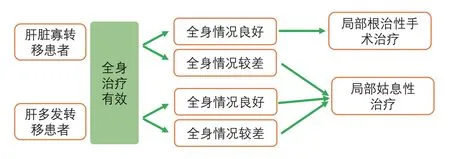
图3 肝转移相关治疗
其他肝转移瘤的姑息性局部治疗(LM)包括经动脉栓塞(TAE)、经动脉化疗栓塞(TACE)和选择性体内放射治疗(SIRT)等。目前超声引导经皮热消融治疗,如射频消融(RFA)和微波消融(MWA)也因侵入性小、成本低、禁忌症和并发症发生率低被认为可作为部分患者的首选治疗方式,但无法控制较大的转移病灶。
有研究显示[35],肝局部切除治疗较肝局部射频消融可使患者获得更高的生存率,但射频消融等其他方法具有创伤小、并发症少、住院时间短等优点,适用于不适合手术切除的病人。乳腺癌肝转移患者具体生存获益情况及各种方法如何选择仍需进一步试验。
4 总结
乳腺癌肝转移发生率较高,且一旦发生将严重影响患者预后情况,制定更加精准的乳腺癌肝转移患者治疗指南是十分有必要的,但目前高级别研究数据仍十分有限。对于晚期乳腺癌治疗,应主要立足于患者的原发灶或转移灶的分子亚型和肿瘤负荷,同时综合患者年龄、耐受性等、原发肿瘤情况等多项信息来制定患者治疗策略。对于肝转移的乳腺癌患者,有效的全身治疗是延长患者生存期的关键,在此基础上,对于有良好表现分数、肝受累有限、无肝外病变且经过充分的全身治疗,病情得到控制的患者,可根据病灶情况选择合适的局部治疗方案,能帮助患者提高生活质量甚至延长生存期。随着乳腺癌治疗观念的不断发展,相信未来乳腺癌肝转移患者将获得更加个体化和精细的临床治疗。
