高电压钴酸锂软包电池热失控行为研究 ①
2021-07-28张诗怡林志炜王贵刚刘志宏刘继延
张诗怡,陈 龙,林志炜,王贵刚,杨 坤,刘志宏,刘继延
(江汉大学 化学与环境工程学院 光电化学材料与器件教育部重点实验室,湖北 武汉 430056)
1 引言
钴酸锂电池以其能量密度高、循环性能好和环保无污染等优点,被广泛应用于电子类消费品中[1-5],尤其是智能手机中。随着人们在生活中对电子设备的依赖度增高,对锂离子电池的综合性能也提出了更高的要求,其中之一是提高锂离子电池的能量密度以提高续航时间。与传统4.2 V钴酸锂电池相比,4.4 V高电压钴酸锂电池充电截止电压提高了0.2 V,能量密度提高了10%左右。然而锂离子电池能量密度提高的同时也带来了相应的安全隐患,即锂离子电池的热失控[6-9]。近年某品牌手机电池着火爆炸事故以及笔记本电脑电池着火事故引起了社会的广泛关注,既危害人民生命安全,又造成贵重财产损失。在此背景下对锂离子电池热失控行为进行研究显得极为重要,通过分析热失控的行为及成因,评估发生热失控的风险,为防范热失控和减少损失提供一些有益参考和依据。
一般来说,锂离子电池发生热失控的原因主要是电滥用、机械滥用、热滥用[10],但是不论以何种方式都会导致锂离子电池隔膜破裂引发内短路最终发生安全事故。例如Perea等采用加速量热仪研究不同荷电状态(State of Charge,简称SOC)0%、50%和100%的LiFePO4(简称LFP)和Li(Ni0.80Co0.15Al0.05)O2(简称NCA)电池,结果表明LFP材料电池相对于NCA电池来说表现出更出色的循环特性和热稳定性[11]。Golubkov等研究了3种类型的商业化18650锂离子电池的热失控特性[12],通过实验可知,锂离子电池的安全性取决于它们的内部成分、电池大小、容量、荷电量、设计方式和活性物质的含量。到目前为止,对4.4 V高电压钴酸锂电池的安全性和热失控研究还未有报道。因此本文利用加速绝热量热仪对两种品牌公司的高电压钴酸锂软包电池进行热失控研究,评估高电压钴酸锂电池发生热失控的风险,并分析了两种电池发生热失控的行为差异,以期为防范热失控和减少损失提供一些有益参考和依据。
2 实验材料与方法
2.1 实验材料
选取两种品牌的智能手机用高电压钴酸锂软包电池A和B,两种锂离子电池均采用4.5 V高电压钴酸锂为正极,硅碳复合石墨为负极,其容量分别为3 400 mAh和4 100 mAh,详细参数如表1中所示。

表1 样品A和B两种电池的相关参数Table 1 Related parameters of sample A and B batteries.
2.2 实验方法
2.2.1 软包电池电化学性能
锂离子电池的综合性能主要包括电池容量、充放电性能、循环性能和倍率性能等,采用电池充放电仪(武汉蓝电)对电池的该性能进行测试和表征。还可以通过充放电容量来精确调整电池的荷电状态(SOC)。
2.2.2 电池热稳定性测试
探究电池热稳定性使用的仪器是加速绝热量热仪(英国H.E.L.公司BTC-130),主要由热跟踪器和BTC-130主机组成。本次研究使用了H-W-S(加热-等待-搜索)程序。初始温度设定为50 ℃,截止温度为500 ℃,温度梯度值为5 ℃,灵敏度值为0.03 ℃/min。在进行热失控测试之前,使用蓝电充放电仪,把电池充至满电状态,然后将电池按照图1的方式固定在量热仪的温度传感器上,最后闭合测试腔体启动仪器对电池进行热稳定性测试。

图1 BTC-130量热仪的模型Fig.1 Model of BTC-130 calorimeter.
2.2.3 热失控后产物的成分分析
X 射线衍射仪(荷兰PANalytical 公司X’pert powder),测试对象为燃烧后的正负极材料残留物,衍射角为20°-70°,扫描速度为10 °/min,目的是研究钴酸锂电池热失控过后的残留产物成分。
3 结果与讨论
3.1 电池A和B的充放电曲线
为了研究结果具有代表性,选用了市场上A和B两种品牌的高电压钴酸锂软包电池。为了便于比较,选用了额定容量相近的两款电池,其额定容量分别为3 400 mAh和4 100 mAh。电池A和B的充放电曲线见图2(a)和(b),充放电范围为2.7 V-4.4 V,是典型的高电压钴酸锂电池的充放电曲线,容量符合标定额定容量范围。满电态(SOC=100%)的电池一般指充电至最高电压4.4 V,无荷电态(SOC=0%)的电池,一般指放电至最低电压2.7 V。
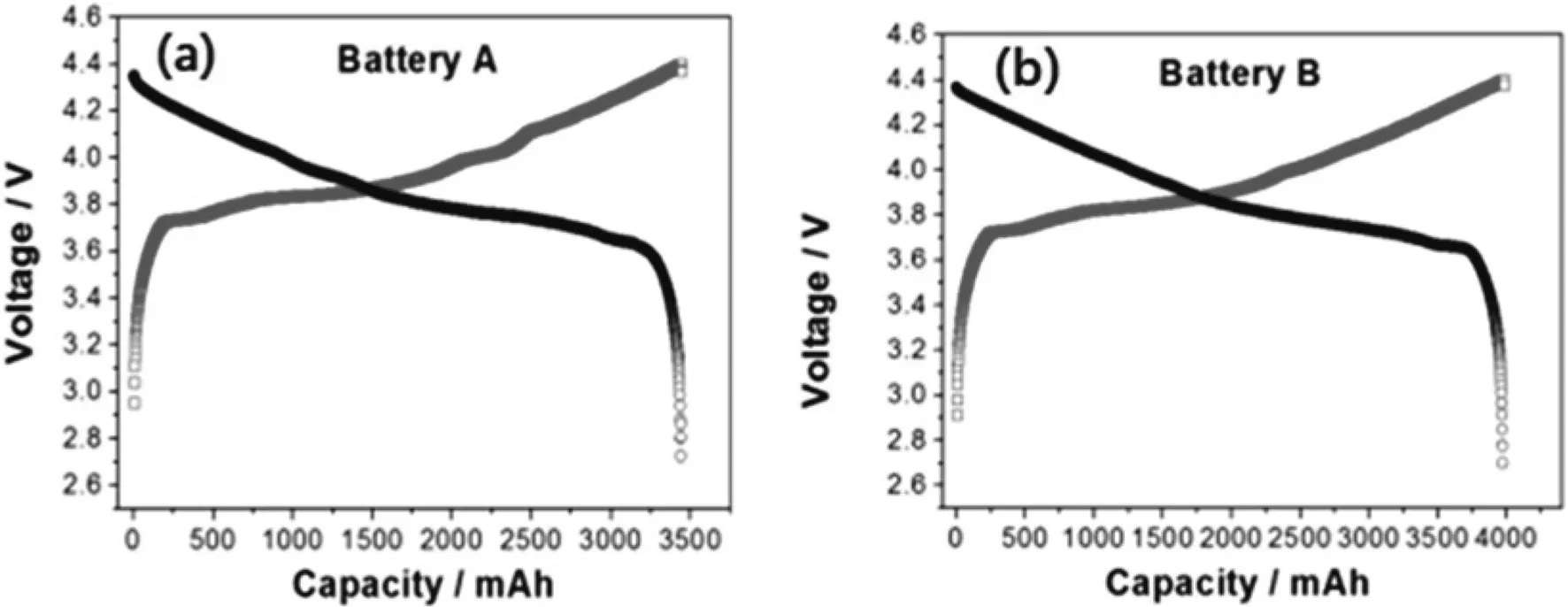
图2 A和B两种电池的充放电曲线Fig.2 Charge-discharge curves of A and B batteries.
3.2 电池A和B的热失控行为
图3(a)和(c)分别是电池A和B在SOC=100%满电状态下热失控温度-时间曲线(T-t)和温度变化率-温度曲线dT/dt-T。从图3 (a)中可以看到,在温度升至80 ℃左右时,电池内部开始发生放热副反应,此过程中主要是由于负极表面亚稳定结构的SEI膜分解,此时暴露在电解液中的负极材料开始与电解液发生放热反应。由图3(c)可知电池温度变化率一直处于线性上升状态,说明放热反应的过程在持续进行。当温度达到150 ℃左右时A和B电池的隔膜都开始熔化,与此同时正负极短路释放大量的热,加速了后续副反应的发生,在此温度下A和B电池发生完全热失控。在此过程中发生的副反应有正负极之间的氧化还原反应、电解液燃烧、正极材料的释氧反应、黏结剂与电极材料之间的反应以及正极集流体铝箔的燃烧反应多种反应同时进行,最终达到热失控的最高温点600 ℃左右,反应停止。其中电池B的最高温度620 ℃略高于电池A的最好温度600 ℃,这是因为电池B的容量和能量密度都略高的缘故。图3(b)和(d)分别是电池A和B在SOC=0%无荷电状态下热失控温度-时间曲线(T-t)和温度变化率-温度曲线dT/dt-T。由图3(b)可知在A、B电池SOC=0时大约在200 ℃左右时才开始缓慢地发生副反应。由于SOC=0,因此两种电池在温度上升的过程中只发生副反应,基本无短路热释放,最终电池A和B分别在在400 ℃、340 ℃左右发生热失控,最后电池内部的活性物质反应完毕达到热失控的最高温500 ℃,整个热失控过程结束。由图3(d)可知电池在温度上升的过程中温度变化率呈锯齿状,主要原因是硅(亚硅)负极氧化,隔膜,黏合剂,以及电池内部电解液组分发生氧化反应,或不同电解液组分与电极发生副反应。且此过程呈阶段性发生。
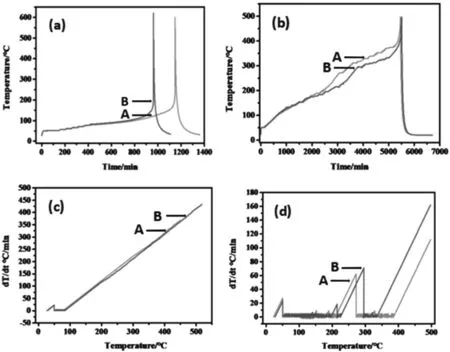
图3 (a-b)分别表示电池A和B的温度-时间(T-t)曲线;(c-d)分别表示温度变化率-温度(dT/dt)-T曲线Fig.3 (a-b) Temperature-time (T-t) curves for batteries A and B,respectively;(c-d) Temperature change rate-temperature (dT/dt)-T curves,respectively.
3.3 热失控后产物成分分析
图4是A和B电池燃烧后的残留粉末进行粉末XRD衍射分析,由图可知其主要成分为石墨、LiCO3、SiO2、LiN3以及部分含钴的化合物。其中残留了大量石墨,说明负极石墨本身基本没有参与热失控。含有SiO2表明这两种电池的负极材料为SiCx化合物。生成Li2CO3的主要原因是电解液与正极材料之间高温反应所致;产生Li3N主要是因为高温下Li与氮气反应所致。

图4 A和B两种电池热失控后残留物的粉末XRD图谱Fig.4 XRD patterns for the residue of A and B batteries after thermal runway Powder.
由图5可知,荷电量越大电池燃烧越剧烈,在SOC=0%时A、B电池表面的铝塑膜均保持完整但内部的隔膜和电解液完全然燃烧。而SOC=100%时,A电池表面的铝塑膜、正极集流体铝箔、隔膜、电解液均燃烧殆尽;B电池的铝塑膜保持完整,但内部的隔膜、电解液、正极集流体铝箔均燃烧殆尽。电池B在完全热失控后仍然保持较好的形态,得益于电池B采用不锈钢外壳防护,所以具有更好的高温稳定性。
由表2可知,无荷电状态条件下,电池热失控后的质量损失基本是液态电解液的挥发或燃烧所造成的损失。随着电池荷电量的增加,热失控程度越剧烈,导致部分粉末材料的喷出,质量损失率也随之增大。

表2 热失控前后两种电池的质量Table 2 Mass of two batteries before and after thermal runway.
4 结论
采用绝热量热仪研究了4.4 V高电压钴酸锂软包电池的热失控行为,温度-时间曲线和温度变化率-温度曲线的结果表明,在温度升至80 ℃时,电池内部开始发生缓慢的放热副反应,当温度持续升高到150 ℃左右时,数分钟内电池发生完全热失控最终达到最高温点600 ℃左右。在此期间电池温度变化率一直处于线性上升状态。电池B在热失控后仍然保持较好的形态,得益于电池B采用不锈钢外壳防护,所以具有更好的高温稳定性。
