CodY在单核细胞增生李斯特菌抗氧化胁迫中的作用
2021-07-28杨诗怡杨丽玉
杨诗怡,林 巍,杨丽玉,左 成,罗 勤
(华中师范大学生命科学学院,湖北 武汉 430079)
单核细胞增生李斯特菌(Listeria monocytogenes,Lm)是一种食源性致病菌,在自然界中广泛存在,对环境有极强的耐受能力,能在冷藏温度(2~4 ℃)、酸性环境(pH 4.5)以及高盐(10% NaCl)条件下生长,因此Lm能够克服食品储存过程中的各种不利因素影响,造成食品污染进而危害到人类健康,由Lm引起的李斯特菌病可导致孕妇流产,新生儿、老年人以及免疫缺陷或低下病人罹患脑膜炎、败血症等[1-2]。Lm黏附在器具表面所形成的生物被膜有助于其耐受恶劣环境以及抗菌处理手段[3-4]。合理的消毒方法对防控Lm污染至关重要,而所使用的消毒剂需要具有无毒、无害、无残留等特性[5]。
食品加工过程中,常用到H2O2、NaClO等氧化类消毒剂,强氧化环境会导致细菌内活性氧(reactive oxygen species,ROS)大量积累,从而激发细菌氧化应激反应[6-7]。H2O2因其在使用后能分解成无毒产物(H2O和O2),不会造成有害物残留,被越来越多地应用于医疗、食品和工业生产中[6,8]。一定浓度的H2O2能激发细菌的抗氧化应激反应,诱导超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽(glutathione,GSH)等相关基因表达[9]。多种外部环境胁迫(如饥饿、氧化应激、抗生素处理等)也会导致细菌DNA受到损伤,此时其内部的DNA修复机制被激活,如DNA损伤诱导反应(SOS反应),以抵御外部环境胁迫引起的DNA损伤[10]。Lm中参与SOS反应的基因主要有recA(SOS反应诱导物)、lexA(SOS反应阻碍物)、recR(SOS反应激活因子)、lmo1302(LexA家族调节子)和lmo1975(DNA聚合酶IV)等[10-11]。
CodY是一种全局转录调控因子,普遍存在于低G+C含量的革兰氏阳性菌中,参与多种代谢途径以及生理过程的调控[12]。研究表明,在乳酸链球菌(Lactococcus lactis)[13]、枯草芽孢杆菌(Bacillus subtilis)[14]和金黄色葡萄球菌(Staphylococcus aureus)[15]中,CodY可以通过直接与靶基因启动子区保守序列CodY-box(即AATTTTCWGAAAATT)结合,或通过其他方式直接或间接地调控基因表达,Lm中也存在类似的保守序列[16]。已有研究发现某些细菌中CodY参与了抗氧化应激过程的调控,如:Wang Yue等[17]证明了在嗜热链球菌(Streptococcus thermophilus)中CodY能结合到GSH的编码基因ghsF启动子区域,调控GSH的合成,清除过量H2O2;Hajaj等[18]发现肺炎链球菌(Streptococcus pneumoniae)中虽不存在常见的CAT,但却有一种被称为“硫醇过氧化物酶(TpxD)”的关键酶用以清除多余的过氧化物,其编码基因tpxD具有CodY-box,当细菌受到H2O2胁迫时,CodY能够激活tpxD使其表达上调。Lm中CodY在细菌毒力、鞭毛运动等方面具有重要作用[19-21],但CodY是否直接或间接参与Lm抗氧化应激调控还鲜有研究。
本研究通过比较野生株EGDe和CodY(由codY编码)缺失株EGDeΔcodY的抗氧化应激能力以及SOS反应等基因表达差异,探寻CodY在LmH2O2氧化胁迫中的调控作用及其机制,以期为医疗、食品和工业生产中H2O2的合理使用策略,以及预防和治疗李斯特菌病提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
实验中所用菌株EGDe(血清型1/2a,全基因组序列已知[22])为德国维尔茨堡大学Werner Goebel教授惠赠,EGDeΔcodY为本实验室构建和保存[19]。如无特殊说明,菌株均在脑心浸液(brain heart infusion,BHI)培养基中37 ℃过夜活化并200 r/min振荡培养至对数中期(OD600nm=0.65)。
1.1.2 试剂
BHI培养基 美国B&D公司;30% H2O2(分析纯)国药集团化学试剂有限公司;CAT、SOD及GSH检测试剂盒 南京建成生物工程研究所有限公司;十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB) 北京索莱宝生物科技有限公司;PrimeScriptTMRT reagent反转录试剂盒 宝生物工程(大连)有限公司;荧光定量SYBR Green Master Mix 中国US Everbright公司。
1.1.3 引物
根据NCBI中已公布的EGDe全基因组序列,利用Primer5设计基因引物,所有引物均由生工生物工程(上海)股份有限公司合成,引物见表1。

表1 实验引物信息Table 1 Primers used in this study
1.2 仪器与设备
VCX800超声波细胞破碎 美国Sonics公司;DYY-6D电泳仪 北京市六一仪器厂;Veriti PCR仪 美国Applied Biosystems公司;ZF-258凝胶成像系统 上海嘉鹏科技有限公司;CFX96 real-time PCR仪 美国Bio-Rad公司。
1.3 方法
1.3.1 H2O2对细菌最低抑菌浓度(minimum inhibitory concentration,MIC)和最低杀菌浓度(minimum bactericidal concentration,MBC)的测定
将10 μL对数中期的新鲜菌液(浓度约为9×1011CFU/mL)分别加入到200 μL含有不同浓度的H2O2(5、10、15、20、25、30、35、40、45、50 mmol/L)的无菌BHI培养基中,每组设3 个重复。另设一组不添加H2O2的菌液作为对照。此时各组菌液较为清亮。37 ℃静置培养22 h后,肉眼观察,无细菌生长(即菌液保持清亮,无明显浑浊)的最低H2O2浓度即为该菌的MIC值。在MIC结果的基础上,取200 μL肉眼观察无菌生长的培养液进行BHI平板涂布,37 ℃培养22 h后,平板上无细菌生长的最低H2O2浓度,即为该菌的MBC值。
1.3.2 抑菌圈检测
采用纸片琼脂扩散法。调节对数中期菌液浓度近似为9×1011CFU/mL,稀释107倍,取100 μL菌液进行平板涂布。用无菌镊子夹取无菌圆形滤纸片(直径6 mm),平贴于培养基表面。每个平板上均匀放4 张滤纸片,分别滴加10 μL含0(对照)、10、20、30 mmol/L H2O2的BHI于其上,37 ℃过夜培养,游标卡尺测量抑菌圈直径。
1.3.3 细菌在不同浓度H2O2中的生长曲线测定
向100 mL对数中期菌液中分别加入一定量(0.05~2.04 mL)30% H2O2溶液(市售H2O2初始浓度9 790 mmol/L),使菌液中H2O2终浓度分别为5、20、50、100、200 mmol/L,37 ℃、200 r/min振荡培养。每隔0.5 h检测菌液OD600nm的变化,连续测定至第3小时。
1.3.4 细菌CAT、SOD活力和GSH含量检测
菌株培养至对数中期后,加入200 mmol/L H2O2分别胁迫0(对照)、10、20、40 min,磷酸盐缓冲液洗涤并重悬菌体。超声波细胞破碎仪破碎菌体,破碎时将菌体置于冰水混合环境,工作总时间5 min(超声3 s、间歇5 s)。破碎后的细胞经6 000 r/min、4 ℃离心10 min,取上清液,依照CAT、SOD及GSH检测试剂盒的步骤检测细菌的CAT、SOD活力和GSH含量。
1.3.5 H2O2胁迫对细菌DNA损伤程度的检测
本实验采用RAPD技术[23]研究H2O2对细菌DNA的损伤。DNA损伤程度通过菌株基因组模板稳定性(genomic template stability,GTS)进行评估。利用CTAB法提取对数中期细菌总DNA,进行RAPD分析,所使用的随机引物见表1。反应体系为:TaqMix 12.5 μL、随机引物2 μL、DNA 3 μL、ddH2O 7.5 μL。反应条件:95 ℃预变性5 min;94 ℃变性45 s,40~30 ℃梯度退火30 s,72 ℃延伸1 min,循环20 次;94 ℃变性45 s,35 ℃退火45 s,72 ℃延伸1 min,循环10 次;72 ℃充分延伸10 min。PCR产物进行1%琼脂糖凝胶电泳,EB染色后,利用凝胶成像系统成像观察并统计多态性条带数。GTS计算公式如下:

式中:A为H2O2胁迫后细菌DNA的RAPD条带数,即新出现和消失的PCR条带数之和;N为未经H2O2胁迫的细菌DNA PCR后的总条带数。
1.3.6 细菌real-time PCR分析
对细菌抗氧化应激物CAT、SOD和GSH的编码基因kat、sod、gshF,SOS反应重要基因recA、lexA、recR、lmo1302、lmo1975进行real-time PCR,定量分析H2O2胁迫对其转录表达的影响。用200 mmol/L H2O2胁迫EGDe和EGDeΔcodY菌株0(对照)、10、20、40 min后,分别提取细菌总RNA,利用反转录试剂盒,1 μL RNA/10 μL体系得到细菌不同胁迫条件下的cDNA,以其为模板进行real-time PCR,每组设置4 个平行。反应体系(15 μL)为:SYBRTaq7.5 μL、上下游引物各0.3 μL、cDNA 3 μL、ddH2O 3.9 μL。反应条件:95 ℃预变性3 min;95 ℃变性10 s,62 ℃退火及延伸30 s,循环39 次;65~95 ℃,每5 s增加0.5 ℃,生成熔解曲线。以细菌16S rRNA为内参基因,采用2-ΔΔCt法 处理数据。
1.4 数据统计与分析
各实验均进行3 次生物学重复,实验结果取其平均值,利用SPSS 22.0软件进行数据的统计与分析,P≤0.05,差异显著,Origin 8.0软件作图。
2 结果与分析
2.1 EGDe和EGDeΔcodY对H2O2耐受能力的比较
为了比较野生株EGDe和CodY缺失株EGDeΔcodY抗氧化胁迫的差异,首先检测了H2O2对两株细菌的MIC和MBC。H2O2对EGDe的MIC为25 mmol/L,MBC为30 mmol/L,对EGDeΔcodY的MIC为10 mmol/L,MBC为15 mmol/L,H2O2对EGDe的MIC和MBC大约是EGDeΔcodY的2 倍,表明缺失CodY会导致Lm对H2O2的耐受能力减弱。同时,也进行了抑菌圈实验,如表2所示,当滤纸片中H2O2浓度为10 mmol/L时,EGDe和EGDeΔcodY形成的抑菌圈直径分别为(0.97±0.16)cm和(1.30±0.45)cm,H2O2对EGDeΔcodY的抑制略高于EGDe,但差异不显著(P>0.05);当H2O2浓度达到20 mmol/L后,EGDe和EGDeΔcodY形成的抑菌圈直径分别为(1.01±0.15)cm和(1.57±0.34)cm,二者之间差异极显著(P≤0.01);当H2O2浓度达到30 mmol/L时,EGDeΔcodY形成的抑菌圈直径极显著大于EGDe(P≤0.01),约为EGDe的1.7 倍。以上结果表明,CodY的缺失降低了Lm对H2O2的耐受能力,并且随着H2O2浓度的升高,CodY缺失的影响越显著。
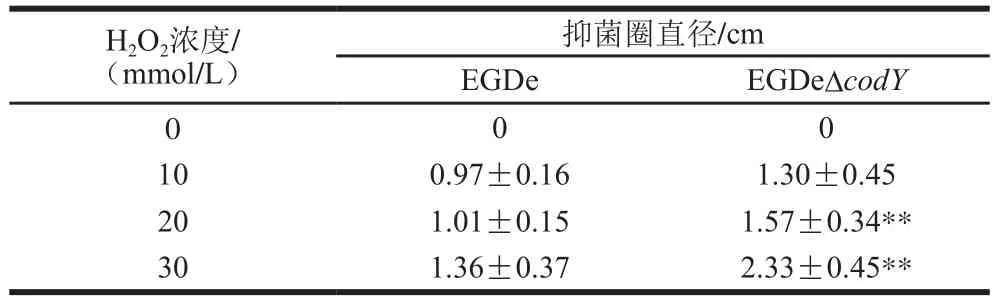
表2 EGDe和EGDeΔcodY在不同浓度H2O2胁迫下抑菌圈大小Table 2 Diameter of inhibition zone of EGDe and EGDeΔcodY when exposed to different concentrations of H2O2
2.2 EGDe和EGDeΔcodY在不同浓度H2O2胁迫下的生长曲线
相比MIC(或MBC)以及抑菌圈实验中所涉及的较低细菌初始浓度(类似实际生产中受Lm污染初期),为了检测较高细菌初始浓度下(如在Lm污染严重时),加入不同浓度H2O2对EGDe和EGDeΔcodY生长繁殖的影响,并为后续实验中比较两株细菌中氧化应激物相关基因转录表达和酶活力差异确定适宜的胁迫浓度,向培养至对数中期的菌液(浓度约为9×1011CFU/mL,体积为100 mL)中分别加入一定量(0.05~2.04 mL)30% H2O2溶液,使菌液中H2O2终浓度分别为5、20、50、100、200 mmol/L,置于37 ℃、200 r/min培养。如图1所示,当H2O2胁迫浓度等于或低于100 mmol/L时,虽然随着H2O2浓度升高,EGDe和EGDeΔcodY生长趋势有所下降,但二者之间并无明显差异。但当H2O2浓度达到200 mmol/L时,EGDe的生长仍呈上升趋势,只是生长速率较之前明显减慢,而EGDeΔcodY生长则受到非常显著的抑制,两菌株的生长曲线存在显著差异,因此选择该胁迫浓度进行后续实验。

图1 EGDe(A)和EGDeΔcodY(B)在不同浓度H2O2胁迫下的生长曲线Fig.1 Growth curves of EGDe (A) and EGDeΔcodY (B) at different concentrations of H2O2
2.3 H2O2胁迫下EGDe和EGDeΔcodY中CAT、SOD活力和GSH含量
如图2A所示,当CodY缺失后,细菌中催化H2O2分解成氧和水的CAT活力明显比野生株EGDe低(P≤0.05)。H2O2胁迫10 min后,野生株EGDe CAT活力开始急剧下降,而EGDeΔcodY中CAT虽有所下降,但并不如EGDe显著。而SOD活力在EGDe和EGDeΔcodY中始终未表现出显著差异,即使是受到H2O2胁迫处理长达40 min(图2B)。细菌体内GSH含量随着H2O2胁迫时间延长总体呈现先下降后上升的趋势,但EGDe内GSH含量始终高于EGDeΔcodY(图2C)。

图2 EGDe和EGDeΔcodY在200 mmol/L H2O2不同胁迫时间下抗氧化应激物酶活和GSH含量的比较Fig.2 Antioxidant parameters in EGDe and EGDeΔcodY after different durations of exposure to 200 mmol/L H2O2
2.4 H2O2胁迫下EGDe和EGDeΔcodY中CAT、SOD和GSH编码基因的转录表达变化
为了进一步研究CAT、SOD和GSH编码基因在EGDe和EGDeΔcodY中的转录表达,以未经H2O2胁迫的EGDe为参照,进行了real-time PCR检测。如图3所示,编码CAT的基因kat以及编码SOD的基因sod的转录表达趋势与其酶活力结果并不完全一致。如图3A所示,kat在两菌株内的相对转录表达水平几乎没有差异,且并不受H2O2胁迫的影响;sod转录水平在EGDe中随着H2O2胁迫时间延长而显著上升,而EGDeΔcodY中sod的转录表达几乎没有变化,因此,sod在两个菌株中的表达差异逐渐增加,当H2O2胁迫40 min时差异达到高度显著(P≤0.001)(图3B)。只有GSH合成酶基因gshF在两株细菌中的相对转录表达趋势基本与其含量变化一致,且更加明显和稳定。如图3C所示,缺失CodY后,细菌体内的gshF的表达显著降低,在H2O2胁迫10 min和20 min时差异极显著(P≤0.01),但随着胁迫时间延长,野生株中gshF的表达下降,差异不再显著。

图3 CAT、SOD和GSH编码基因受到200 mmol/L H2O2不同时间胁迫后在EGDe和EGDeΔcodY中的相对表达水平Fig.3 Relative transcriptional expression of kat (A), sod (B) and gshF (C)in EGDe and EGDeΔcodY after different durations of exposure to 200 mmol/L H2O2
2.5 H2O2胁迫对EGDe和EGDeΔcodY基因组DNA稳定性的影响
氧化胁迫会造成细菌DNA受损,但细菌能够通过激活DNA修复机制维持DNA稳定性(GTS)。为了深入研究CodY在细菌受到氧化胁迫后对维持细菌基因组DNA稳定性的作用,利用RAPD技术检测并统计电泳后EGDe和EGDeΔcodY多态性条带数,计算和分析H2O2胁迫对细菌基因组DNA稳定性的影响。如表3所示,经200 mmol/L H2O2胁迫20 min后,EGDe基因组DNA的GTS降为未受胁迫时的93.1%,而EGDeΔcodY的GTS下降更低,为未受胁迫时的80.0%。表明在H2O2胁迫下,CodY缺失显著影响了Lm基因组的稳定性,细菌DNA受到氧化胁迫后损伤更严重。
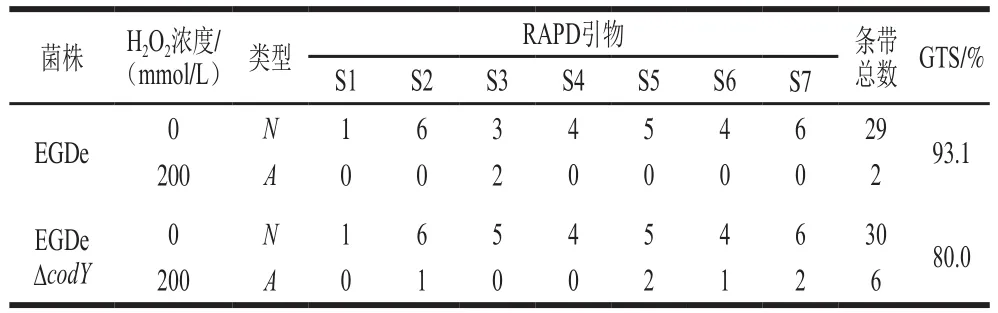
表3 H2O2胁迫下EGDe和EGDeΔcodY GTS比较Table 3 Comparison of genomic DNA template stability of EGDe and EGDeΔcodY under H2O2 stress
Lm能够通过激活SOS反应进行DNA损伤修复,参与SOS反应的重要基因包括recA、lexA、recR、lmo1302和lmo1975等。为进一步探究CodY在DNA损伤修复中的作用,利用real-time PCR技术,检测EGDe和EGDeΔcodY中参与SOS反应的上述基因在H2O2胁迫前后的转录表达水平。如图4所示,与未受H2O2胁迫的EGDe(即胁迫0 min)相比,H2O2胁迫20 min后,SOS反应诱导物编码基因recA与DNA聚合酶IV的编码基因lmo1975在EGDe中的转录表达水平呈现高度显著提高(P≤0.001),而在EGDeΔcodY中的表达则正好相反,呈现高度显著降低(P≤0.001)。同时,SOS反应阻碍物编码基因lexA及其基因家族调节子编码基因lmo1302以及SOS反应激活因子编码基因recR的转录表达水平在EGDe中没有明显变化,但在EGDeΔcodY中表现出高度显著降低(P≤0.001)。以上结果表明,在H2O2胁迫下,CodY会快速激活Lm中recA和lmo1975的转录表达,参与修复损伤的基因组DNA;而CodY的缺失会造成上述Lm中参与SOS反应的所有重要基因(recA、lexA、recR、lmo1302、lmo1975)的转录表达显著下调,从而显著影响细菌的DNA损伤修复能力,造成细菌基因组DNA的稳定性下降。
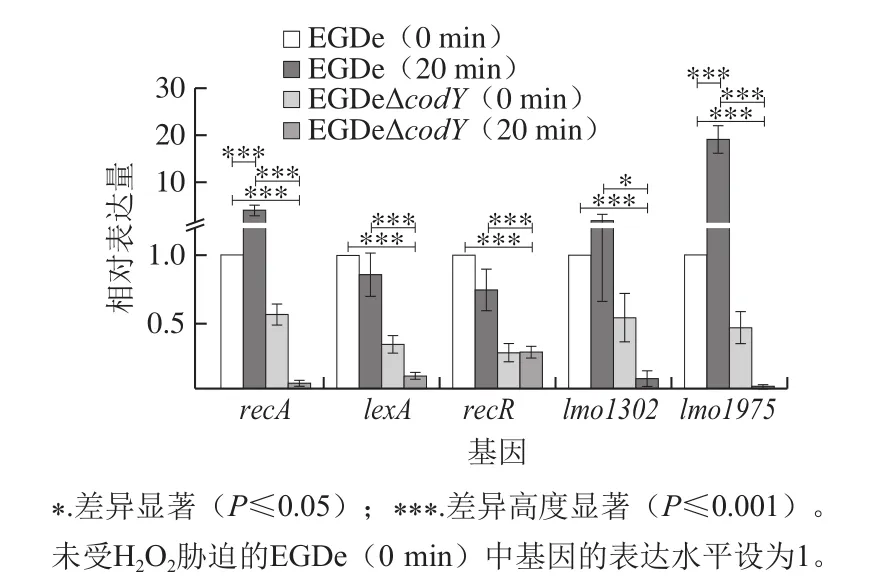
图4 200 mmol/L H2O2胁迫下EGDe和EGDeΔcodY中基因相对表达水平Fig.4 Relative transcriptional expression of recA, lexA, recR, lmo1302,lmo1975 in EGDe and EGDeΔcodY after different durations of exposure to 200 mmol/L H2O2
3 讨 论
作为普遍存在于低G+C含量革兰氏阳性菌中的全局转录调控因子,CodY参与了细菌多种代谢途径以及生理过程的调控。本研究通过实验证实CodY可能通过调节Lm中氧化应激物的转录表达或者酶活力水平以及SOS反应中重要基因的表达,直接或者间接帮助细菌抵抗环境中氧化胁迫而生存下来。
CodY缺失后,即使在正常条件下(没有氧化胁迫),EGDeΔcodY中GSH含量低于野生菌株EGDe;当受到H2O2胁迫后,GSH的转录表达水平在EGDeΔcodY中下降更为明显,极显著低于在EGDe中的水平,表明CodY对细胞中谷胱甘肽含量具有重要的调控作用。通过生物信息学分析,发现Lm中编码合成GSH的基因gshF的启动子区存在CodY结合位点,即CodY-box(AATTGGTAGAAATT)[14],因此认为CodY可能直接与gshF启动子结合,调控GSH在细菌受到氧化胁迫后的表达水平,帮助细菌抵御氧化损伤。而CAT和SOD的编码基因kat和sod启动子区没有发现合适的CodY-box,而且在H2O2胁迫前后,尽管CAT活力呈现下降趋势,但其转录表达在EGDe和EGDeΔcodY中并没有显著变化,说明CodY对其并没有调控作用,或者作用很弱。氧化胁迫下SOD活力在EGDe和EGDeΔcodY中始终未表现出显著差异,但编码基因sod的转录表达在EGDe和EGDeΔcodY中差异高度显著(P≤0.001)。该结果的产生,一方面是可能存在的转录后修饰或者翻译水平的修饰使得RNA和蛋白质的表达并不能一一对应[24]。例如,Archambaud等[25]报道Lm中的SOD活性可通过改变其丝氨酸和苏氨酸残基的磷酸化修饰进行调控。另外,SOD活力与H2O2浓度之间也存在较为复杂的关系:氧化环境使细菌内过量富集ROS,SOD能够催化超氧根阴离子(O2-)发生歧化反应,进而生成H2O2和O2:2O2-+2H+→H2O2+O2,产物H2O2随后被CAT还原为H2O和O2[26],然而过量的H2O2又会抑制SOD活力[27]。而本研究直接使用H2O2作为氧化胁迫物,这样便使得菌体内富集过量H2O2,因此EGDe中其sod转录水平呈上升趋势,转录后阶段又会受到过量的H2O2的抑制。
H2O2胁迫还会导致细菌DNA受到损伤。SOS反应是细菌重要的应激机制,在DNA损伤修复方面有重要作用,作为调节SOS反应的两种关键酶,RecA和LexA分别起诱导和抑制SOS反应的作用[10]。DNA未受损伤的情况下,LexA结合到SOS-box并抑制SOS诱导的蛋白转录;DNA受到损伤后,RecA与ssDNA(单链DNA)结合并形成活性核蛋白,导致LexA蛋白水解并激活SOS调控的基因表达。同时,部分细菌中存在Com系统(competence system)能够促进外源DNA的摄取,在DNA修复过程中有着重要作用[28]。对于枯草芽孢杆菌Com系统已有较多研究,其中,该细菌Com系统中的ComK与CodY能够竞争性结合comK启动子,当CodY结合时抑制转录,进一步抑制recA的表达,阻止SOS反应;当CodY解除对comK的抑制作用时,recA转录表达被激活,从而激发SOS反应[29]。Lm中也存在Com系统,且与枯草芽孢杆菌的com基因有相似的表达机制[28]。因此,可能类似于枯草芽孢杆菌,当Lm受氧化胁迫后,其CodY对comK抑制作用消除,从而诱导DNA修复基因recA表达,同时DNA聚合酶IV等多种酶协助启动因受损停滞的DNA复制叉[30],激活SOS反应通路。值得注意的是,受氧化胁迫后,EGDeΔcodY中SOS反应重要基因recA、lexA、recR、lmo1302、lmo1975并没有因为CodY的缺失而表现出上调,反而受到极显著抑制。出现这种现象的原因可能与CodY在Lm中起到的全局性调控作用有关,此前研究已证明CodY的缺失会造成Lm生长缓慢、毒力减弱以及运动能力降低[19],说明CodY对维持细菌正常生命活动以及侵染宿主具有重要作用,而EGDeΔcodY由于完全失去了CodY的调控,细菌在自身生理活性减弱的同时又受到H2O2的胁迫,生命活动处于严重失衡状态,极可能影响氧化胁迫下SOS反应中基因的表达,导致recA、lexA、recR、lmo1302、lmo1975基因表达下调。
综上所述,氧化环境中EGDe相比于EGDeΔcodY有更强的耐受能力。CodY帮助Lm提高GSH等抗氧化应激物水平来直接清除菌体内的ROS,以及调控SOS反应通路直接或者间接抵御氧化胁迫造成的DNA损伤。本研究探究了CodY在Lm中抗氧化应激作用方式,为深入理解革兰氏阳性菌抵抗氧化胁迫而生存的复杂调控机制提供依据。
