鱼皮明胶和多酚组装行为与相互作用
2021-07-28王舒雅赵靖昀代亚磊梁宏闪李述刚
王舒雅,赵靖昀,代亚磊,高 瑾,梁宏闪,李述刚,周 彬,3,
(1.湖北工业大学生物工程与食品学院,发酵工程教育部重点实验室,湖北 武汉 430068;2.华中农业大学食品科学技术学院,湖北 武汉 430070;3.国家外国专家局/教育部“细胞调控与分子药物”学科创新引智基地(“111”基地),湖北 武汉 430068)
明胶具有优良的乳化性、凝胶性、成膜性、发泡性等性能,在食品和医药工业中得到了广泛的应用[1]。然而,近年来传统动物明胶在食品中的应用面临着严峻的挑战。疯牛病、口蹄疫、禽流感等动物传染病的频繁发生,导致了动物源明胶的安全问题[2-3]。因此,开发具有较高生物安全性和接受性的新型明胶成为当前的迫切需要。
随着中国水产养殖和渔业的迅速发展,水生动物明胶凭借其优良的安全性、低致敏性、低抗原性、高溶解性和易水解性的优点受到科研工作者和企业的关注。多年来,我国水产品产量均居世界第一。水产品加工业每年都会产生大量的鱼皮废料[4-5],如果不加以有效开发利用,不仅会造成资源的极大浪费,还会造成严重的环境污染。然而,目前对鱼皮明胶(fish skin gelatin,GLA)的研究多集中于提取工艺的优化,或利用其优异的成膜性制备膜材料等较为单一的研究[6]。因此,研究GLA与食品组分,如多酚、多糖等之间的相互作用及对其功能特性的调控行为,对拓宽其在食品领域的应用具有重要意义。
多酚是广泛存在于食品体系中的功能性小分子化合物,在食品生产加工及人体消化过程中,植物多酚可通过疏水键或氢键与多糖、蛋白质等大分子物质发生相互作用,进而影响生物大分子的功能与营养特性,而且多酚可与蛋白质在形成复合物的过程中起交联作用[7]。且植物多酚凭借其自身的抗氧化、抗炎、抗菌、抗癌、抗病毒等诸多优点,可赋予蛋白、多糖等高分子体系良好的功能特性[8-10],这对于新型食品添加剂与食品配料的开发具有重要的理论指导意义。
本研究选取不同结构的植物多酚(含有不同数目的邻多元酚结构),单宁酸(C76H52O46,tannic acid,TA)、表没食子儿茶素没食子酸酯(C22H18O11,epigallocatechin gallate,EGCG)、没食子酸(C6H2(OH)3COOH,gallic acid,GA)[11]为研究对象,系统研究其与GLA间的相互作用及复合行为。3 种不同结构多酚的化学结构式如图1所示。借助浊度、粒径和荧光光谱等光学手段及等温滴定量热法(isothermal titration calorimetry,ITC),对比研究含有不同数量邻三元酚结构的多酚与GLA之间的相互作用以及形成复合物的行为。本研究期望提高GLA综合利用率及其在食品领域的应用范围,为其开发新型功能食品配料提供数据参考和理论指导,对水产品加工和副产品的利用具有重要意义。

图1 TA、EGCG、GA的化学结构式Fig.1 Chemical structures of TA, EGCG and GA
1 材料与方法
1.1 材料与试剂
GLA(A型,200冻力,巴沙鱼皮中提取) 上海烨熠生物科技有限公司;TA、EGCG、GA 上海阿拉丁生化科技股份有限公司;所用其他试剂均为分析纯。
1.2 仪器与设备
TCM-1000稳态荧光光谱仪 美国新泽西州国际光子技术有限公司;自动ITC 200等温滴定量热仪、Zetasizer Nano-ZS 90纳米粒度测定仪 英国马尔文公司;722s可见分光光度计 上海菁华科技仪器有限公司;Seven Compact精密pH计 瑞士梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 透光率测定
称取适量的明胶加入0.01 mol/L磷酸盐缓冲溶液中,在50 ℃水浴中磁力搅拌30 min,配制10 mg/mL明胶溶液[12]。随后,在磁力搅拌条件下将多酚溶液(TA、EGCG、GA溶液浓度分别为20、40 mmol/L和40 mmol/L)加入明胶溶液中,得到胶体复合物溶液。用分光光度计测定其在波长500 nm处的透光率。
1.3.2 粒径
采用Zetasizer Nano-ZS 90激光纳米粒度仪测定胶体复合物的粒径大小与分布情况。
1.3.3 荧光光谱分析
参照Joye等[13]的方法,荧光测量用稳态荧光光谱仪进行测量。荧光实验在恒温条件下进行,恒温水浴温度分别为298 K和308 K,恒温12 min后,立即扫描溶液的荧光光谱。实验参数:荧光灯功率75 W、激发波长280 nm、采集发射信号300~400 nm、步阶2 nm。
1.3.4 ITC
采用自动ITC 200等温滴定量热仪分析TA、EGCG、GA与GLA结合的热力学过程。分别配制10 mg/mL的GLA溶液、1 mmol/L的TA溶液、10 mmol/L的EGCG溶液、20 mmol/L的GA溶液,避光保存在4 ℃冰箱中备用。参比室注入去离子水作为热平衡对照,用微量注射器将GLA溶液缓慢注入到样品池中,避免产生气泡,若有气泡需将气泡排除。注射器中注入TA溶液(或EGCG、GA溶液),分20 次单独注射将多酚溶液注入至样品池中,每滴5 μL,搅拌速率为250 r/min,温度设置为298 K[14]。
1.4 数据处理
2 结果与分析
2.1 多酚溶液对复合体系透明度的影响
多酚和蛋白质可通过疏水相互作用、氢键等作用力自组装形成各种聚集体或微纳结构[15]。考察多酚-GLA比例对体系透明度的影响,由图2可知,随着多酚添加量的增加(尤其是TA和EGCG体系),多酚-GLA复合溶液由最初的无色透明逐渐呈现出微蓝色乳光。微蓝色乳光的出现说明随着多酚的添加,体系中的GLA和多酚通过相互作用逐步组装为微纳结构。且随着体系中多酚含量的增加,微蓝色乳光愈发明显,说明GLA与多酚形成的微纳组装体的数量、粒径均发生了一定的变化。对比分析3 种多酚对体系透明度的影响规律发现,TA浓度为0.2 mmol/L时即出现微蓝色乳光。且随着TA添加量的进一步增加,体系透明度显著下降。而EGCG体系中透明度下降较为缓慢,在多酚浓度约为0.8 mmol/L时才出现肉眼可见的浑浊现象。对于GA体系而言,随着GA添加量的增加,混合溶液的透明度并未出现显著下降,均呈现澄清透明的状态。究其原因是蛋白质与多酚之间可通过氢键、疏水相互作用、静电相互作用等形成复合物。如明胶分子中含有氨基、羧基和羟基等基团可以与多酚结构的酚羟基发生非共价相互作用,在明胶分子之间形成网状结构,最终在低浓度下形成分散的纳米复合物[16]。而明胶与多酚形成复合物的程度取决于多酚的分子质量,分子质量越小,酚羟基的数目越少,与明胶发生碰撞时,结合能力越弱[17]。就本研究中的3 种多酚而言,TA含有大量酚羟基,且其结构类似5 个悬臂,并具有一定的柔性,可看作是一种多位点的交联剂,可与不同明胶分子或同一明胶分子的不同位点结合,更易形成蛋白-多酚复合物。EGCG相比于TA,其酚羟基较少,虽亦可作为交联剂,但交联作用弱于TA。而GA只含有一个苯环,其上相邻含有3 个酚羟基,该结构整体刚性较强,导致3 个酚羟基不能像TA和EGCG一样容易与明胶分子作用,且位阻作用也阻碍了GA分子与不同的明胶分子发生作用。推测GA分子更倾向吸附于单个明胶分子上,故不易于产生交联作用形成复合物。
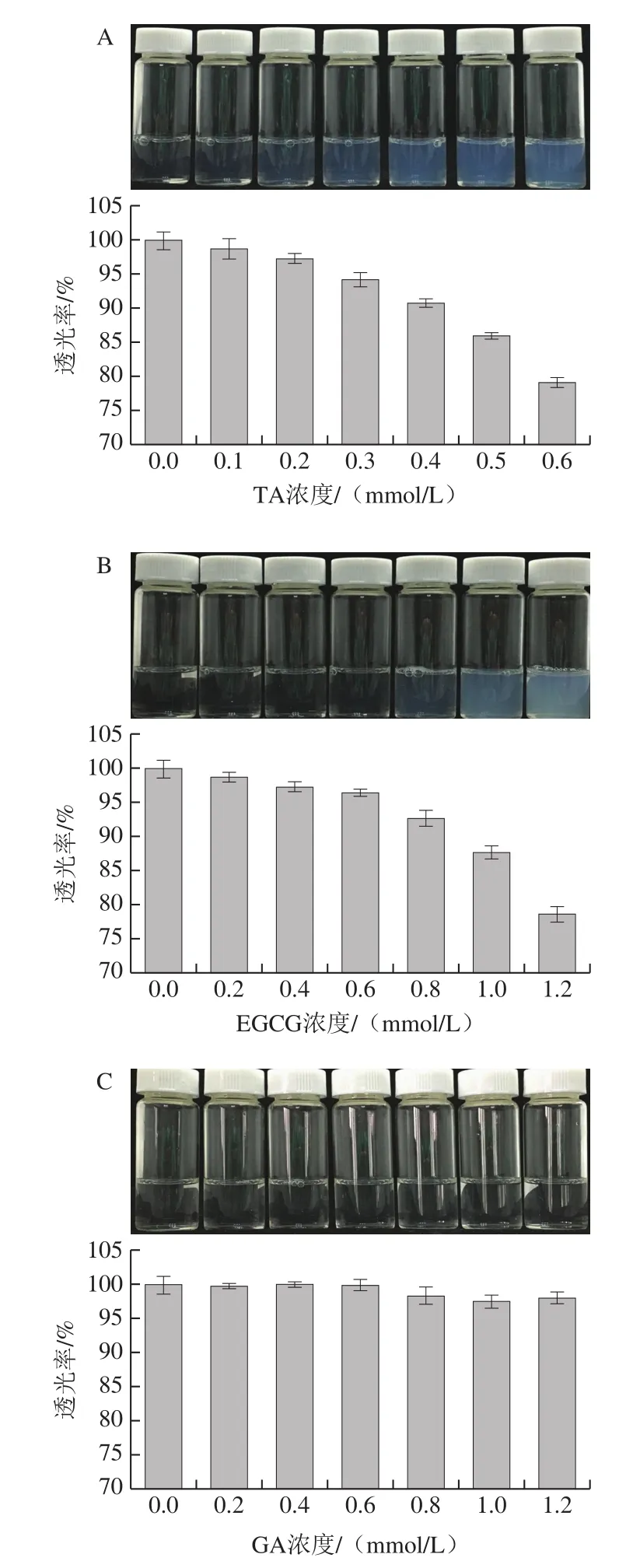
图2 GLA溶液中添加不同浓度的TA(A)、EGCG(B)和GA(C)对透明度的影响Fig.2 Influence of concentration of TA (A), EGCG (B) and GA (C) on the transmittance
2.2 pH值和循环次数对溶液体系可逆性的影响
反应体系的pH值显著影响多酚和蛋白质的聚集行为,不同多酚与蛋白质都有它们最适合的pH值络合点[18]。蛋白质可以在其等电点上下进行质子化和去质子化转变,所以体系pH值对多酚与GLA复合物的形成具有显著影响。本研究通过调节多酚-GLA复合溶液的pH值以考察pH值对二者相互作用的影响规律。如图3A所示,EGCGGLA体系随着pH值的增加其透光率逐渐下降,在达到pH 6.5左右时趋于平稳。而TA-GLA体系在pH值约为5.5时达到最小值之后,随着pH值的进一步升高,体系透光率呈现出回升的趋势。A型巴沙鱼GLA的等电点在7~9之间[19],可能是TA与GLA之间较强的相互作用使二者形成复合物,TA上大量的酚羟基和羰基使复合物等电点向低pH值方向移动。由图3A可知,在低于复合物等电点时,体系pH值升高逐渐逼近复合物的等电点时,斥力减小,多酚-GLA复合物间的聚合动力大于其间的阻力,更加容易聚集形成聚集体,导致体系透明度下降。而高于复合物等电点后,逐渐远离等电点使体系静电斥力逐渐增大,减少了物质碰撞形成聚集体的几率,故而在远离等电点时透光率又逐步回升。而EGCG-GLA间的相互作用弱于TA-GLA,且其负电性亦相对较弱,所以pH值对EGCG-GLA体系的透明率影响程度也相对较小。通过反复调节pH值发现,TA-GLA和EGCG-GLA体系中多酚与GLA的组装行为表现出稳定的可逆性(图3B、C),显示这2 种体系具有良好的pH值响应性。
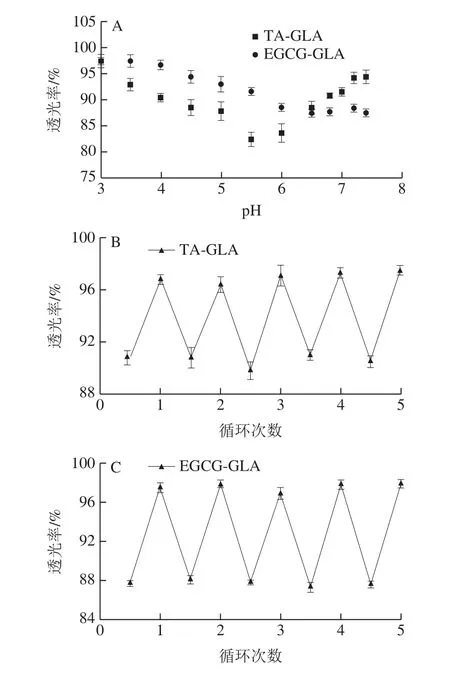
图3 TA-GLA和EGCG-GLA复合物的透光率随pH值(A)和循环次数(B、C)的变化Fig.3 Transmittance of TA-GLA and EGCG-GLA complexes as a function of pH (A) and cycle number (B and C)
2.3 pH值对多酚-GLA复合物粒径的影响
由于GA和GLA体系未形成蛋白-多酚复合物,故只探讨pH值对TA-GLA和EGCG-GLA复合物粒径的影响规律。由图4可知,在pH 4.5、5.5和6.8时TA-GLA和EGCGGLA粒径均呈现单峰分布,且粒径分布较窄。在相同pH值条件下,TA-GLA复合物比EGCG-GLA复合物的粒径更大,这是由于TA与GLA之间具有更多的结合位点,更易形成复合物且粒径相对较大。然而,当pH 7.4时,TAGLA和EGCG-GLA复合物粒径均呈现双峰。这可能是由于pH值的增加导致二者所带电荷的变化,且较高的pH值会破坏氢键相互作用,进而导致复合物的不均一性。

图4 pH值对TA-GLA(A)和EGCG-GLA(B)粒径分布的影响Fig.4 Particle size distribution of TA-GLA (A) and EGCG-GLA (B)complexes at different pH
2.4 多酚对GLA荧光光谱的影响
2.4.1 荧光光谱分析
蛋白质分子中的芳香族氨基酸残基、色氨酸、酪氨酸和苯丙氨酸,能够在一定波长光源的激发下发射荧光,色氨酸、酪氨酸和苯丙氨酸残基因为生色基团不同而分别在348、303 nm和282 nm波长处出现荧光峰。由于蛋白质分子中苯丙氨酸残基的荧光极弱且易被猝灭,荧光的产生主要是酪氨酸和色氨酸[20]。在280 nm激发波长下,GLA的最大发射波长为304 nm,且在348 nm波长处未见荧光峰出现,且A型巴沙鱼GLA中几乎不含色氨酸,酪氨酸含量为1.61%[21],故本研究主要观察酪氨酸荧光信息的变化。
固定GLA质量浓度,变化TA、EGCG和GA浓度,在300~400 nm范围内扫描荧光发射光谱。由图5可知,在298 K和308 K条件下,随着TA、EGCG和GA溶液添加量的增加,GLA发射峰的荧光强度呈现持续下降趋势,说明多酚与GLA之间发生相互作用,使GLA的内源荧光规律性下降。对比分析3 种多酚对GLA内源荧光的猝灭行为,发现3 种多酚对GLA的荧光猝灭能力为TA>EGCG>GA。结果表明,TA比EGCG、GA更多地使处于疏水环境中酪氨酸暴露,导致GLA荧光强度的减弱。同时,GLA的最大发射波长发生微弱红移。研究表明,蛋白质分子最大荧光发射波长的变化,在一定程度上能够反映蛋白质分子中荧光发色基团本身及其周围环境的变化[22],多酚的加入使GLA荧光发射峰产生位移,说明酪氨酸残基的亲水性增强,其肽链的伸展程度也有所增加,导致最大发射波长的变化[23]。多酚使GLA中更多的酪氨酸残基暴露,肽链更加舒展,导致最大发射波长向长波方向移动。

图5 多酚浓度变化的荧光发射扫描光谱图Fig.5 Fluorescence emission scanning spectra with varying polyphenol concentration
2.4.2 猝灭类型的确定
多酚等物质与蛋白结合的荧光猝灭机理主要分为动态猝灭和静态猝灭,二者的主要区别是对温度和黏度的依赖性不同[24]。静态猝灭是指多酚与GLA形成无荧光或弱荧光的复合物而导致的,猝灭常数随着温度的升高而降低;而动态猝灭是多酚和蛋白质分子之间相互碰撞引起的,猝灭常数随着温度升高而增大。分析多酚等物质和蛋白质的荧光猝灭机制时采用Stern-Volmer方程[25]:

式中:F0、F分别为单宁酸等多酚猝灭剂加入前后的荧光强度;[Q]为单宁酸等猝灭剂浓度/(mol/L);Ksv、Kq分别为猝灭常数和猝灭速率常数;τ0为猝灭剂不存在时生物大分子的平均寿命,生物大分子的平均寿命约为10-8s。
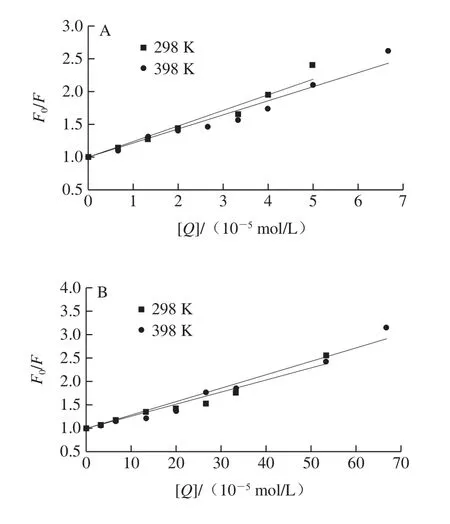
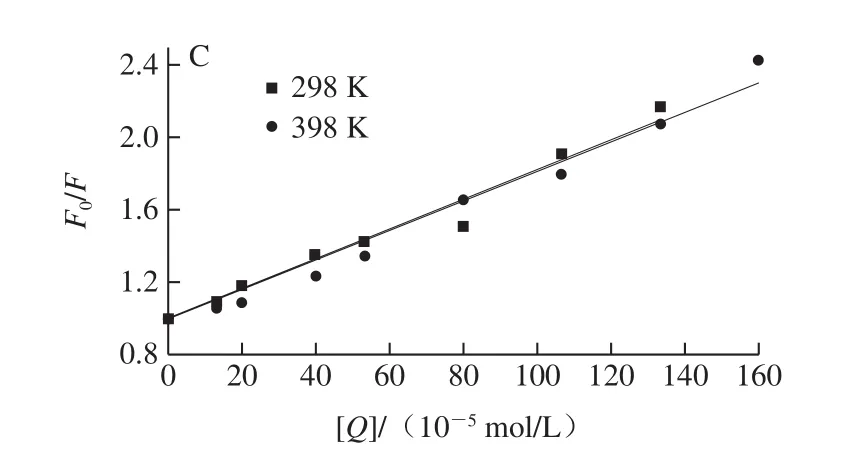
图6 TA-GLA(A)、EGCG-GLA(B)和GA/GLA(C)相互作用的Stern-Volmer曲线Fig.6 Stern-Volmer curves for TA-GLA (A), EGCG-GLA (B) and GA/GLA (C) interaction
如图6所示,根据数据绘制Stern-Volmer曲线,计算Ksv和Kq数据(表1),在多酚作用范围内曲线都具有良好的线性关系。由表1可知,随着处理温度的升高,Ksv值却随之下降,说明3 种多酚和GLA相互作用的猝灭机制可能均为静态猝灭而不是动态猝灭。另外,各类猝灭剂对生物大分子的最大扩散碰撞猝灭常数为2.0×1010L/(mol•s),而多酚对GLA的动态猝灭速率常数Kq的数量级达到了1012~1013,即便是GA组也接近1012L/(mol•s),远高于猝灭剂对生物大分子的最大扩散碰撞猝灭常数。这些结果进一步证实了TA、EGCG、GA对GLA的荧光猝灭机制是静态猝灭。其中Ksv和Kq为TA>EGCG>GA。因为TA具有最多的酚羟基及苯环结构,且分子柔性较高,容易与酪氨酸结合形成弱荧光物质,导致GLA荧光猝灭最为严重,而GA的酚羟基与苯环结构最少,对GLA荧光猝灭能力最弱。

表1 不同温度下多酚与GLA相互作用的Stern-Volmer猝灭常数Table 1Stern-Volmer quenching constants for interactions between polyphenols and GLA at different temperatures
2.4.3 多酚与GLA的结合常数及结合位点数

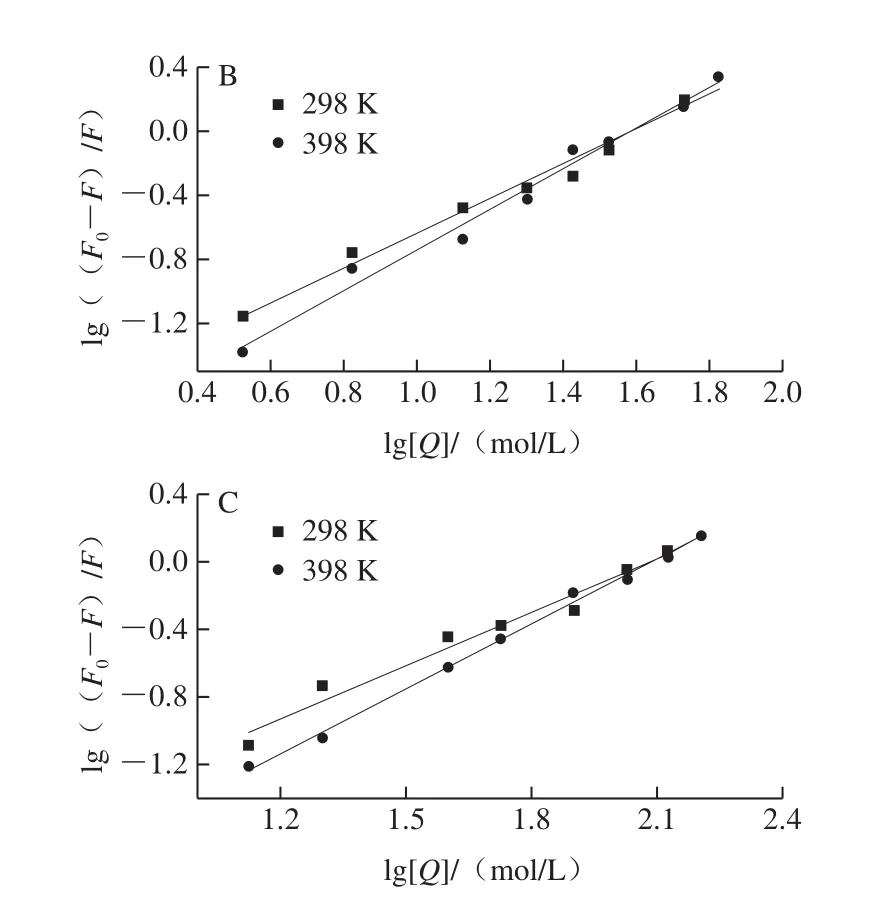
图7 TA-GLA(A)、EGCG-GLA(B)和GA/GLA(C)相互作用的双对数曲线Fig.7 Double logarithmic curves for TA-GLA (A), EGCG-GLA (B) and GA/GLA (C) interaction
对于静态猝灭,TA、EGCG和GA与GLA的结合常数可由方程[26](2)确定:
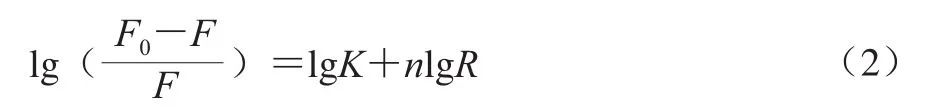
绘制双对数曲线如图7所示,y轴的截距可以得到结合常数K的信息,斜率表示可用的结合位点数n。结果见表2,3 种多酚与GLA的结合位点数都接近于1,随着温度的升高,结合位点数增加,表明升高温度,有助于多酚和GLA发生相互作用。通过比较结合常数K的值,发现TA与GLA的结合常数显著大于EGCG和GA,GA与GLA的结合常数最小,说明多酚和GLA的结合作用强弱为TA>EGCG>GA。

表2 多酚-明胶复合物的表观结合常数、结合位点数及线性相关系数Table 2 Apparent binding constants, binding site numbers and correlation coefficients for polyphenol-GLA complexes
2.5 ITC结果
ITC能够直接测定出2 种物质相互作用的热力学参数,如结合焓(ΔH)、结合熵(ΔS)等信息(表3)。对于作用力类型的判断,研究表明:当ΔH>0、ΔS>0时,主要作用力为疏水作用力;当ΔH<0、ΔS>0时,静电作用力起主要作用;当ΔH<0、ΔS<0时,氢键和范德华力起主要作用[27]。

表3 多酚(TA、EGCG)与GLA蛋白相互作用的热力学参数Table 3 Thermodynamic parameters for interaction between polyphenols and GLA
如图8所示,图上半部分为原始数据,纵坐标表示补偿加热丝补偿给样品池和参与池的热量速率差。图下半部分为积分结果,纵坐标表示每次滴加产生的热流差对时间的积分。TA与GLA相互作用的反应热为负值导致峰向下[28],说明二者的结合过程是放热反应。反应热ΔH值最大,表明二者发生相互作用时放热最多,相互作用力最强,同时还发现结合常数值最大进一步证明TA和GLA的相互作用最强[29]。ΔG为负值表明TA和GLA的反应是自发进行的,反应的熵值为负值,说明GLA与TA之间的相互作用为熵驱使,氢键和范德华力在反应中起主要作用。

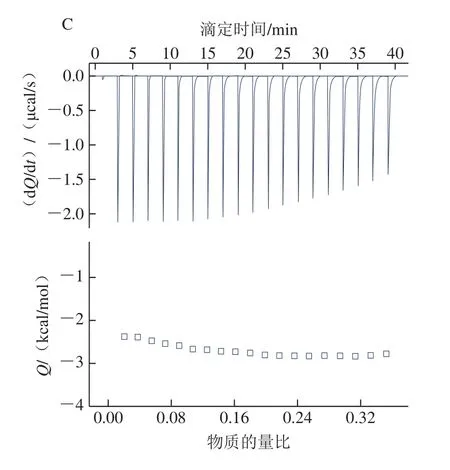
图8 TA(A)、EGCG(B)、GA(C)与GLA相互作用的等温滴定量热图Fig.8 Isothermal titration calorimetry plots for interaction of TA (A),EGCG (B) and GA (C) with GLA
在EGCG-GLA相互作用中可以看出,结合常数K和ΔH绝对值均小于TA-GLA,说明EGCG与GLA的结合能力低于TA与GLA的结合能力,放出的热量少于TA。有研究报道明胶与多酚的结合能力与多酚的分子质量有关系,分子质量越小,酚羟基数量越少,与明胶的结合能力就越弱[30],TA的摩尔质量(1 701.20 g/mol)大于EGCG(458.37 g/mol),因此GLA与TA的结合强于与EGCG的结合。另外,GLA与EGCG的ΔG为负值,表明明胶与EGCG之间的相互作用也可自发进行。熵值为正值,表明EGCG与GLA是焓驱使[31],观察熵值和焓值可以得出静电作用是主要结合力。对于GA-GLA体系,不断增加GA浓度仍不能在ITC测试中使二者反应热达到平衡,不能拟合出合理的相关热力学参数,故GA-GLA体系的相关参数未在此列出。
3 结 论
本研究通过浊度和粒径分析、光谱学(荧光光谱)和热力学(ITC)手段探究不同结构的多酚与GLA之间的相互作用。结果显示,在一定浓度下,TA和EGCG均可以和GLA发生相互作用形成纳米复合物,导致溶液体系透明度的变化,而GA虽也可与GLA发生相互作用,但不能产生宏观上浊度的明显变化。其中TA与GLA形成复合物的能力最强。且TA和EGCG与GLA形成的纳米复合物可以随着pH值的变化实现可逆沉降。通过荧光光谱法和ITC得出,3 种多酚和GLA均可以形成弱荧光的复合物,猝灭类型为静态猝灭;TA、EGCG和明胶的作用均是可自发进行的放热反应,氢键和范德华力是TA-GLA相互作用的主要结合力,静电作用是EGCG-GLA相互作用的主要结合力,这为多酚明胶胶体配合物的制备提供了重要信息,对GLA和多酚的利用具有重要意义。
