参芪解郁方对母婴分离产后抑郁大鼠磁共振波谱的干预作用研究
2021-07-27王岳青曲淼茹尘邓璐瑶谢颖桢
王岳青 曲淼 茹尘 邓璐瑶 谢颖桢
〔摘要〕 目的 通過应用磁共振波谱(magnetic resonance spectroscopy, MRS)观察母婴分离产后抑郁大鼠脑组织内代谢物的浓度,探索参芪解郁方对母婴分离产后抑郁大鼠模型的干预作用。方法 SD孕鼠72只,孕16 d,随机分为正常组、模型组、参芪解郁方组、盐酸氟西汀组,共4组,每组18只,模型组、参芪解郁方组、盐酸氟西汀组,采用母婴分离法制备产后抑郁大鼠模型,在产后1~21 d每日分离4 h。造模结束后,分别给予双蒸水、参芪解郁方、盐酸氟西汀灌胃,正常组给予等容双蒸水灌胃,再设1、2、4周3个时点,分别对大鼠进行行为学测试,并于第4周采用MRS定量检测技术扫描各组大鼠双侧海马、前额叶皮质的N-乙酰天冬氨酸(N-acety1 aspartate, NAA)、含胆碱化合物(choline, Cho)、肌醇(myo-inositol, mI)、肌酸(creatine, Cr)以及谷氨酸(glutamate, Glu),测定NAA、Cho、G1u及mI相对浓度变化,计算NAA/Cr、Cho/Cr、Glu/Cr及mI/Cr的比值。结果 行为学结果:与正常组相比,模型组大鼠各时点的不动时间均明显增加(P<0.01),挣扎时间、游泳时间、旷场实验总分、蔗糖水消耗、进入开放臂的次数比例(OE/TE)和进入开放臂的时间比例(OT/TT)明显降低(P<0.01);与模型组相比,参芪解郁方组、盐酸氟西汀组大鼠各时点的不动时间明显减少(P<0.01);挣扎时间、游泳时间、旷场实验总分、蔗糖水消耗、OE/TE和OT/TT明显升高(P<0.01)。MRS结果:与正常组相比,模型组大鼠双侧前额叶皮质、海马的NAA/Cr、Cho/Cr明显降低(P<0.01),Glu/Cr明显升高(P<0.01);与模型组相比,参芪解郁方组、盐酸氟西汀组大鼠双侧海马NAA/Cr、Cho/Cr值显著升高(P<0.01)。结论 参芪解郁方可以调节母婴分离PPD模型大鼠的抑郁样行为,修复PPD受损神经元,促进神经重塑,调节谷氨酸能系统及膜磷脂代谢,从而对PPD发挥治疗作用。
〔关键词〕 母婴分离;产后抑郁;磁共振波谱;参芪解郁方
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.03.003
〔Abstract〕 Objective To observe brain metabolites changes in rats with maternal and infant separation post-partum depression (PPD) and effects of Shen-Qi-Jie-Yu-Fang (SJ Fang) on maternal and infant separated PPD rat model by magnetic resonance spectroscopy (MRS). Methods 72 pregnant SD rats on the 16th day of pregnancy were randomly divided into four group, normalgroup, model group, SJ Fang group and fluoxetine group, and with 18 rats in each group. Model group, fluoxetine group, and SJ Fang group were created in SD rats by suffered with maternal infant separation stress (MISS). They were separated daily for 4 hours from 1 to 21 day postpartum. After the modeling, rats were given intragastric administration with SJ Fang, fluoxetine and distilled water, normal group was given equal volume double distilled water. Behavioral tests were conducted at 3 time points at 1st, 2nd, 4th week, respectively. At the 4th week, the N-acety1 aspartate (NAA), choline (Cho), myo-inositol (mI), creatine (Cr) and glutamate (Glu) in the bilateral hippocampus and prefrontal cortex of rats in each group were scanned by MRS quantitative detection technology. Changes in the relative concentrations of NAA, Cho, G1u and mI were determined, and the ratios of NAA/Cr, Cho/Cr, Glu/Cr and mI/Cr were calculated. Results Behavioral results: compared with the normal group, the immobility time of model group was significantly increased at each time point (P<0.01), while the struggle time, swimming time, total score of open field experiment, sucrose water consumption, the proportion of times entering the open arm (OE/TE) and the proportion of open entries/total entries (OT/TT) were significantly decreased (P<0.01); compared with model group, both fluoxetine group and SJ Fang group decreased immobility time (P<0.01), increased swimming time, struggling time, sucrose consumption, OT/TT and OE/TE (P<0.01). MRS results: compared with normal group, NAA/Cr, Cho/Cr in bilateral prefrontal cortex and hippocampus of model group were significantly decreased (P<0.01), and Glu/Cr was significantly increased (P<0.01); compared with model group, the values of NAA/Cr and Cho/Cr in bilateral hippocampus of rats in SJ Fang group and fluoxetine group were significantly increased (P<0.01). Conclusion SJ Fang could regulate the depression-like behavior of maternal and infant separation PPD model rats, repair PPD damaged neurons, and promote neural remodeling, regulate glutamatergic system and membrane phospholipid metabolism, and thus play a therapeutic role in PPD.
〔Keywords〕 maternal and infant separation; post-partum depression; magnetic resonance spectroscopy; Shen-Qi-Jie-Yu-Fang
产后抑郁症(postpartum depression, PPD)是与分娩相关的暂时性重度抑郁症发作,是全球范围内女性常见的精神心理问题之一,其发病率约为13%~19%[1]。有相关研究[2]已经证实,PPD直接影响产妇的生活质量,如果不及时治疗,可使产妇出现精力下降、注意力不集中、睡眠障碍,甚至影响母婴关系,严重者诱发产妇杀婴和自杀。因此,了解PPD的病理生理过程具有重要意义。
磁共振波谱(magnetic resonance spectroscopy, MRS)作为一种无创性的功能影像技术,可以测量脑组织内多种代谢物的水平,对大脑功能进行定性及定量分析,课题组前期[3-4]采用MRS对脑卒中后抑郁和广泛性焦虑大鼠脑内形态学进行探索性研究两种模型的大鼠均存在脑组织形态学的改变及神经元的损伤,相比之下,采用MRS技术研究PPD尚处于早期阶段,PPD发病与脑内代谢物浓度的改变有待进一步研究。因此,本研究以脑代谢水平为切入点,采用母婴分离法制备产后抑郁大鼠模型,以中药参芪解郁方为干预手段,利用MRS技术定量分析PPD大鼠前额叶皮质和海马脑组织内的相关能量代谢物,揭示PPD大鼠的脑功能变化,并以补益心脾方药参芪解郁方对PPD大鼠进行干预,从大鼠脑代谢水平及不同时间点的行为学等相关指标,阐释参芪解郁方对PPD大鼠的干预机制,为临床提供治疗思路和理论依据。
1 实验材料
1.1 实验动物
采用SPF级,Sprague-Dawley孕鼠,孕16 d购于北京维通利华实验动物技术有限公司[动物许可证:SCXK(京)2016-0006]。母鼠仅在怀孕期间给予繁殖营养饲料,产后则给予普通饲料。实验过程中动物自由摄食和饮水(蔗糖水消耗实验除外),室内安静,光照周期为12 h(7:00~19:00),室温 20~22 ℃,相对湿度为60%~70%。
1.2 实验药物
参芪解郁方由党参12 g、黄芪20 g、炒枣仁 30 g、當归15 g、郁金15 g、山茱萸肉30 g、陈皮 10 g、佛手9 g组成[4]。参芪解郁方中药配方颗粒购于北京中医药大学第三附属医院,按成人用量7倍计算大鼠用量,生药配比1.25 g/mL,溶于双蒸水,于4 ℃冰箱贮存备用,临用前加热。盐酸氟西汀胶囊购买于礼来苏州制药有限公司(20 mg×7粒,批号:0943A),60 kg体质量成人用量20 mg/d,按成人用量的7倍计算大鼠每天用量为0.25 g/100 g,临用时溶于双蒸水中,浓度为0.25 mg/mL。
2 实验方法
2.1 动物分组与造模
孕16 d SD大鼠,单笼饲养,购入后适应性喂养3 d,3 d后进行旷场测试,根据评分结果筛选72只合格孕鼠,并随机分为正常组、模型组、参芪解郁方组和盐酸氟西汀组,共4组。每组再设处理后第1、2、4周观察时间点,各组不同时间点设大鼠6只。
造模方法参照实验进行,采用母婴分离应激法制备动物模型[5-6],于分娩后第1天至第21天进行母婴分离,每天分离4 h,分离时间为每天上午9:00 至下午1:00,分离时将幼鼠移至另一笼中,分离结束后将幼鼠放回对应母鼠笼子中,对照组幼鼠不做任何处理,所有幼鼠于第22天断乳。造模后1、2、4 周观察模型组与正常组行为学变化,明确造模成功。
2.2 给药方法
于造模结束后进行药物干预,以相当于成人用量的7倍计算,配成419 mg/kg的混悬液(即1剂配方颗粒加100 mL的蒸馏水)药物灌胃体积为1 mL/100 g体质量。参芪解郁方组给予自拟参芪解郁方(该方已提交专利申请,专利号201810157146.5)中药配方颗粒,盐酸氟西汀组予盐酸氟西汀胶囊,正常组和模型组给予等容双蒸水。母鼠灌胃1、2、4周进行行为学实验,灌胃结束后行影像学检测。
2.3 行为学测试
2.3.1 大鼠体质量增长情况 实验开始后,每周监测大鼠体质量,并计算大鼠灌胃1、2、4周的体质量增长情况,根据体质量情况调整药物剂量。
2.3.2 强迫游泳实验 强迫游泳(forced swimming test, FST)实验参照文献[7-8]进行,第1天,将各组大鼠在安静状态下分别置于直径25 cm、高度60 cm、水深35 cm的圆柱形缸内进行预游泳,时间15 min,水温24~25 ℃。结束后,用毛巾擦干鼠毛,将大鼠置于28 ℃的环境中30 min后放回鼠笼。第2天同一时间(24 h后)进行强迫游泳正式实验,在同一时间、同样条件下让待测大鼠游泳5 min,并记录5 min内大鼠呈现的不动状态、挣扎状态、游泳状态的时间,以秒(s)为单位。FST在一定程度上反映了大鼠的抑郁状态。
2.3.3 旷场实验 旷场试验(open field test, OFT)参照文献[9-10]进行,实验装置为旷场箱(100 cm×100 cm×40 cm),四壁涂黑,记录动物穿越方格次数作为水平活动得分,以动物两前肢离地次数作为垂直活动得分,将大鼠放入敞箱中央,记录5 min内大鼠水平活动与垂直活动得分。最后将水平得分和垂直得分相加,记录为旷场试验的总分。
2.3.4 蔗糖水消耗实验 参照文献[11-12]进行,实验前,大鼠禁食禁水24 h,24 h后给予各组大鼠1%的蔗糖水,并计算1 h内每只大鼠自由饮用1%蔗糖水的消耗量。用测量前水瓶液体的体质量减去测量后水平液体的体质量,得出的差值即为蔗糖水消耗量。
2.3.5 高架十字迷宫实验 高价十字迷宫(elevated plus-maze, EPM)是一种经典的非条件性焦虑测试,被广泛用于焦虑相关神经生物学中。参照Marchette等人[13]报道的方法将大鼠面朝闭合臂轻放于中央平台,测试时间5 min,观察指标:进入开放臂的次数(open-arm entries, OE)、时间(open-arm time, OT)和进入闭合臂的次数和时间。计算出OE占进入两臂总次数(total entries, TE)的百分比OE/TE和0T占在两臂中停留的总时间(total time, TT)的百分比OT/TT。
2.4 MRS测定
2.4.1 动物准备 动物腹腔麻醉下,俯卧位置于扫描床上,头部固定,在大鼠躯干覆盖棉布保温,连接呼吸监控接收装置。扫描过程中保持室内温度在20~22 ℃,同时监测大鼠的呼吸频率,使其保持在70~80次/min之间。
2.4.2 磁共振波谱测定 在双侧海马及双侧前额叶皮质部位,分别选择一3 mm×3 mm×3 mm大小的立方体感兴趣区,因为有临床和神经影像学证据证据表明抑郁症患者这一区域的功能神经化学发生了改变[14-15],经匀场和抑水后,采用PRESS序列采集1H谱,谱宽1 500 Hz,采样点数2 048,TR=2 500 ms,TE=20 ms,累加次数500次,所得1H谱经傅立叶变换,基线校正后,指定水峰的化学位移为4.77 ppm,从而确定2.02 ppm的N-乙酰天冬氨酸(NAA)、3.0 ppm的肌酸(Cr)、3.22 ppm的胆碱化合物(Cho)、2.35 ppm的谷氨酸(Glu)及3.56 ppm的肌醇(mI)等信号。测定这些谱峰的高度,计算NAA/Cr、Cho/Cr、Glu/Cr、MI/Cr。
2.5 统计学处理
采用统计软件SPSS 26.0及Graphpad prism 8.0进行统计分析处理,所得数据以“x±s”表示。计量资料先进行正态性检验,符合正态分布且方差齐时,多组组间比较采用one-way ANOVA检验分析,组间两两比较采用LSD检验。不符合正態分布者进行数据转化使其符合正态分布或采用非参数检验。显著性水准取α=0.05,以P<0.05为差异有统计学意义。
3 结果
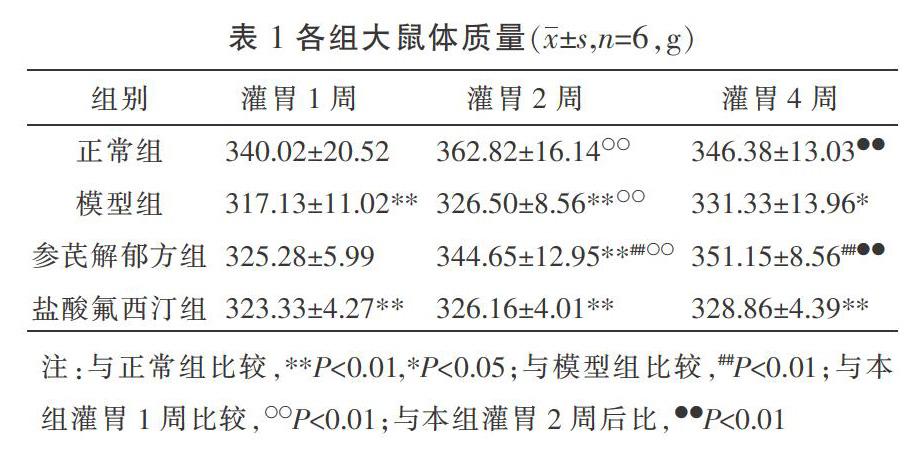
3.1 各组大鼠产后体质量比较
在灌胃1、2、4周后,与正常组相比,模型组大鼠体质量明显下降(P<0.05)。灌胃1周后,与模型组相比,参芪解郁方组、盐酸氟西汀组体质量增加,但差异无统计学意义(P>0.05);治疗2周后,参芪解郁方组与模型组相比较,差异有统计学意义(P<0.01),盐酸氟西汀组与模型组相比较差异无统计学意义(P>0.05);治疗4周后,参芪解郁方组与模型组相比较,差异有统计学意义(P<0.01)。正常组、模型组、参芪解郁方组灌胃2周后体质量明显上升(P<0.01);正常组、参芪解郁方组灌胃4周后体质量较灌胃2周明显上升(P<0.01)。各时间点参芪解郁方组与盐酸氟西汀组相比差异无统计学意义(P>0.05)。见表1。
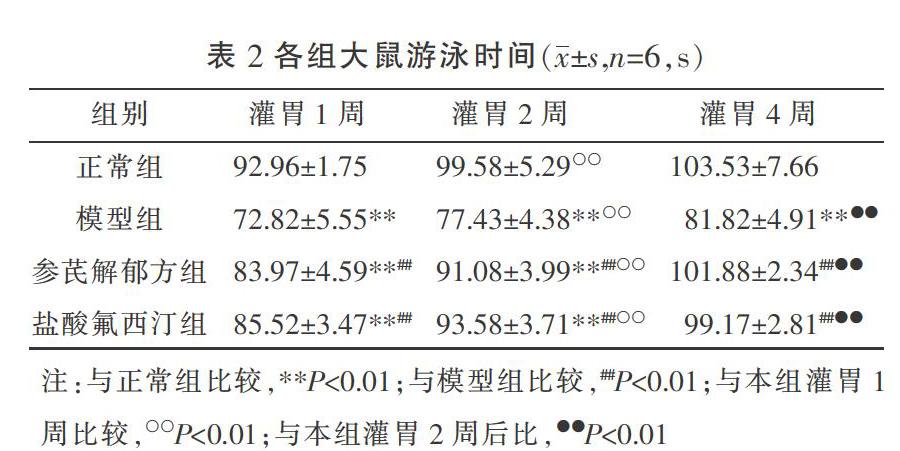
3.2 各组大鼠产后游泳时间比较
灌胃1、2、4周后,与正常组相比,模型组大鼠的游泳时间显著降低,差异有统计学意义(P<0.01)。与模型组相比,参芪解郁方组、盐酸氟西汀组游泳时间显著增加,差异有统计学意义(P<0.01)。正常组、模型组、参芪解郁方组、盐酸氟西汀组灌胃2周较灌胃1周游泳时间明显增加(P<0.01);正常组、模型组、参芪解郁方组、盐酸氟西汀组灌胃4周较灌胃2周游泳时间明显增加(P<0.01)。各时点参芪解郁方组与盐酸氟西汀组相比差异无统计学意义(P>0.05)。见表2。
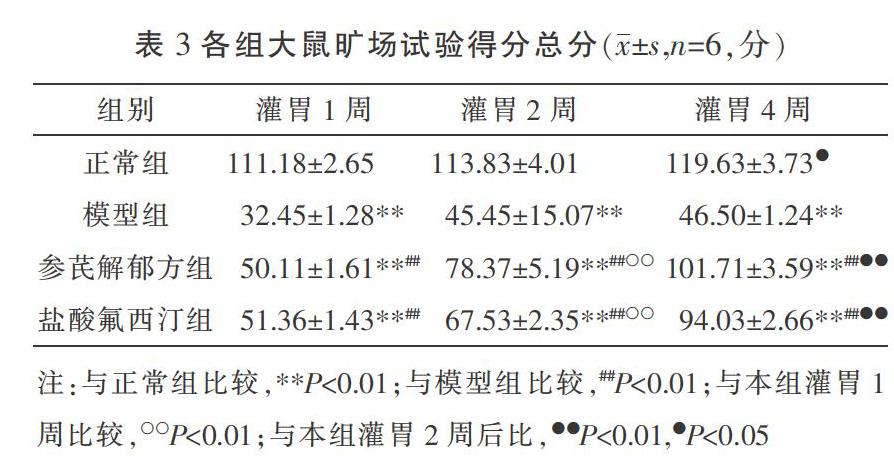
3.3 各组大鼠OFT总分比较
灌胃1、2、4周后,与正常组相比,模型组大鼠旷场试验总分显著降低(P<0.01);与模型组相比,参芪解郁方组、盐酸氟西汀组灌胃2周较灌胃1周旷场试验得分总分明显增加(P<0.01);正常组、参芪解郁方组、盐酸氟西汀组灌胃4周较灌胃2周旷场试验得分总分明显增加(P<0.01,P<0.05)。各时点参芪解郁方组与盐酸氟西汀组相比差异无统计学意义(P>0.05)。见表3。
3.4 各组大鼠的蔗糖水消耗比较
灌胃1、2、4周后,与正常组相比,模型组大鼠各时间点蔗糖水消耗显著降低(P<0.01),说明抑郁模型复制成功。与模型组相比,参芪解郁方组、盐酸氟西汀组蔗糖水消耗明显增加,差异有统计学意义(P<0.01)。参芪解郁方组、盐酸氟西汀组灌胃2周较灌胃1周蔗糖水消耗明显增加(P<0.01);正常组、参芪解郁方组、盐酸氟西汀组灌胃4周较灌胃2周旷场蔗糖水消耗明显增加(P<0.01)。各时间点参芪解郁方组与盐酸氟西汀组相比差异无统计学意义(P>0.05)。见表4。
3.5 各组大鼠0T/TT比较
灌胃1、2、4周后,与正常组相比,模型组0T/TT显著降低(P<0.01),说明模型复制成功;与模型组相比,参芪解郁方组、盐酸氟西汀组0T/TT比值明显增加,差异有统计学意义(P<0.01)。正常组、参芪解郁方组、盐酸氟西汀组灌胃2周较灌胃1周0T/TT明显增加(P<0.01);正常组、参芪解郁方组、盐酸氟西汀组灌胃4周较灌胃2周0T/TT明显增加(P<0.01)。各时间点参芪解郁方组与盐酸氟西汀组相比差异无统计学意义(P>0.05)。见表5。
3.6 各组大鼠双侧前额叶皮质、海马的脑代谢物浓度
与正常组相比,模型组大鼠双侧前额叶皮质的NAA/Cr、Cho/Cr值明显下降,Glu/Cr明显升高,差异有统计学意义(P<0.01或P<0.05)。与模型组相比,参芪解郁方组、盐酸氟西汀组NAA/Cr、Cho/Cr值显著升高、Glu/Cr值显著降低,差异有统计学意义(P<0.01或P<0.05);参芪解郁方组与盐酸氟西汀组相比差异无统计学意义(P>0.05)。见表6。
与正常组相比,PPD模型组大鼠双侧海马的NAA/Cr、Cho/Cr值明显下降,差异有统计学意义(P<0.01或P<0.05)。与模型组相比,参芪解郁方组、盐酸氟西汀组双侧海马NAA/Cr、Cho/Cr值显著升高(P<0.01)。参芪解郁方组与盐酸氟西汀组相比差异无统计学意义(P>0.05)。见表7。
4 讨论
在中医理论中,产后抑郁可归属“郁病”“百合病”的范畴。中医传统理论认为气血亏虚贯穿于产后病的始终,气机失调是产后精神障碍类疾病发病的重要原因。肝处中焦,为一身气机之枢纽,气血的运行,情志的条畅,均取决于肝主疏泄功能的正常。产后气血亏虚,运行无力,气机不畅,心神失养,因虚致实,产生气滞痰瘀等时邪,又兼有情志不舒,使浊毒瘀滞脑络而诱发郁病。而气郁日久又会导致气血耗伤,因实致虚,从而迁延难愈。本病多本虚标实,与心、肝、脾等脏腑功能失调密切相关,治当补血养心、解郁醒神,故立参芪解郁方。
4.1 参芪解郁方对PPD大鼠行为学的调节作用
本实验采用母婴分离应激诱导母鼠出现抑郁症的典型症状来制备产后抑郁动物模型,母婴分离动物模型是将母鼠和仔鼠进行为期21 d的分离应激是一种较为成熟的公认的产后抑郁大鼠模型[16-17],已经得到广泛应用。课题组前期[18-20]在母婴分离应激后,成功制备了产后抑郁的动物模型,经测试,产后抑郁模型的大鼠蔗糖水消耗降低,旷场试验中水平和垂直活动次数减少,这与产后抑郁患者的临床症状相近。因此,本研究继续采用此种造模方法。本研究结果发现PPD模型组大鼠的不动时间较正常组增加,游泳时间、OFT总分、蔗糖水消耗、进入OE/TE比例较正常组减少,而中药参芪解郁方能够有效改善上述指标,提示中药对焦虑、抑郁情绪具有明显的治疗作用,且随着治疗时间的延长,治疗效果逐渐显著。
4.2 参芪解郁方对PPD大鼠脑内代谢物浓度的影响
MRS是基于磁共振成像,利用化学位移作用,测定人体内能量代谢及进行化合物定量分析的一种技术,是目前唯一显示活体组织代谢的无创影像学方法[21-22]。它不仅能够对能量代谢水平进行量化,而且还可以为我们提供神经元完整性和神经递质可用性的参数,因此,它也可以用来评价大鼠空间学习和记忆能力。本研究采用MRS检测PPD大鼠前额叶皮质及海马区域代谢物的浓度,并从脑代谢的角度观察参芪解郁方对PPD发生发展的干预作用。
NAA是1H-MRS谱中观察到的主峰,是神经元、轴突结构完整性的标志[23],NAA的减少可以反映神经元细胞死亡或功能障碍[24]。本研究觀察到PPD模型组大鼠双侧前额叶皮质、海马区域的NAA的浓度显著下降,可能提示PPD大鼠存在神经元密度降低、完整性丧失以及空间学习和记忆能力下降,这与目前的大多数研究结果大致相似[25-27]。其机制可能与糖皮质激素水平升高有关,已有研究表明,慢性生理或心理压力会刺激糖皮质激素的分泌[28]。大量观察表明[29-31],糖皮质激素治疗可抑制齿状回的神经发生,减少海马、前额叶皮质神经元树突萎缩、突触丢失,最终恢复神经元功能,在MRS上可表现为NAA增加Cho是与情绪、认知密切相关的神经递质乙酰胆碱的前体[32],是情感障碍发生的病理生理基础,也是神经细胞膜磷脂代谢的一部分。本研究发现PPD模型组大鼠双侧前额叶皮质、海马的Cho/Cr值降低,与既往多项研究结果一致[33-34],分析其可能原因为产后抑郁作为一种慢性应激造成脑内细胞膜磷脂代谢异常,影响细胞内信号转导,从而阻碍情绪调节环路神经元功能的实现,导致抑郁症状,但也可能是多种代谢物异常的综合作用所致,需要进一步研究来进行证实。
Glu被认为是抑郁症的潜在生物标志物[35],关于PPD脑内代谢物Glu/Cr的变化,目前尚无统一结论,本研究结果显示,双侧海马的Glu/Cr显著升高,双侧前额叶皮质的Glu/Cr降低,这可能与所测脑区的不同有关,有相关研究[36]指出大鼠体内海马区域代谢物浓度的变化可能与其他区域不同,海马和前额叶皮质内Glu/Cr变化提示PPD大鼠体内兴奋性氨基酸与抑制性氨基酸递质相对浓度失去平衡,佐证了谷氨酸能系统障碍在产后抑郁的病理生理中所发挥的重要作用。
mI被认为神经胶质细胞的标志物,它的升高通常被解释为反映了细胞内信号转导系统的紊乱和胶质细胞功能障碍[37],mI的代谢水平的常与重度抑郁密切相关[30]。本研究发现在PPD大鼠双侧海马和前额叶皮质的mI无明显变化,这可能与该组大鼠正处于产后抑郁的早期有关,但本研究认为其对于PPD早期预示并无明确相关性。
参芪解郁方由党参、黄芪、炒枣仁、当归、郁金、山茱萸肉、陈皮、佛手组成,具有补血养心、解郁醒神之效,课题组前期动物实验和临床研究从脑内单胺类神经递质水平及其代谢产物变化、T细胞免疫调节等方面论述了参芪解郁方的确切疗效。本研究主要从脑代谢的角度分析参芪解郁方的作用机制,结果显示,与模型组相比,中药参芪解郁方组能够升高NAA/Cr、Cho/Cr,降低Glu/Cr值,提示参芪解郁方可修复受损的神经元,促进神经的重塑,调节膜磷脂的代谢、兴奋性神经递质和抑制性神经递质浓度,这可能是其发挥抗抑郁作用、改善产后抑郁症状的主要机制。
綜上所述,本研究结果表明产后抑郁脑内代谢物浓度的改变,海马及前额叶皮质神经元的损伤,胆碱物质的代谢异常,以及谷氨酸能系统异常等病理过程。本研究通过采用MRS技术观察参芪解郁方对PPD大鼠的干预作用,参芪解郁方作用特点为多靶点、多途径、整体调节,能够明显改善产后抑郁症状,且其对于情绪调节环路神经元的功能修复和保护的作用尤为突出,值得推广应用于临床。
参考文献
[1] OHARA M W, MCCABE J E. Postpartum Depression: Current Status and Future Directions[J]. Annu Rev Clin Psychol, 2013, 9: 379-407.
[2] WISNER K L, SIT D K, MCSHEA M C, et al. Onset timing, thoughts of self-harm, and diagnoses in postpartum women with screen positive depression findings[J]. JAMA Psychiatry, 2013, 70(5): 490-498.
[3] 张 媛.颐脑解郁方对脑出血后抑郁、焦虑、痴呆大鼠脑功能影像的干预作用研究[D].北京:北京中医药大学,2018.
[4] 王 娆.疏肝清热健脾法对广泛性焦虑模型大鼠脑磁共振波谱的干预作用研究[D].北京:北京中医药大学,2015.
[5] WANG Q, LI M, DU W, et al. The different effects of maternal separation on spatial learning and reversal learning in rats[J]. Behavioural Brain Research, 2015, 280: 16-23.
[6] 王 丹,赵瑞珍,李小黎,等.补益心脾法对产后抑郁症患者中医证候积分以及雌、孕激素的影响[J].北京中医药大学学报,2015,38(11):772-776.
[7] PORSOLT R D, BERTIN A, JALFRE M. Behavioral despair in mice: A primary screening test for antidepressants[J]. Archives Internationales De Pharmacodynamie et De Therapie, 1977, 229(2): 327-336.
[8] MUIR J, LOPEZ J, BAGOT R C. Wiring the depressed brain: Optogenetic and chemogenetic circuit interrogation in animal models of depression[J]. Neuropsychopharmacology, 2019, 44(6): 1013-1026.
[9] KUNIISHI H, ICHISAKA S, YAMAMOTO M, et al. Early deprivation increases high-leaning behavior, a novel anxiety-like behavior, in the open field test in rats[J]. Neuroscience Research, 2017, 123: 27-35.
[10] STURMAN O, GERMAIN P L, BOHACEK J. Exploratory rearing: A context- and stress-sensitive behavior recorded in the open-field test[J]. Stress, 2018, 21(5): 443-452.
[11] WILLNER P, MUSCAT R, PAPP M. Chronic mild stress-induced anhedonia: A realistic animal model of depression[J]. Neuroscience & Biobehavioral Reviews, 1992, 16(4): 525-534.
[12] DELBENDE C, TRANCHAND BUNEL D, TAROZZO G, et al. Effect of chronic treatment with the antidepressant tianeptine on the hypothalamo-pituitary-adrenal axis[J]. European Journal of Pharmacology, 1994, 251(2/3): 245-251.
[13] MARCHETTE R C N, BICCA M A, SANTOS E C D S, et al. Distinctive stress sensitivity and anxiety-like behavior in female mice: Strain differences matter[J]. Neurobiology of Stress, 2018, 9: 55-63.
[14] TIAN L, PU J C, LIU Y Y, et al. Metabolomic analysis of animal models of depression[J]. Metabolic Brain Disease, 2020, 35(6): 979-990.
[15] RASHIDI-RANJBAR N, RAJJI T K, KUMAR S, et al. Frontal-executive and corticolimbic structural brain circuitry in older people with remitted depression, mild cognitive impairment, Alzheimers dementia, and normal cognition[J]. Neuropsychopharmacology, 2020, 45(9): 1567-1578.
[16] 李净娅,章正祥,戚观树,等.母婴分离方法制备产后抑郁大鼠模型的行为学及海马病理变化的观察[J].浙江临床医学,2018,20(6):991-993.
[17] VON POSER TOIGO E, DIEHL L A, FERREIRA A G, et al. Maternal depression model: Long-lasting effects on the mother following separation from pups[J]. Neurochemical Research, 2012, 37(1): 126-133.
[18] 趙瑞珍,杨歆科,唐启盛,等.参芪解郁方对产后抑郁大鼠脑组织ER表达分布的干预研究[J].北京中医药,2013,32(3):195-199.
[19] 曲 淼,李净娅,唐启盛,等.Treg/Th17平衡对产后抑郁大鼠的影响及参芪解郁方的细胞免疫调节作用[J].中华中医药杂志,2015,30(5):1452-1458.
[20] QU M, TANG Q S, LI X L, et al. Shen-Qi-Jie-Yu-Fang has antidepressant effects in a rodent model of postpartum depression by regulating the immune organs and subsets of T lymphocytes[J]. Neuropsychiatric Disease and Treatment, 2015, 11: 1523-1540.
[21] LI Y, ZHANG C C, WEIDACKER K, et al. Investigation of anterior cingulate cortex gamma-aminobutyric acid and glutamate-
glutamine levels in obsessive-compulsive disorder using magnetic resonance spectroscopy[J]. BMC Psychiatry, 2019, 19(1): 1-9.
[22] RASHIDI-RANJBAR N, MIRANDA D, BUTTERS M A, et al. Evidence for structural and functional alterations of frontal-executive and corticolimbic circuits in late-life depression and relationship to mild cognitive impairment and dementia: A systematic review[J]. Frontiers in Neuroscience, 2020, 14: 253.
[23] ERBAY M F, ZAYMAN E P, ERBAY L G, et al. Evaluation of transcranial magnetic stimulation efficiency in major depressive
disorder patients: A magnetic resonance spectroscopy study[J]. Psychiatry Investigation, 2019, 16(10): 745-750.
[24] BARTNIK-OLSON B L, ALGER J R, BABIKIAN T, et al. The clinical utility of proton magnetic resonance spectroscopy in traumatic brain injury: Recommendations from the ENIGMA MRS working group[J]. Brain Imaging and Behavior, 2020: 1-12.
[25] TAE W S, KIM S S, LEE K U, et al. Progressive decrease of N-acetylaspartate to total creatine ratio in the pregenual anterior cingulate cortex in patients with major depressive disorder:
Longitudinal 1H-MR spectroscopy study[J]. Acta Radiologica, 2014, 55(5): 594-603.
[26] 黄小燕,顾晓丽,沈小勇,等.产后抑郁症患者海马氢质子磁共振波谱分析[J].医学影像学杂志,2019,29(2):184-186.
[27] ROSA C E, SOARES J C, FIGUEIREDO F P, et al. Glutamatergic and neural dysfunction in postpartum depression using magnetic resonance spectroscopy[J]. Psychiatry Research Neuroimaging, 2017, 265: 18-25.
[28] FAURHOLT-JEPSEN M, MISKOWIAK K W, FROST M, et al. Patient-evaluated cognitive function measured with smartphones and the association with objective cognitive function, perceived stress, quality of life and function capacity in patients with bipolar disorder[J]. International Journal of Bipolar Disorders, 2020, 8(1): 31.
[29] KHAN A R, HANSEN B, DANLADI J, et al. Neurite atrophy in dorsal Hippocampus of rat indicates incomplete recovery of chronic mild stress induced depression[J]. NMR in Biomedicine, 2019, 32(3): e4057. DOI:10.1002/nbm.4057.
[30] CONRAD C D, ORTIZ J B, JUDD J M. Chronic stress and hippocampal dendritic complexity: Methodological and functional considerations[J]. Physiology & Behavior, 2017, 178: 66-81.
[31] XIE Y H, ZHOU C N, LIANG X, et al. Anti-Lingo-1 antibody ameliorates spatial memory and synapse loss induced by chronic stress[J]. Journal of Comparative Neurology, 2020: 112765.
[32] CARRERA I, RICHTER H, MEIER D, et al. Regional metabolite concentrations in the brain of healthy dogs measured by use of short echo time, single voxel proton magnetic resonance spectroscopy at 3.0 Tesla[J]. American Journal of Veterinary Research, 2015, 76(2): 129-141.
[33] 毛 寧,刘泉源,王 静,等.青少年抑郁症前额叶的磁共振波谱研究[J].实用医学杂志,2014,30(15):2394-2394.
[34] 郭志勇,谭西英,刘丽娇,等.氟西汀对脑卒中后抑郁患者海马磁共振氢质子波谱影响的研究[J].中国实用神经疾病杂志,2017,20(12):11-14.
[35] CHEN G H, YANG D Y, YANG Y T, et al. Amino acid metabolic dysfunction revealed in the prefrontal cortex of a rat model of depression[J]. Behavioural Brain Research, 2015, 278: 286-292.
[36] AKIMOTO H, OSHIMA S, OHARA K, et al. High-resolution magic-angle spinning-1H-NMR spectroscopy-based metabolic profiling of hippocampal tissue in rats with depression-like symptoms[J]. Biological & Pharmaceutical Bulletin, 2017, 40(6): 789-796.
[37] KIM S Y, CHOI C B, LEE H S, et al. Reversal of myo-inositol metabolic level in the left dorsolateral prefrontal cortex of rats exposed to forced swimming test following desipramine treatment: An in vivo localized 1H-MRS study at 4.7T[J]. Magnetic Resonance Imaging, 2010, 28(10): 1461-1467.
