糙米结合酚的分离纯化、结构表征及体外抗氧化活性
2021-07-27冯芝英张名位张瑞芬刘磊池建伟董丽红贾栩超
冯芝英,张名位,张瑞芬,刘磊,池建伟,董丽红,贾栩超
(1.华南农业大学食品学院,广东广州 510642)(2.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)
全谷物是指完整、碾成粉状、碎块状或压成片状的谷物颖果,其胚乳、胚芽和糠麸的比例与在完整颖果中的比例基本相同[1]。流行病学研究表明,摄入全谷物食品具有预防多种慢性疾病的生理功效,如降低心血管疾病、肥胖症、2型糖尿病和结肠癌等风险[2,3]。
糙米是稻谷仅经脱壳处理,保留米糠层和胚芽的大米,是一种典型的全谷物食品[4]。糙米中除含有丰富的膳食纤维外,还含有生育酚、生育三烯酚、植物甾醇、γ-谷维素和酚类物质等活性成分,其中酚类物质是糙米发挥健康效应的重要活性物质[5,6]。糙米中的酚类物质主要以游离态、可溶酯化态和不溶结合态三种形式存在[7]。蔬菜水果中只有24%的酚酸物质以结合态形式存在,而在糙米中这一比例高达88%[8,9]。结合态酚由于其与膳食纤维共价结合,较难直接被释放出来,绝大多数关于酚酸的研究都集中在游离形式上,不溶性酚类物质常被忽视。相关研究已表明结合态酚具有很强的生物活性,包括抗氧化、益生菌、抗癌、抗炎、减肥、降糖等,对中枢神经系统疾病也有一定的治疗作用[10,11]。课题组在前期研究中也发现,结合态酚类物质膳食干预可激活骨骼肌中IRS1/AKT/GLUT4胰岛素信号通路并改变肠道微生物群,从而导致糖尿病db/db小鼠的血糖水平降低[12]。然而关于糙米结合态酚化学组成的研究,目前主要采用高效液相色谱和液相色谱-质谱分析等手段进行结构表征,已鉴定出的化合物包括阿魏酸、对香豆酸、香草酸、丁香酸、对羟基苯甲酸等单体酚酸和8-8'阿魏酸脱氢二聚体(8-8' diferulic acid,DFA)、5-5' DFA、8-O-4' DFA、8-5' DFA、8-8'芥子酸二聚体以及索马榆脂二酸等[13-15]。也有研究对米糠结合酚进行分离纯化并鉴定了10个化合物,化合物的结构类型主要包括酚酸和甾醇类[16]。糙米中结合酚类物质的化学组成仍有待进一步研究探索。
本研究通过碱水解法提取全谷物糙米结合酚,采用多种柱层析色谱分离手段对糙米结合酚提取物进行分离纯化,并借助高分辨质谱、核磁共振等波谱手段对分离得到的单体化合物进行结构表征;以分离得到的单体化合物为标准物质,通过高效液相色谱对米糠结合酚提取物中的色谱峰进行指认和含量测定;并采用DPPH自由基清除法,FRAP和ORAC三种体外抗氧化方法来评价分离得到单体化合物的的抗氧化活性,研究结果将有助于明确糙米结合酚化学物质构成,为糙米功效物质阐明和开发利用提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验材料
本实验的糙米购自黑龙江金都米业有限公司,新鲜的糙米经粉碎、过80目筛,制得糙米粉,用塑料自封袋密封保存4 ℃冷库储藏备用。
1.1.2 试剂
实验中所用试剂二氯甲烷、甲醇、乙酸乙酯、盐酸、氢氧化钠等为天津江天化工有限公司生产,均为分析纯;HPLC级甲醇、乙酸和乙腈购自上海安谱公司;氘代甲醇、二甲基亚砜为美国剑桥公司生产;没食子酸为上海阿拉丁生化科技股份有限公司生产;Trolox试剂、荧光素,DPPH(2,2-二苯基-1-苦基肼),2,2'-偶氮(2-甲基丙脒)盐酸盐(AAPH)购自于美国Sigma公司。FRAP试剂盒购自上海碧云天生物技术有限公司。柱层析硅胶(100~200目)为青岛海洋化工厂生产;反相硅胶Develosil ODS(粒径75 μm)为日本富士化学公司产品;凝胶Sephadex LH-20为瑞典Amersham Biosciences公司生产。
1.1.3 仪器与设备
Waters515中压纯化系统(MPLC),美国沃特斯公司;DPE-1250旋转蒸发仪,日本东京理化公司;Tecan GENios酶标仪,瑞士Tecan有限公司;P3000半制备系统,北京创新通恒科技有限公司;LC2030 PLUS液相色谱仪,日本岛津公司;Cosmosil 5-C18 MS-II(4.6×250 mm,5 μm)色谱柱,赛默飞世尔科技有限公司;YMC-Pack ODS-A(20×250 mm,5 μm)色谱柱,日本YMC股份有限公司;MDS SCIEX APCI 2000 LC-MS-MS,美国Applied Biosystem/MDS Sciex公司;BSZ-100自动部份收集器,上海沪西分析仪器公司;BrukerAVANCE HD 500型超导核磁共振仪,德国布鲁克公司;Bruker Bio TOF IIIQ MS,德国布鲁克公司。
1.2 实验方法
1.2.1 全谷物糙米结合态酚粗提物提取
将110 kg糙米粉用95%乙醇浸泡(3次,每次48 h)去除游离酚,再通过碱解提取结合酚,即在去除游离态酚类物质后的沉淀物中加入2 mol/L NaOH溶液(料液比1:40),充满氮气密封,水浴振荡提取2 h,所得提取液用6 mol/L HCl溶液调节pH至1,然后用乙酸乙酯(1:2)萃取5次,收集合并乙酸乙酯萃取相,经旋转蒸发仪在45 ℃条件下减压浓缩,最终得结合态酚类物质提取物52.1717 g。
1.2.2 全谷物糙米结合态酚粗提物的分离纯化
52.1717 g粗提物经正相硅胶柱层析分离,二氯甲烷/甲醇(10:0~6:4)梯度洗脱,收集流份,薄层色谱检查,合并后得到组分F2~16。F2(16.1699 g)经MPLC分离,流速10 mL/min,甲醇/水(4:6~10:0)梯度洗脱,流份经薄层色谱检查,合并为F2-1~14。F2-2(0.7811 g)经葡聚糖凝胶柱层析分离,甲醇洗脱,流份经薄层色谱检查,合并为F2-2-1~5,F2-2-4(25.9 mg)经HPLC纯化,甲醇/水(11:89)为流动相,流速6 mL/min,得到化合物1(tR75 min,3.7 mg)和化合物4(tR92 min,4.2 mg)。F5-5(0.5892 g)经葡聚糖凝胶柱分离,甲醇洗脱,流份经薄层色谱检查,合并得F5-5-1~3,F5-5-3(85 mg)经HPLC纯化,甲醇/水(23:77)为流动相,流速6 mL/min,得到化合物2(tR102 min,5.3 mg)。F6(7.8679 g)经MPLC分离,流速10 mL/min,甲醇/水(2:8→10:0)梯度洗脱,流份经薄层色谱检查,合并为F6-1~8。F6-3(0.3925 g)经葡聚糖凝胶柱分离,甲醇洗脱,流份经薄层色谱检查,合并为F6-3-1~2,F6-3-2(14.8 mg)经HPLC纯化,甲醇/水(28:72)为流动相,流速6 mL/min,得到化合物3(tR25 min,7.2 mg)。
1.2.3 高效液相色谱条件
Agilent 1260 HPLC系统(配备DAD检测器)和Zorbox SB-C18柱(250×4.6 mm内径,5 μm,USA);柱温为40 ℃,流速为1.0 mL/min,其进样体积为10 μL,流动相包括溶剂A(0.1%乙酸,V/V)和溶剂B(甲醇),洗脱梯度为:溶剂B:0~20 min,10%~50%;检测波长为280 nm。将每个单体化合物作为标准物质,分别配置成6个不同浓度(100~3.125 μg/mL)的标准溶液,将标准溶液和样品溶液(浓度为0.5 mg/mL)分别进样,以标准溶液的浓度为横坐标,相应的峰面积为纵坐标绘制4个化合物的标准曲线,然后根据峰面积外标法定量。
1.2.4 抗氧化活性测定
1.2.4.1 DPPH自由基清除率测定
参考PĺO-LEÓN等[17]的方法并稍作修改,称取4.00 mg DPPH溶解于100 mL 95%乙醇中,即为0.1 mmol/L的DPPH工作液。将4个单体化合物进行梯度稀释,得到不同浓度的样品溶液。取50 μL不同浓度的样品溶液与150 μL DPPH工作液充分混合,室温避光反应30 min,在517 nm波长下测定吸光度A1,同时测定50 μL不同浓度的样品溶液与150 μL 95%乙醇的吸光度A2和50 μL 95%乙醇与150 μL DPPH工作液的吸光度A0,以维生素C做阳性对照,每个样品每个浓度重复3次。按下列公式计算DPPH自由基清除率,同时求得清除率为50%时所需样品的浓度,即IC50值:

其中:A0为150 μL DPPH工作液+50 μL 95%乙醇的吸光度;A1为150 μL DPPH工作液+50 μL不同浓度的样品溶液;A2为150 μL 95%乙醇+50 μL不同浓度的样品溶液。
1.2.4.2 FRAP总抗氧化能力测定
参照董丽红等[18]的方法,样品检测孔内加入5 μL待测样品溶液,空白孔加入5 μL蒸馏水,标准曲线检测孔加入5 μL不同浓度的FeSO4-7H2O标准溶液,再向所有检测孔中加入现配的FRAP工作液180 μL;混匀,37 ℃孵育5 min后,于593 nm波长下测定吸光值,根据标准曲线计算出样品的FRAP值。以Trolox为阳性对照,FRAP结果以每mol化合物中所含的FeSO4-7H2O当量表示,即mmol FeSO4-7H2O/mol。
1.2.4.3 ORAC抗氧化能力测定
参考张名位等[19]的方法,先分别向空白孔加入20 μL 75 mmol/L pH 7.4磷酸盐缓冲液,其余孔分别加入20 μL样品溶液、不同浓度的Trolox标准溶液(6.25~50 μmol/L)以及17.5 μmol/L的阳性对照没食子酸溶液;孵育10 min后,向所有孔加入200 μL 0.96 μmol/L荧光素钠工作液;继续孵育20 min后,除对照孔外,每个孔加入20 μL 119 mmol/L AAPH溶液。最后将96孔板放入酶标仪中,在激发波长485 nm,发射波长520 nm下测定各个孔的荧光值,每4.5 min一次,共循环35次。根据Trolox标准曲线计算样品的ORAC值,ORAC值以每μmol样品中所含的μmol Trolox当量表示,即μmol TE/μmol。
1.2.5 数据分析
每组实验均重复3次,实验结果以均数±标准差表示。利用SPSS 24进行统计分析,检验差异显著性(p<0.05表示差异显著)。
2 结果与讨论
2.1 化合物结构鉴定
2.1.1 化合物结构解析
运用NMR、MS波谱学方法并结合文献中的核磁数据对照,鉴定出化合物1~4为生物碱类化合物,结构如图1所示。
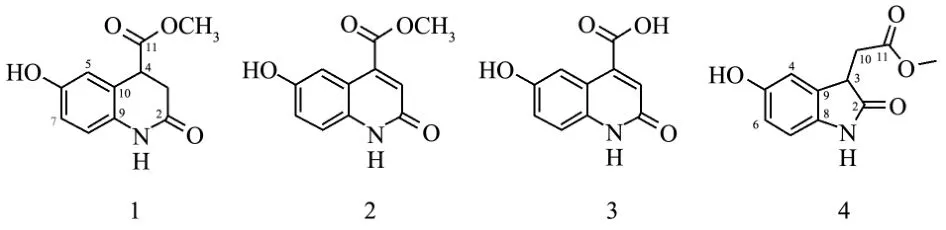
图1 化合物1~4的化学结构Fig.1 Chemical structures of compounds 1~4
化合物1:根据HR-ESI-MSm/z222.0757 [M+H]+(计算值222.0761)准分子离子峰确定分子量为221,分子式为C11H11NO4,不饱和度为7。核磁共振氢谱(表1)显示有1个芳环的ABX耦合信号δ6.76(1H,d,J=2.6 Hz, H-5)、6.73(1H,d,J=8.5 Hz,H-8)、6.67(1H,dd,J=8.5,2.6 Hz,H-7);1个次甲基信号δ3.92(1H,dd,J=6.6,3.5 Hz,H-4),1个亚甲基信号δ2.80(1H,dd,J=16.4,3.5 Hz,H2-3a)和2.73(1H,dd,J=16.4,6.6 Hz,H2-3b),以及1个甲氧基信号δ3.68(3H,s,OCH3)。核磁共振碳谱显示(表1)有6个芳环信号(δ154.6~116.5),1个亚甲基碳信号δ33.6(C-3),1个次甲基碳信号δ43.5(C-4),2个羰基碳信号δ173.8(C-11)、171.6(C-2)和1个甲氧基信号δ52.9,结合分子式中存在一个氮原子,推断结构中存在一个2-喹诺酮母核[20]。根据氢氢相关谱(1H-1H COSY)和异核单量子相关谱(HSQC)谱将碳氢信号进行归属(图2)。在异核多键相关谱(HMBC)谱中(图1),H2-3与δ43.5(C-4)、122.9(C-10)、171.6(C-2)和173.8(C-11)相关,H2-4与δ33.6(C-3)、116.8(C-5)、122.9(C-10)、131.0(C-10)、171.6(C-2)和173.8(C-11)相关,OCH3与173.8(C-11)相关,基于上述信息,鉴定化合物1为6-羟基-2-氧代-1,2,3,4-四氢喹啉-4-羧酸甲酯,结构如图1所示,该化合物为1个新天然产物。

表1 化合物1~4的1H(500 MHz)和13C(125 MHz)NMR数据Table 1 1H (500 MHz) and 13C (125 MHz) NMR data of compounds 1~4

图2 化合物1的1H-1H COSY(粗线)、HMBC(箭头)相关信号Fig.2 1H-1H COSY (bold lines) and HMBC correlations (arrows)correlations of compounds 1
化合物2:根据HR-ESI-MSm/z218.0463 [M-H]-准分子离子峰确定分子量为219,分子式为C11H9NO4,不饱和度为8。分子式与化合物1相比,结构中少了两个氢原子。核磁共振氢谱和碳谱显示化合物2中有1个1,3,4-三取代的苯环、1个双键、两个羰基和1个甲氧基,表现出了与化合物1类似的核磁共振信号,进一步仔细比对两个化合物的核磁数据发现(表1),化合物2中氮杂环的2,3位脱氢形成了双键,化合物的分子式进一步佐证这一推断。与文献[20]报道的数据进行比对,最终确定化合物2为4-羧甲氧基-6-羟基-2-喹诺酮,结构如图1所示。该化合物之前从黑米中分离报道,这是首次从糙米中分离报道该化合物。
化合物3:根据HR-ESI-MSm/z204.0303 [M-H]-和m/z205.0594 [M+H]+准分子离子峰确定分子量为205,分子式为C10H7NO4,不饱和度为8。分子式与化合物2相比,结构中少了一个CH2。核磁共振氢谱和碳谱显示化合物3中同样有1个1,3,4-三取代的苯环、1个双键、两个羰基,表现出了与化合物1类似的核磁共振信号(表1),不同之处是化合物3中少了一个甲氧基的信号,推测该化合物中11位是一个羧酸基团,没有发生甲酯化取代。通过异核单量子相关谱(HSQC)和异核多键相关谱(HMBC)对化合物的数据进行归属。与文献[21]报道的数据进行比对,最终确定化合物3为4-羧基-6-羟基-2-喹诺酮,结构如图1所示,这是首次报道该化合物在氘代二甲基亚砜中的核磁数据。
化合物4:根据HR-ESI-MSm/z220.0589 [M-H]-准分子离子峰确定分子量为221,结合核磁共振氢谱和碳谱推断该化合物的分子式为C11H11NO4,不饱和度为7。分子式与化合物1相同。核磁共振氢谱、碳谱结合异核单量子相关谱(HSQC)显示化合物4中有1个1,3,4-三取代的苯环、1亚甲基、1个次甲基、2个羰基和1个甲氧基,表现出了与化合物1类似的核磁共振信号(表1),与文献[21]报道的数据进行比对,确定化合物4为2-(5-羟基-2-氧代吲哚-3-基)乙酸甲酯,结构如图1所示。
2.1.2 化合物的波谱数据
生物碱类是自然界中广泛存在的一大类活性天然产物,结构类型丰富多样。本研究从全谷物糙米中分离得到的主要包括喹诺酮类(1-3)和吲哚类(4)。化合物1为新天然产物,未有相关研究报道其化学结构和核磁数据。Chung等[20]从黑米的糊粉层提取物中分离得到了化合物3,这是首次从糙米中报告该化合物。前人从米糠提取物中分离报道过化合物2和4,并推断这两个化合物是植物内源生长素3-吲哚乙酸的代谢产物[21]。4个化合物的波谱数据如表1所示。
2.2 单体化合物的定性定量分析
以分离得到的单体化合物1~4为标准物质,通过HPLC对糙米结合酚提取物中的主要色谱峰进行指认,结果如图3所示,化合物1~4的保留时间分别为13.02,18.6,8.6,14.5 min。通过外标法对4个化合物的含量进行测定,结果表明化合物1~4的含量分别为0.19,0.14,0.17,0.13 mg/g DW,其中新天然产物化合物1含量最高。

图3 全谷物糙米结合态酚提取物的HPLC图谱Fig.3 HPLC chromatography of bound phenolics extract from whole grain brown rice
2.3 体外抗氧化活性评价
2.3.1 DPPH自由基清除能力
DPPH可从抗氧化物中吸取质子失去发色基团,其在517 nm波长处有较强的吸收,通过吸光度的变化反映样品对自由基的清除能力,从而推测其抗氧化性[22]。IC50值是对自由基清除率达50%时所需的样品有效剂量,IC50值越小,则自由基清除能力越强,抗氧化性越好。如表2所示,化合物4的IC50值最小,表明其DPPH自由基清除能力显著高于其他3个化合物,但比阳性对照Vc弱;本研究中化合物2也表现出DPPH自由基清除活性,这与Chung等报道的结果一致[20]。然而化合物1和3未表现出DPPH自由基清除活性,IC50均大于1 mM。

表2 各单体化合物的DPPH自由基清除率IC50值Table 2 The IC50 value of DPPH free radical scavenging rate of compounds 1~4
2.3.2 FRAP总抗氧化能力

表3 各单体化合物的铁离子还原能力Table 3 FRAP of compounds 1~4
采用总抗氧化能力检测试剂盒(FRAP法)对分离得到的4个单体化合物进行抗氧化活性测试,结果表明化合物1~4具有一定的抗氧化活性,其中,化合物2的还原能力最强,还原能力高达249.60 mmol FeE/mol,与阳性对照Trolox相当;其它3个化合物活性均弱于阳性对照(p<0.05),4个单体的还原能力由大到小为:化合物2>3>4>1。FRAP法重现性好,操作简单且快速,测定的是样品对高价态离子的还原能力,测定过程中不包含活性氧,因此,并不能完全反映打破自由基链式反应或抗氧化剂阻断的抗氧化能力[23]。
2.3.3 ORAC抗氧化能力
ORAC抗氧化属于经典的氢原子转移(HAT)机制,是目前国际上常用的一种评价食品抗氧化能力的方法,较一般的自由基清除法更准确灵敏[24]。如表4所示,ORAC氧自由基吸收能力测定结果表明化合物2,3,4有较强的抗氧化能力,其活性均比阳性对照没食子酸强(p<0.05)。而化合物1 ORAC抗氧化能力最差(0.18±0.02 μmol TE/μmol),此结果与DPPH及FRAP结果一致,表明化合物1是4个化合物中抗氧化活性最差的。

表4 各单体化合物的ORAC值Table 4 ORAC value of compounds 1~4
对比3种体外抗氧化活性结果,DPPH自由基清除能力最好的是化合物4,其IC50值为72.19±3.45 μM;FRAP抗氧化能力最强的是化合物2,FRAP值为249.60±3.19 mmol FeE/mol;ORAC测定结果表明化合物3和4抗氧化能力最强。三种抗氧化方法的测定结果存在差异,其可能的原因是不同抗氧化方法所采用的自由基种类及测定原理不同。DPPH和FRAP法是基于电子转移,涉及还原有色氧化剂,颜色变化的程度与样品的抗氧化剂浓度相关;ORAC法基于氢原子转移,涉及到抗氧化剂和底物竞争热产生的过氧自由基。FRAP测定法与其他两种方法不同,因为其不涉及自由基,而是将三价铁(Fe3+)还原为二价铁(Fe2+)的过程;ORAC方法中的自由基来源为AAPH, 可产生出的过氧化自由基是人体内普遍存在的一种自由基,是目前国际上常用的一种评价食品抗氧化能力的方法[24,25]。因此,为了科学评价化合物的抗氧化活性,应该至少采用两种以上的抗氧化方法进行评价。
3 结论
通过多种柱层析手段结合波谱学方法共分离鉴定了4个化合物,分别为6-羟基-2-氧代-1,2,3,4-四氢喹啉-4-羧酸甲酯(1),4-羧甲氧基-6-羟基-2-喹诺酮(2),4-羧基-6-羟基-2-喹诺酮(3)和2-(5-羟基-2-氧代吲哚-3-基)乙酸甲酯(4),其中化合物1为新天然产物,化合物2为首次从糙米中分离报道。4个单体化合物中化合物1含量最高,为0.19 mg/g DW。分离得到的4个单体化合物均表现出了一定的抗氧化活性。糙米结合酚提取物中除了已报道的酚酸类、黄酮类和甾醇类之外,还含有生物碱类活性物质。
