一种通过过表达毕赤酵母翻译相关因子提高重组蛋白胞内表达的策略
2021-07-27林雯炀廖锡豪陈南柱黄大富陈亮钟炳旭梁书利林影
林雯炀,廖锡豪,陈南柱,黄大富,陈亮,钟炳旭,梁书利,林影
(华南理工大学生物科学与工程学院,广东广州 510006)
巴斯德毕赤酵母(Pichia pastoris)是重组蛋白表达生产的优良宿主,它被美国食品药物管理局认定为GRAS(通常认为安全的)级微生物[1],且具有遗传操作简便、培养成本低、有接近高等真核生物的蛋白质翻译后加工和修饰能力[2,3]、可进行高密度发酵[4,5]等优点。此外,毕赤酵母还具有甲醇诱导型强启动子PAOX1,在以廉价碳一化合物甲醇为唯一碳源的条件下,由PAOX1启动的AOX1蛋白可达到胞内总蛋白的30%[6]。大量研究实例证明,除了在分泌表达方面的优越性能,毕赤酵母也被广泛应用于重组蛋白的胞内表达,并且胞内表达的重组蛋白具有良好的活性和生物安全性,如HPV-16的L1-L2蛋白[7]、大豆血红素C2[8,9]、类胡萝卜素[10,11]、重组人溶菌酶[12]等。因此,优化重组蛋白在毕赤酵母的胞内表达具有重要的意义。
目前,毕赤酵母提高重组蛋白胞内蛋白表达的主要策略有启动子改造,基因拷贝数增加,密码子优化和发酵优化[13]等,在蛋白质翻译模块研究鲜有报道。然而,基因的转录水平和蛋白表达水平并不是完全一致的,从mRNA到蛋白质需要进行翻译和翻译后修饰等。翻译作为将mRNA遗传信息传递到蛋白质的桥梁,它不仅决定多肽的合成质量与生成速率,还影响蛋白质的翻译后易位,折叠,修饰及分泌等。最初,由于蛋白质翻译存在复杂性,关于重组蛋白过量表达在翻译水平的研究及调控的报道较少。而近年本实验室林小琼等人[14]通过定量蛋白质组学方法(iTRAQLC-MS/MS)测定中过表达木聚糖酶基因xynA毕赤酵母菌株翻译蛋白系统中翻译相关因子的变化,结果显示过表达重组蛋白时翻译系统的部分翻译相关因子出现上调(本文中定义翻译相关因子为通过互作作用参与辅助,调节目的蛋白质翻译,折叠和加工的反式作用因子)。即表明部分翻译相关因子与重组蛋白过表达之间存在正相关关系。故本文基于Schutter等人[15]发布的毕赤酵母基因组注释,选取了部分核糖体蛋白,翻译起始因子,翻译延伸因子,氨酰-tRNA合成酶,核糖体生物合成因子和核糖体相关分子伴侣5类在翻译及翻译后修饰中发挥重大作用的翻译相关因子在毕赤酵母中进行过表达,以增强型绿色荧光蛋白eGFP作为报告蛋白,初筛选出对翻译有促进作用的因子,并用红色荧光蛋白mRFP验证了其促进重组蛋白表达的功能。本研究首次提出了在毕赤酵母中过表达翻译相关因子从而提高外源表达的策略,为从翻译层面提高重组蛋白及促进外源途径基因表达提供了新思路。
1 材料与方法
1.1 材料与仪器
宿主菌Pichia pastorisGS115/eGFP、Pichia pastorisGS115/mRFP,质粒pPICZA和Escherichia coliTOP10由本实验室保存;限制性核酸内切酶,质粒小提等试剂盒,Seamless Master Mix酶购于广州美基生物科技有限公司;引物由广州擎科生物技术有限公司合成。
主要实验仪器:DRP-90_52型电热恒温培养箱,上海森信实验仪器有限公司;NBS恒温摇床,美国NBS公司;NanoDrop 1000紫外可见分光光度计,德国Eppendorf公司,凝胶成像仪Gel DocXR;PCR仪、电转仪、水平电泳槽Mini-Sub Cell GT Cell,美国Bio-rad公司。
1.2 表达载体的构建
根据网站(https://bioinformatics.psb.ugent.be/orcae/overview/Picpa)上毕赤酵母基因组注释得到的基因序列,以毕赤酵母GS115为模板,用上,下游引物1-56,分别扩增得到基因片段RPS25、ASC1、Tif5、eIF4A,eIF4G、Tif11、Sui1、Tef4、Nip1、eEF1A、eEF2、eEF3、Ded81、Krs1、Ses1、Gln4、Ils1、Dps1、Sch9、Sfp1、Bcy1、Tpk1、Tpk2、Ssz1、Zuo1、Ssb、Egd1、Egd2。将这些片段回收并分别与pPICZA质粒通过Seamless Master Mix酶进行同源重组,使得目的基因整合至pPICZA质粒中的AOX1启动子下游,(按照美基公司该产品的使用说明书)构建重组质粒,用E. coliTOP10扩增质粒并送至广州擎科生物技术有限公司测序验证无基因突变后用于毕赤酵母的转化。

表1 引物汇总表Table 1 Primer used in this study

接上页
1.3 翻译相关因子过表达菌株的构建
构建得到的重组质粒经mss1酶线性化(Bcy1用Sac1酶),并用PCR产物纯化回收试剂盒纯化后,取10 μL纯化回收产物分别加入100 μL感受态细胞毕赤酵母GS115/eGFP和GS115/mRFP中,轻轻吹打混匀,转移至冰浴的电击杯中,冰浴5 min。使用电穿孔仪进行fungi档电击。电击结東后立即加入1 mL冰浴的1 mol/L的山梨醇,混匀后转移至1.5 mL离心管中,于30 ℃电热恒温培养箱中孵育1 h。取200 μL孵育后的悬浮液用无菌三角扒涂布于YPD抗性平板中,30 ℃培养箱中培养3~4 d。挑取重组菌株菌落为模板,以每个翻译相关因子对应的上游引物和通用引物3'AOX1对其进行菌落PCR验证以筛选出阳性转化子。
1.4 翻译相关因子过表达菌株的摇瓶发酵
重组蛋白在毕赤酵母中的表达分为两个阶段,即菌体的生长阶段和重组蛋白的表达阶段。菌体生长阶段以甘油为碳源,将已经活化的菌种直接接种到5 mL的初始pH 6.0的BMGY摇瓶生长培养基(0.1 g蛋白胨,0.05 g酵母提取物,0.067 g YNB,10%(m/V)的甘油),在30 ℃,250 r/min的条件下培养22~24 h,使菌体进行大量的生长繁殖。
在菌体大量繁殖之后,可将其转接到以甲醇为碳源的BMMY液体培养基中进行诱导培养,使其进入重组蛋白表达阶段。为控制起始OD相同,可每瓶取2 mL菌液,6000 r/min离心5min,弃上清液。用1 mL BMMY摇瓶生长培养基重悬菌体。控制BMMY摇瓶培养基中菌体的起始OD=1.0,将重悬的菌液转接到20 mL BMMY摇瓶生长培养基(0.4 g蛋白胨,0.2 g酵母提取物,0.268 g YNB,1%(V/V)的甲醇)。在30 ℃,250 r/min条件下恒温培养120 h进行重组蛋白的诱导表达,每隔24 h±2 h取样测定OD值和荧光强度,菌液取样量为200 μL。并向培养基中补加200 μL的100%甲醇(AR)。
1.5 菌体生物量与荧光蛋白表达总量的测定
每次取样品菌液40 μL稀释50倍用紫外分光光度计测量OD600代表菌体生物量,剩余菌液13000 r/min离心1 min后的上清液10 μL,用Refloding Buffer(0.05 mol/L NaH2PO4·2H2O,0.1 mol/L NaCl,0.5 mol/L Zmidazole)稀释20倍后加到96孔板中,每个样品做3组平行实验,用酶标仪(PerkinElmer)检测荧光强度代表荧光蛋白表达总量(eGFP,激发波长:488 nm,发射波长:520 nm;mRFP,激发波长:584 nm,发射波长:610 nm),则荧光蛋白单位菌体表达量(每单位菌体生物量荧光蛋白表达量)计算公式如下:
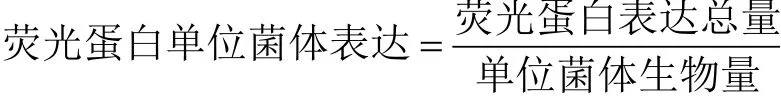
1.6 数据处理
每个重组酵母菌株重复发酵三次,每次反应合RA设置三个平行,数据值为平行样品的平均值,用误差线表示标准偏差。采用Microsoft Office 2016分析处理数据,采用Graph PadPrism 7绘制图。
2 结果与讨论
2.1 翻译相关因子的选取
本实验室研究表明,在表达重组蛋白时,毕赤酵母翻译系统相关基因出现上调的现象,[14]由此我们筛选了在重组蛋白表达时出现上调的翻译相关因子(表2),尝试通过过表达这些翻译相关因子,观察其对重组蛋白的翻译能力主动地上调的变化,力图促进重组蛋白表达。此外,我们还筛选了对翻译至关重要的参与IRES介导翻译起始的Rps25,组成mRNA帽子结合复合物的eIF4G,参与翻译延伸的eEF2和eEF3筛选潜在的重组蛋白翻译促进因子,并分析翻译相关因子对重组毕赤酵母重组蛋白表达及细胞生长的影响。

表2 Pichia pastoris GS115翻译相关因子的筛选Table 2 Selected translation-related factors of Pichia pastoris GS115
2.2 翻译促进因子的初筛选
为研究各个翻译相关因子过表达对重组蛋白表达的影响,本文以绿色荧光蛋白为报告蛋白,构建毕赤酵母翻译相关因子过表达菌株,在BMNY培养基中进行摇瓶发酵,测定且计算其菌体生物量、eGFP表达总量和eGFP单位菌体表达量,并与未存在翻译相关因子重组表达的eGFP毕赤酵母表达菌株比较。通过发酵测定28个翻译相关因子对胞内eGFP表达影响的分析,发现过表达翻译核糖体相关分子伴侣Ssb可提高eGFP表达量21.60%,过表达翻译延伸因子eEF1A、eEF3、翻译起始因子eIF4A和氨酰-tRNA合成酶因子Ded81也有明显促进作用。核糖体生物合成因子Bcy1可提高细胞生物量,从而提高单位体积eGFP表达量,如图1。

图1 发酵测定28个翻译相关因子过表达菌株的eGFP表达总量和菌体生物量Fig.1 eGPF intensity and biomass of 28 translation-relatedfactors overexpressed strains
2.3 翻译促进因子的再验证
为进一步验证对eGFP表达有促进作用的6个潜在的翻译促进因子对重组蛋白表达有促进作用,本文通过发酵对上文所提及对重组蛋白表达有促进作用的6个翻译相关因子进行了胞内mRFP表达分析。实验结果表明,红色荧光蛋白mRFP的表达与绿色荧光蛋白eGFP的表达实验结果相吻合,成功验证了翻译相关因子eIF4A、eEF1A、eEF3、Ded81、Bcy1、Ssb可显著促进重组蛋白的表达,结果如图2所示。
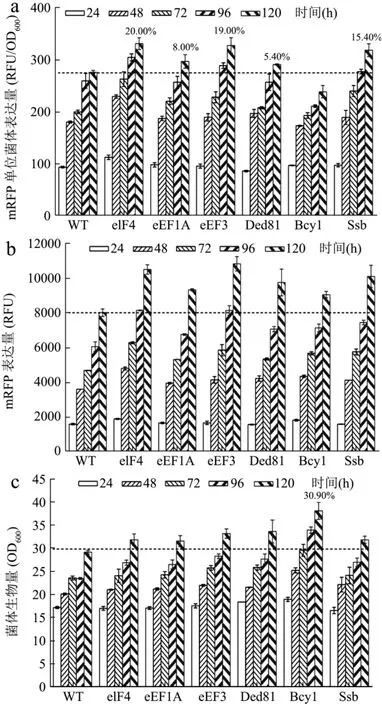
图2 发酵测定6个翻译相关因子过表达菌株的mRFP表达总量和菌体生物量Fig.2 mRFP intensity and biomass of 6 translation-related factors overexpressed strains
2.4 比较
目前提高毕赤酵母胞内表达的策略主要集中在对重组蛋白基因进行改造,如启动子优化[16]、增加基因拷贝数[17]、密码子优化[18]发酵条件优化,如通过单因素试验和正交试验来优化培养基成分和摇瓶发酵条件[19]、改善前体供应[16]优化pH、溶氧、甲醇流加速率及搅拌转速通风量[18]等。本研究通过过表达翻译相关因子,利用反式因子提高蛋白翻译效率来提高外源表达,从而使得eIF4A、eEF1A、eEF3、Ded81、Ssb的eGFP单位菌体表达量分别增加了18.40%、18.80%、29.50%、28.45%、21.60%,使得eIF4A、eEF1A、eEF3、Ded81、Ssb的mRFP单位菌体表达量分别增加了20.00%、8.00%、19.00%、5.40%、15.40%。此外还筛选到一个可以提高毕赤酵母菌体生物量从而提高毕赤酵母荧光表达总量的Bcy1翻译相关因子,可以使得eGFP表达菌株生物量增加20.00%,mRFP表达菌株生物量增加30.90%。说明过表达翻译相关因子提高重组蛋白表达具有普适性。本研究通过过表达翻译相关因子提高毕赤酵母重组蛋白表达的策略,虽然相较于提高了4倍重组蛋白胞内表达的密码子优化[18]等策略提高量较少,但首次通过过表达单一的翻译相关因子提高毕赤酵母胞内蛋白表达,为从翻译层面提高毕赤酵母外源表达提供了一种新思路。
3 结论
毕赤酵母是一种甲醇营养型酵母,由于它可以实现高密度发酵以及作为目前已广泛应用于生产的重组蛋白,近期人们开始关注毕赤酵母在外源代谢途径表达及新的代谢产物合成的研究。近年来,关于提高毕赤酵母外源表达的策略,较多的研究报道集中在增加基因拷贝数[20],优化外源基因密码子[21]以及优化菌种培养和发酵条件[22]等,在翻译层面报道较为缺失,本文选用毕赤酵母诱导型强启动子AOX1,以增强型绿色荧光蛋白eGFP为报告蛋白对28个可能提高外源表达的翻译相关因子进行初筛,并用红色荧光蛋白mRFP为报告蛋白对其提高外源表达的作用进行了复筛和再验证,总共筛选到6个翻译相关因子eIF4A、eEF1A、eEF3、Ded81,Bcy1、Ssb可显著提高重组蛋白表达,其中翻译延伸因子eEF3可提高eGFP表达量达30.90%,核糖体生物合成因子Bcy1可显著提高细胞生物量而有利于重组蛋白生产过程中的积累。为提高毕赤酵母重组蛋白及外源途径基因的表达提供了新思路。
