生物产酸对木薯酒精废水发酵联产氢气和甲烷的影响
2021-07-26黄正恒郑展耀刘士清张无敌
黄正恒,郑展耀,杨 红,刘士清,尹 芳,张无敌
(云南师范大学 能源与环境科学学院,云南 昆明 650500)
0 引言
随着人们对煤、石油、天然气等化石能源的过度开采,人类面临着能源危机和环境恶化两大问题,因此世界各国也在时刻关注新型绿色能源的开发。沼气是有机物质在厌氧条件下,经过多种厌氧微生物分解代谢所产生的可以燃烧的混合气体,是有效治理环境的同时而产生的新能源[1]。沼气开发对于生物质能清洁利用、减少温室气体排放具有重要意义[2]。
厌氧消化是处理废弃物最有效的一项技术,在经济上和环境上均有较大的优势。以往的研究显示:一方面,利用厌氧消化技术处理餐厨垃圾、酒精废水等易降解的原料时,由于产酸菌的生长速度远远超过产甲烷菌的生长速度,会导致过量的挥发性有机酸(VFA)的积累,进而出现产酸的现象,阻碍甲烷的生产;另一方面,在厌氧消化的产酸阶段会产生H2,若不能加以回收,就会因较高的氢分压而抑制甲烷菌的活性,从而导致能源转化率低的结果[3]~[5]。
为了解决厌氧消化过程中出现的产酸和能源转化率低的问题,许多学者开展了废弃物发酵联产H2和CH4的研究。在厌氧发酵系统中,pH值是影响厌氧发酵过程的重要因素[6]。杨斌以牛粪为原料,通过调节pH值联合发酵制取H2和CH4,实验时间为13 d,最终实验得出以单位质量VS计的产氢率和产甲烷率分别为53.00 mL/g和51.4 8 mL/g,牛粪联产氢和甲烷的能源转换率要比单独产氢、产甲烷发酵分别高18.3 9%和2.3 5%[7]。尹芳利用紫茎泽兰发酵联合产氢产甲烷,在厌氧发酵产氢过程中的pH值维持在4.5 ~5.5 ,实验持续时间为14 d,以单位质量VS计的产氢率和产甲烷率分别为63.6 6 mL/g和175.3 5 mL/g,在紫茎泽兰厌氧消化过程中先产氢后产甲烷要比先产甲烷后产氢的能源利用效率高出53.1 9%[8]。Chihe Sun在pH值为6.5 左右的条件下,对水热酸预处理的小球藻和大米渣混合物进行厌氧发酵联产氢气和甲烷实验,144 h的生物产酸过程结果显示,以单位质量VS计的最大产氢率和产甲烷率分别为223.1 mL/g和141 mL/g,两阶段发酵比单阶段发酵的能源转化率提高了64%,并把原料分解成了更容易被甲烷菌利用的小分子挥发性有机脂肪酸类物质,提高了后续的产甲烷能力[9]。
生物产酸过程也受一些其它外界因素的影响,其中初始pH值的不同,也影响着生物产酸过程中物料的水解和产酸的效率,并导致氢气和甲烷产量的差异[10],[11]。本文以木薯酒精废水为原料,研究不同初始pH值下,生物产酸对木薯酒精废水厌氧发酵联产氢气和甲烷的影响,并对比两级厌氧消化与单级厌氧消化的能源利用率水平。
1 材料和方法
1.1 原料和接种物
木薯酒精废水采集自木薯乙醇发酵蒸馏后从中试实验室蒸发罐底部排出的废醪液,COD值为46 386 mg/L。实验用原料是由原废醪液配水所得。接种活性污泥为污水处理厂脱水活性污泥,经实验室在室温情况下厌氧驯化一年获得。物料特性如表1所示。
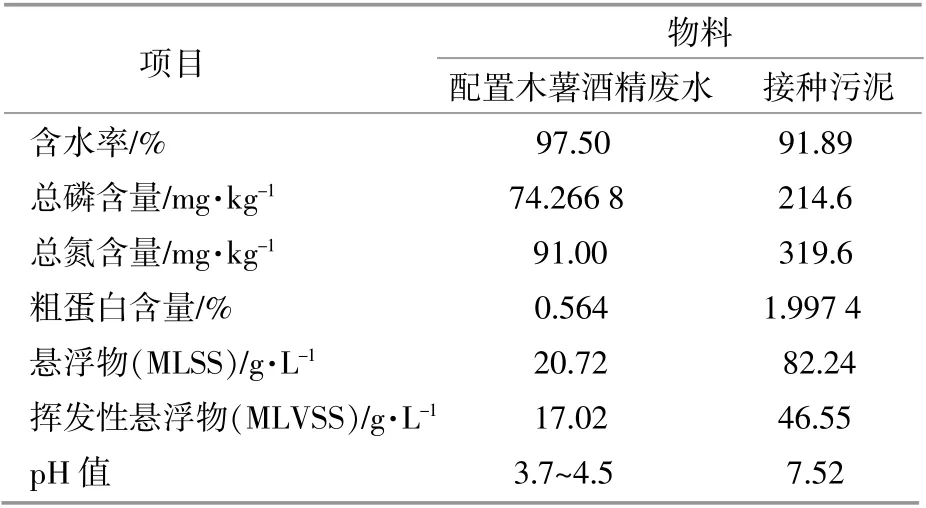
表1 木薯酒精废水与接种污泥的物料特性Table l Comparison of characteristic of material between cassava alcohol wastewater and inoculating sludge
1.2 生物产酸
生物产酸实验在500 mL发酵罐中进行,每个发酵罐的有效工作体积为400 mL。设置4个实验组和1个对照组,每组均重复设置3个平行实验。向每个实验组发酵罐中加入120 mL经过热预处理的接种污泥,把接种活性污泥在80℃水浴1 h;加入280 mL的木薯酒精废水,加水至400 mL。使用3 mol/L的NaOH和HCl溶液,将初始pH值分别调节至7.5±0.2,6.5±0.2,5.5±0.2和4.5 ±0.2 。对照组设置为120 mL接种物和280 mL的自来水。生物产酸过程在36.0 ±0.5 ℃的恒温水浴中自然发酵一周。实验开始前,对装置进行检漏。实验中产生的气体从发酵罐的顶部空间释放,收集在带刻度的气体收集器中,然后每隔预定的时间记录产气量和氢气含量[12]。
1.3 厌氧消化
实验组用生物产酸后的上清液作为底物,对照组用不经过生物产酸的木薯酒精废水为底物,分别转移到500 mL玻璃发酵罐中,作为厌氧消化过程的底物。实验组内含280 mL原料和120 mL接种污泥。对照组内含120 mL接种污泥和280 m L自来水。直接厌氧消化实验(DAD)使用3 mol/L的NaOH和HCl溶液将初始pH值调节至7.5±0.1,实验组不调节pH值。实验组和对照组均置于36.0 ±0.5 ℃的水浴中。
1.4 分析方法
使用PHS-3C型pH计测定进水和出水的pH值变化。
使用福立GC9790Ⅱ型气相色谱仪测定气体成分,Porapak Q不锈钢填充柱,柱温80℃;以氮气为载气,流速为30 mL/min;进样室温度为80℃;检测室热导检测器(TCD)的检测室温度为120℃;桥电流为120 mA。
使用福立GC9790Ⅱ型气相色谱仪测定挥发性有机酸,色谱柱为30 mm×0.25 mm×0.25μm的熔融硅胶毛细管色谱;以高纯氮气作载气,气体流速为30 mL/min;进样方式为分流进样,分流比为10∶1,空气和氢气流速分别为400 mL/min和30 mL/min。
使用哈希COD maxⅡ在线测定仪测定进水和出水的COD。
采用苯酚-硫酸法测定碳水化合物[13]。用DNS比色法测定还原糖[1]。
1.5 计算方法
生物产酸率(BAR)为发酵完成后挥发性有机酸(VFA)的总量与初始生物质的比值。比产氢气量和比产甲烷量是指单位体积或单位干重的微生物,在任何特定废水有机物中产生氢气和甲烷的能力。
使用改进的Modified Gompertz方程模拟比产氢量和比产甲烷量[14]。
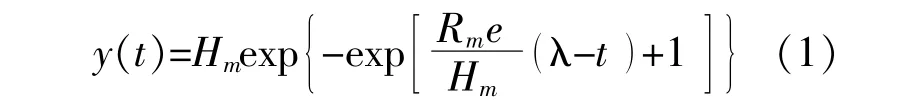
式中:y(t)为时间t时的最大比产气量,当t→∞时,y(t)→a,有Hm=a为最大比产气量,mL;Rm为最大比产气速率,mL/d,Rm=a·c/e;λ为发酵滞留时间,λ=(b-1)/c,d。
数据处理过程中,利用origin软件对参数a,b,c进行拟合,然后转换为Hm,Rm,λ的值。
利用门捷列夫公式计算出木薯酒精废水的热值Q,kJ/g[15]。利用式(3)计算生物产酸和厌氧消化完成后的能源利用效率[8]。
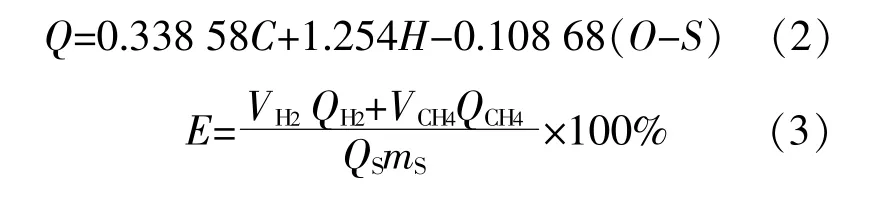
式中:Q为热值;C,H,O,S分别为各元素的MLVSS百分比;E为能源利用效率,%;V为实验测定的气体体积,mL;m为原料干物质质量。
2 结果与讨论
2.1 不同初始pH值对生物产酸的影响
2.1.1 有机物变化情况
有机物的变化如表2所示。

表2 生物产酸和制氢过程中有机物的降解和可溶性代谢产物的产生Table 2 Degradation of organic compounds and production of soluble metabolites in bioacidification and hydrogen production
由表2可知,对木薯酒精废水进行直接厌氧消化(DAD)对照组进行了16 h产氢过程。在此过程中,碳水化合物从23.31 mg/mL降低至10.05 mg/mL,还原糖从1.57 mg/mL降低至0.95 mg/mL,说明在制氢过程中微生物对糖类有所利用。挥发性有机酸出现明显的积累,从285 mg/L到2 536 mg/L,其中丁酸含量最多,为1 499.15 mg/L。因此该产氢类型为丁酸型,pH值从7.35降低至5.7。
在pH值为7.5,6.5,5.5,4.5的初始条件下,进行168 h的生物产酸实验,各实验组生物制氢过程分别进行了32,32,32,24 h。在生物产酸过程中,各有机物质和挥发性有机酸均有不同程度的降解和积累。从制氢结束到生物产酸期间,碳水化合物、还原糖、TS,VS,COD也会有所降解,但是程度较小。此期间各实验组挥发性有机酸会进一步积累,从751.01~1 564.78 mg/L增加至2 917.05~7 252.49 mg/L;其中,丁酸含量减少,乙酸、丙酸的含量有所增加,pH值也有不同程度的降低。在生物产酸过程中,产氢不能持续进行的原因,一是蛋白质水解产生的氨基酸被利用,而氨基酸产氢量较低;二是在产氢结束到生物产酸期间,各实验组丙酸含量明显增加,由85.41~471.27 mg/L增加至167.97~1 690.88 mg/L,丙酸含量增加可能是因为消耗氢气所致。由表2可以看出,在生物产酸实验中,在初始pH值为7.5,6.5,5.5和4.5条件下,产酸率(BAR)分别为52.70%,53.13%,43.98%和35.21%。
2.1.2 生物制氢
①比产氢量和比产氢率
图1、图2展示出了直接厌氧消化(DAD)的对照组和初始pH值为7.5,6.5,5.5,4.5的生物产酸各实验组木薯酒精废水厌氧发酵产氢随时间的变化趋势。

图1 比产氢量随发酵时间的变化趋势Fig.1 Trends of specific hydrogen yield with fermentation time

图2 比产氢率随发酵时间的变化趋势Fig.2 Trends of specific hydrogen yield rate with fermentation time
接种物经过热处理的实验组,发酵周期要长于接种物未预处理的DAD对照组,说明经过热处理的接种污泥,有效地抑制了甲烷菌的活性,而未经过预处理的接种污泥会因为甲烷菌的存在,导致产氢提前结束。初始pH值为7.5和6.5实验组的比产氢率呈一直下降的趋势,在第4 h达到最大值,以单位质量的MLVSS计,分别为13 mL/(g·h)和11.11 mL/(g·h)。初始pH值为5.5,4.5的实验组和DAD对照组的比产氢率呈先上升后下降的趋势,分别在第8,12 h及12 h达到最大值,以单位质量的MLVSS计,分别为5.31,3.47,8.77 mL/(g·h)。这说明初始pH值和接种物的处理,影响着产氢菌群对有机物的利用速率。以单位质量MLVSS计,初始pH值为6.5的实验组的最高比产氢量为96.44 mL/(g·h),比产氢率为13.00 mL/(g·h)。在初始pH值为4.5的情况下,比产氢量和比产氢率要低于其它实验组。
结合表2可以看出,各实验组的比产氢量排列为6.5>7.5>5.5>DAD>4.5。这主要是因为木薯酒精废水中悬浮固体较多,较高的pH值能够进一步水解原料中的悬浮固体,使产氢菌利用的糖类物质增多,因此会导致产氢量和发酵料液中的挥发性有机酸的增加。由表2也可以看出,生物制氢过程中,初始pH值7.5,6.5,5.5,4.5实验组的挥发性有机酸的浓度分别为5 372.73,5 260.37,3 204.10,1 381.30 mg/L。然而,在高pH值下,同型乙酸的存在,会把氢气和二氧化碳转化为乙酸。由表2还可以看出,在总VFA大致相同情况下,初始pH值为7.5实验组的乙酸含量(1 564.78 mg/L)高于初始pH值为6.5实验组的乙酸含量(1 152.71 mg/L)。这也是导致7.5实验组比6.5实验组的比产氢量低的原因。
②氢气含量
用气相色谱法对各实验组进行检测,7.5,6.5,5.5 ,4.5 等4个实验组只观察到氢气和二氧化碳,DAD实验组除了二氧化碳和氢气之外,还观察到了少量的甲烷(图3)。

图3 氢气含量随发酵时间变化的曲线图Fig.3 The curve of hydrogen content with fermentation time
由图3可以看出,pH值为7.5,6.5,5.5,4.5的实验组的平均氢气含量要高于DAD对照组。这主要是因为生物产酸中各实验组的接种污泥都经过热处理,产氢菌种可以得到很好的富集。pH值为7.5 ,6.5 ,5.5 ,4.5 的实验组和DAD对照组的产氢量 分 别 在 第4,4,4,16,4 h达 到 最 大 值,为26.4 47 1%,27.5 54 2%,27.2 49 3%,22.7 01 6%和19.4 70 4%。随着大量的糖类物质被消耗以及丙酸含量的增加,产氢逐渐结束,氢气含量逐渐下降。
2.2 厌氧消化产甲烷
2.2.1 比产甲烷量和比产甲烷率
在生物产酸期间,微生物菌群会把蛋白质、纤维素等物质,进一步降解成更容易被甲烷菌利用的小分子有机酸,因此产酸率的高低影响后续产甲烷的趋势,并且会进一步影响发酵周期。图4、图5分别为比产甲烷量和比产甲烷率随发酵时间的变化趋势。

图4 比产甲烷量随发酵时间的变化趋势Fig.4 Trends of specific methane yield with fermentation time

图5 比产甲烷率随发酵时间的变化趋势Fig.5 Trends of specific methane yield rate with fermentation time
由表2和图4可知,初始pH值为6.5的实验组的BAR最高(53.13%),进而获得了最大的比产甲烷量为197.06 mL/g(以单位质量的MLVSS计)。其它实验组比产甲烷量的排序为7.5(176.1 mL/g)>5.5(155.14 mL/g)>DAD(150.1 mL/g)>4.5(146.12 mL/g),说明在初始pH值为5.5~7.5条件下对原料进行生物产酸,更有利于提高甲烷的产量。在初始pH值为4.5时,微生物并不能对原料进行更有效的降解,致使比甲烷产量较低。在0~72 h,DAD对照组的比产甲烷量和比产甲烷速率高于生物产酸的各实验组。这可能因为在实验开始阶段,系统内未调节pH值,导致甲烷菌还未适应其中的环境,因此其比产甲烷量和比产甲烷速率较低;在72 h以后,随着产甲烷菌对环境的适应,比产甲烷量和比产甲烷速率迅速地增加。
由图5可见,初始pH值为7.5和6.5的两个实验组与其它实验组不同,比产甲烷率的趋势呈“N”型。这是因为在生物产酸过程中这两个实验组的VFA积累较多,在随后的产甲烷过程中,产酸菌的生长速度快于产甲烷菌,造成VFA进一步积累,对产甲烷菌有所抑制,而导致比产甲烷率呈下降趋势。随着产甲烷菌对环境的适应,比产甲烷率快速升高,生物产酸初始pH值为7.5,6.5,5.5,4.5 的各实验组在120 h后,以单位质量MLVSS计的比产甲烷率达到最大值,分别为11.2 3,1.3 7,1.1 5,1.0 mL/(g·h);DAD对照组比产甲烷率在24 h达到最大值,即1.1 3 mL/(g·h)。随着发酵结束,比产甲烷率逐渐下降。
2.2.2 甲烷含量
图6为甲烷含量随发酵时间的变化趋势。由图6可知,各生物产酸实验组的甲烷含量峰值出现时间要早于DAD对照组;初始pH值7.5,6.5,5.5 ,4.5 和DAD实验组的最大甲烷含量分别为54.2 5%,61.8 7%,55.3 4%,53.8 4%和55.8 8%;其中,初始pH值6.5 实验组的甲烷含量最高,其次为DAD对照组。虽然DAD对照组的最大甲烷含量要高于初始pH值7.5 ,6.5 ,5.5 实验组,但是平均甲烷含量低于其它各实验组。

图6 甲烷含量随发酵时间的变化曲线图Fig.6 The curve of methane content following with fermentation time
2.3 动力学参数
利用以上所得数据及式(1),对比产氢量和比产甲烷量进行拟合,获得动力参数最大比产气量、最大比产气速率和滞留时间(表3)。

表3 生物产酸产氢和厌氧消化产甲烷动力学参数比较Table 3 Comparison of kinetic parameters between acetogenic H2-production and anaerobic CH4-production
由表3可知,对比产氢量和比产甲烷量进行拟合,相关系数均在0.9以上,拟合程度较高。在生物制氢阶段,最大比产氢量排序为6.5(90.63 mL/g)>7.5(76.87 mL/g)>5.5(58.66 mL/g)>DAD(51.89 mL/g)>4.5(31.87 mL/g)(以单位质量的MLVSS计)。拟合结果与本实验数据的误差分别仅为6.02%,5.0%,1.13%,0.21%,3.77%。拟合的最大比产氢速率的排序为6.5>DAD>7.5>5.5>4.5。本实验所得数据的最大比产氢速率为7.5>DAD,造成误差的原因是前期产氢趋势不稳定而造成曲线拟合得不准确。经过热处理的接种污泥在初始pH值7.5,6.5实验组的滞留时间较短,pH值5.5 ,4.5 实验组的发酵滞留期较长。在厌氧消化产甲烷过程中,最大比产甲烷量的排序为6.5(199.3 3 mL/g)>7.5 (177.0 4 mL/g)>5.5 (156.2 6 mL/g)>DAD(154.7 5 mL/g)>4.5 (148.0 6 mL/g)(以单位质量的MLVSS计),与本实验的误差分别仅为1.1 4%,0.5 3%,0.7 2%,3.0 %,1.3 1%;拟合的最大比产甲烷速率排序为7.5 >6.5 >5.5 >4.5 >DAD,而实验所得数据为DAD>4.5。这是因为在实验过程中,调节DAD对照组pH值而造成的实验误差所致。DAD对照组的发酵滞留期最短,其次为初始pH值为6.5 ,7.5 ,5.5 ,4.5 实验组。
2.4 能源转化效率
由实验数据所得的累计产氢量和累计产甲烷量如表4所示。根据式(2),已知氢气的热值为12.8 60 J/mL,甲烷的热值为35.8 22 J/mL,计算出木薯酒精废水的热值为14 700 J/g。根据式(3)计算出各实验组能源转化率,如图7所示。

表4 各实验组累计产氢量和累计产甲烷量Table 4 The column of cumulative hydrogen production and methane production
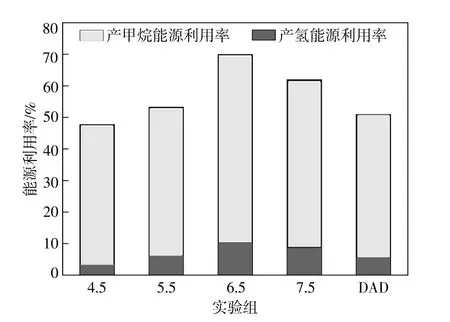
图7 厌氧发酵产氢气和甲烷过程中的能源利用率Fig.7 The Energy efficiency rate in the anaerobic process of H2-production CH4-production
由图7可知,在产氢过程中,实验组7.5,6.5,5.5 ,4.5 及DAD对照组的能源利用率分别为8.7 7%,10.4 5%,6.4 3%,3.5 9%,5.6 1%。可见,在生物厌氧发酵制氢过程中,微生物对原料的利用率不高,导致能源利用率较低。在随后的产甲烷过程中,实验组7.5,6.5,5.5,4.5及DAD对照组的能源利用率分别为53.17%,59.49%,46.83%,44.12%,45.3 2%,比产氢过程中的能源利用率有了明显的提高。在氢气和甲烷联产过程中,实验组7.5 ,6.5 ,5.5 ,4.5 及DAD对照组的总能源利用率分别为61.9 4%,69.9 4%,53.2 6%,47.7 1%,50.9 3%。可以看出,在初始pH值为5.5 ~7.5 时,对原料进行生物产酸168 h后再进行厌氧消化实验,比直接厌氧消化实验的能源利用率都有一定程度的提高,最多可提高19.0 1%;在初始pH值4.5 情况下,会影响微生物对原料的利用,进而导致能源利用率下降。
3 结论
在生物产酸过程中,各实验组的VFA都有不同程度的积累,其中产氢类型为丁酸型,初始pH值对生物产酸率有着显著的影响。初始pH值为4.5 ,5.5 ,6.5 ,7.5 实 验 组 的 生 物 产 酸 率 分 别 为35.2 1%,43.9 8%,53.1 3%,52.7 0%,其中初始pH值为6.5 的产酸率最高。这种现象进一步影响后续发酵产甲烷的性能。
利用Modified Gompertz模型分析木薯酒精废水各实验组厌氧发酵过程中的比产氢量和比产甲烷量,显示出较好的相关性。在生物制氢阶段,最大比产氢量排序为6.5>7.5>5.5>DAD>4.5。在厌氧消化产甲烷过程中,最大比产甲烷量的排序为6.5 >7.5 >5.5 >DAD>4.5 。初始pH值为6.5 实验组的比产氢量和产甲烷量最大,分别为90.6 3 mL/g和199.3 3 mL/g。
木薯酒精废水联产氢气和甲烷的两级厌氧消化实验中,初始pH值为7.5,6.5,5.5,4.5实验组和DAD对照组中的能源转换效率分别为61.9 4%,69.9 4%,53.2 6%,47.7 1%,50.9 3%。其中,初始pH值为6.5 实验组的两级厌氧消化的能源转化率最高,比直接厌氧消化提高了19.0 1%。
