基于3,5-二硝基水杨酸比色法探究苹果中可溶性糖测定方法及其含量*
2021-07-24高贯威匡立学李银萍李海飞徐国锋
高贯威,匡立学,李银萍,李 静,李海飞,徐国锋
(中国农业科学院果树研究所,农业农村部果品质量安全风险评估实验室(兴城),农业农村部果品及苗木质量监督检验 测试中心(兴城),辽宁兴城125100)
可溶性糖是衡量水果及其制品风味品质的重要指标[1-2]。果品中可溶性糖以葡萄糖、果糖和蔗糖为主[3-5],但其构成在不同水果中存在差异。根据主要可溶性糖的种类不同,水果可分为果糖积累型和蔗糖积累型[6]。苹果是我国第一大水果,其产量和消费量均居我国园林水果首位[7-8]。苹果中可溶性糖是其甜度和风味品质的关键因素[9],且以果糖为主,其次是蔗糖和葡萄糖[10]。苹果中可溶性糖组分和含量的研究已有报道[11-13]。然而,其组分间定量关系的探讨比较欠缺。另外,研究表明,苹果中可溶性糖含量与其可溶性固形物含量之间呈极显著正相关[10]。二者均是决定水果风味的关键性因素[6],是水果品质的重要监测指标。
《水果及制品可溶性糖的测定 3,5-二硝基水杨酸比色法》[14](以下简称3,5-二硝基水杨酸比色法)在水果可溶性糖检测工作中的应用非常广泛。此方法测定原理是将可溶性非还原糖进行酸化,并转化为还原糖,碱性条件下与3,5-二硝基水杨酸反应生成棕红色的氨基化合物,该氨基化合物在540 nm 波长下有特定吸光值。然而,3,5-二硝基水杨酸比色法中存在一定的不确定表述,易造成人们对测定结果产生异议。比如,水浴加热后的试样是否冷却再加入乙酸锌和亚铁氰化钾,方法中并未指明。另外,为保证反应的碱性条件,试样中逐步加入氢氧化钠(NaOH)溶液至溶液呈“浅橙色”(甲基红试剂)。然而,浅橙色的判断易因人而异。
本研究探究了3,5-二硝基水杨酸比色法中不确定因素在可变范围内对可溶性糖检测结果的影响,降低了苹果中可溶性糖测定结果的异议。另外,本研究采用优化后的方法测定了100 个苹果样品中可溶性糖含量,并根据NY/T 2637—2014《水果和蔬菜可溶性固形物含量的测定 折射仪法》(以下简称NY/T 2637—2014)[15]测定了其可溶性固形物含量,为苹果中可溶性糖和可溶性固形物含量分析提供了数据支撑。
1 材料与方法
1.1 样品
苹果样品均来自农业农村部果品及苗木质量监督检验测试中心(兴城)。
1.2 可溶性糖和可溶性固形物含量的测定
可溶性糖含量按照NY/T 2742—2015 标准中的步骤测定,可溶性固形物含量采用 PR-101α 数显式全糖仪测定。
2 结果与分析
2.1 乙酸锌和亚铁氰化钾
样品经过水浴加热后,为避免样品中的蛋白质影响糖的测定,加入亚铁氰化钾和乙酸锌溶液,将蛋白质沉淀。然而,样品是否需要冷却,3,5-二硝基水杨酸比色法未进行准确表述。为验证亚铁氰化钾和乙酸锌溶液加入时间,将相同苹果样品水浴加热,并在冷却前后的样品中均加入亚铁氰化钾和乙酸锌溶液,而后按照相同步骤测定其可溶性糖含量(n=3)。测定结果表明,冷却前后样品中可溶性糖含量平均值分别为15.0%、14.5%,前者略高于后者。然而,二者相对偏差为3.1%,远低于NY/T 2742—2015标准中重复性条件下2 次独立测试结果限定的标准偏差(10%),表明亚铁氰化钾和乙酸锌溶液加入时,样品是否冷却对苹果中可溶性糖含量测定值影响不大。
2.2 颜色调节
还原糖与3,5-二硝基水杨酸的反应需要碱性条件,因此样品溶液中需要加入NaOH 溶液,并以甲基红指示剂判定样品酸碱度。3,5-二硝基水杨酸比色法中指出样品溶液调节至“浅橙色”时即可满足检测需求。然而,溶液颜色肉眼判断因人而异。
将相同样品逐步提高NaOH 溶液的加入体积,分别调节至肉眼易判断的浅红色、橙黄色和浅黄色,并按照相同步骤测定样品吸光度值(n=5)。结果如表1 所示,样液呈现浅红色、橙黄色和浅黄色时,其吸光度值分别为0.757~0.816、0.793~0.849 和0.779~0.838。经SPSS 数据分析,颜色调节为浅红色时,样品吸光度值平均值为0.788(n=5),显著低于橙黄色样品吸光度值(0.817)。同时,橙黄色和浅黄色样品吸光度值之间无显著差异(P<0.05)。表明甲基红指示剂指示下,需要将样品采用NaOH 溶液调节至无明显红色,橙黄色或者浅黄色时(NaOH 溶液稍过量)样品中可溶性糖检测结果无显著差别。
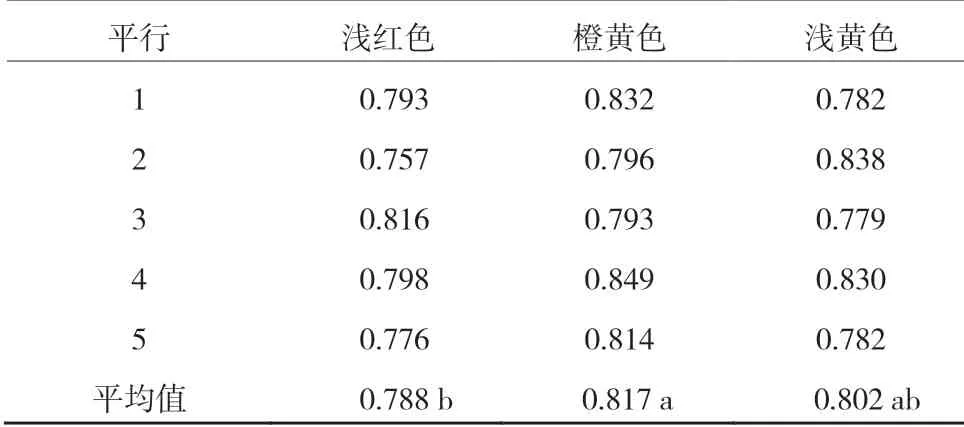
表1 调节至不同颜色时相同样品最终吸光度值比较
2.3 葡萄糖标准物质
标准物质是样品中目标物含量测定的衡量基准,是测定结果准确与否的关键。3,5-二硝基水杨酸比色法中采用葡萄糖作为标准物质,并规定葡萄糖需要干燥处理。在实际操作中,干燥环节常常被忽略。本研究将葡萄糖标准物质在80 ℃下干燥2 h,并将干燥前后标准物质配制成1 mg/mL 的水溶液,继而分别配制浓度为0.02、0.04、0.06、0.08、0.10 mg/mL 的标准溶液,按照NY/T 2742—2015 中的步骤使其与3,5-二硝基水杨酸反应,并分别测定吸光度值。
如图1 所示,干燥前后标准溶液吸光度值与浓度线性关系良好,R2均大于0.99。烘干后标准品最终吸光度值明显高于烘干前标准品,表明长时间储存的标准品中可能含有一定量的水分,造成标准物质纯度不足,吸光度值相对较低。经计算,同一个苹果样品分别经干燥前后标准物质的吸光度值-浓度线性曲线计算,可溶性糖测定值前者高于后者12%(以干燥后标准物质为基准)。因此,葡萄糖标准物质的干燥对测定果品中可溶性糖含量至关重要。
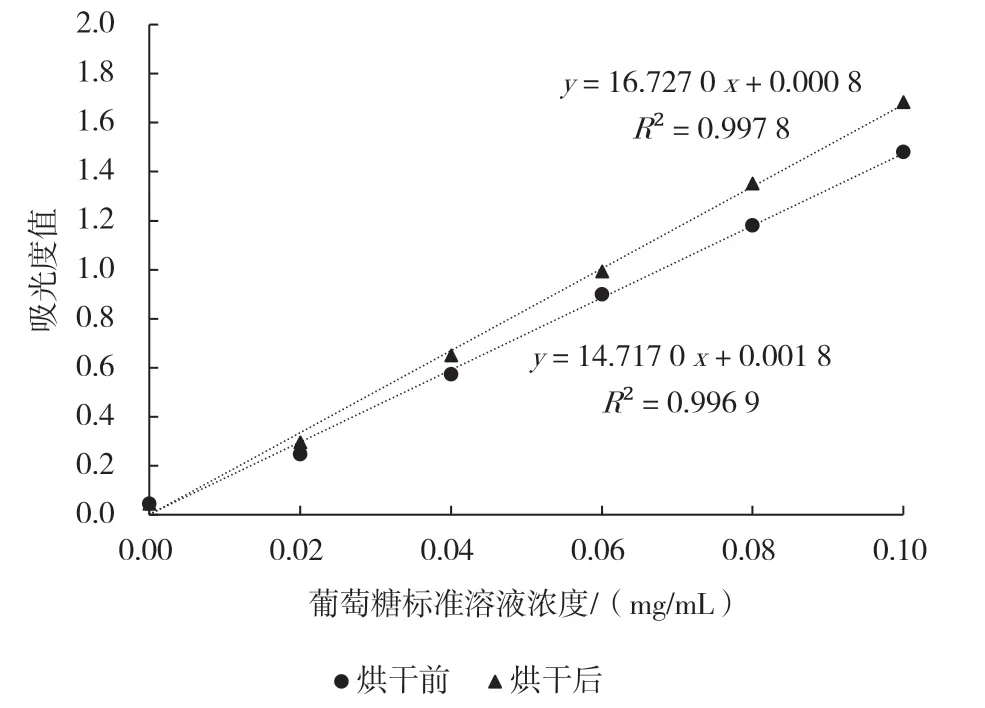
图1 烘干前后葡萄糖标准品浓度与吸光度值线性曲线
2.4 碳酸钙(CaCO3)
已废标准GB 6194—1986[16]标注,有机酸含量比较高的样品中应加入0.5~2.0 g CaCO3调节样品溶液至中性,现行标准NY/T 2742—2015 并未标注CaCO3是否加入。因此,实际操作中,检测人员对CaCO3是否需要加入呈疑惑状态。本研究将10 g 已匀浆苹果样品(n=6)称量至烧杯中后,加入CaCO3约1.5 g。另外,相同样品未加入CaCO3,按照3,5-二硝基水杨酸比色法测定样品的吸光度值。
结果表明,加入和未加CaCO3的样品最终吸光度值(n=6)平均分别为0.977、0.982,经过SPSS分析,二者吸光度值无显著差异(P<0.05)。然而,如图2 所示,当加入CaCO3时样品吸光度值为0.894~1.037,吸光度值波动范围较大。同时,未加入CaCO3的样品吸光度值比较稳定(0.975~0.995)。因此,本研究结果表明苹果可溶性糖测定时无需加入CaCO3。
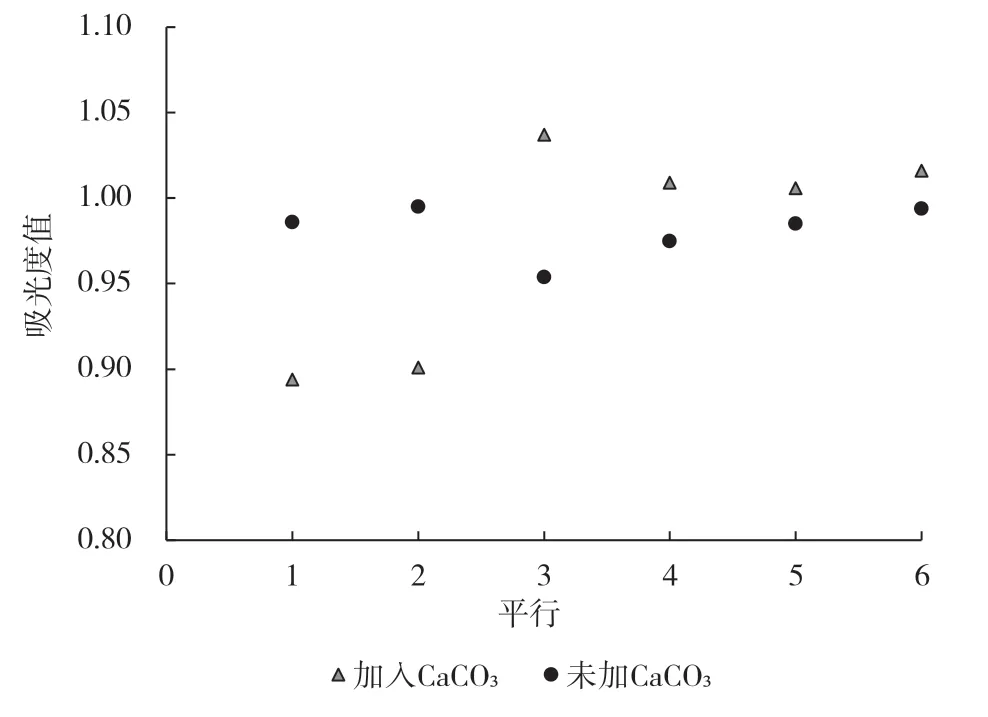
图2 CaCO3 对苹果样品可溶性糖测定最终吸光度值的影响
2.5 苹果可溶性固形物和可溶性糖含量测定
根据验证后的方法,测定了100 个苹果样品中可溶性糖含量,并根据NY/T 2637—2014[15]测定其可溶性固形物含量。结果表明,苹果中可溶性糖和可溶性固形物含量分别为8.9%~15.0%、11.5%~18.4%(图3),与前人研究结果相近[10,17]。苹果样品中可溶性糖含量在可溶性固形物含量中的比重(糖固比)平均为77.8%,且二者呈显著正相关,相关系数为0.783,与前人研究结果(0.735)相近[17]。水果中可溶性固形物含量采用PR-101α 数显式全糖仪测定,操作简单、数值稳定。因此,可溶性糖含量测定值出现异常时,可参考相应样品中可溶性固形物含量测定值进行判定。
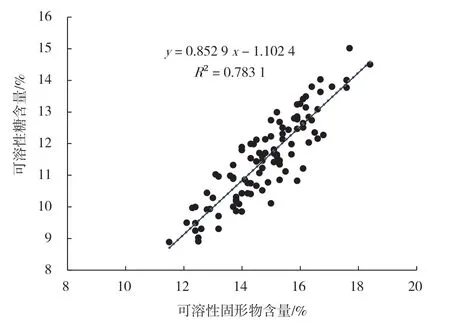
图3 苹果样品中可溶性糖及可溶性固形物含量(n=100)
3 结论与讨论
本研究探究了3,5-二硝基水杨酸比色法中不确定表述,并分析了其在可变范围内对可溶性糖检测结果的影响。对比样品冷却前后加入亚铁氰化钾和乙酸锌溶液,二者可溶性糖测定值相对偏差为3.1%,远低于NY/T 2742—2015 标准限定的标准偏差(10%),表明样品冷却前后均可加入亚铁氰化钾和乙酸锌溶液。
采用NaOH 溶液调节样品颜色至浅红色时,样品吸光度值平均为0.788(n=5),显著低于橙黄色样品(0.817),NaOH 溶液加入量较多的橙黄色和浅黄色样品吸光度值之间无显著差异(P<0.05),表明测定苹果样品中可溶性糖时,甲基红指示剂指示下,需要将样品调节至无明显红色,NaOH 溶液稍过量对样品中可溶性糖检测结果影响较小。
未烘干葡萄糖标准品中可能含有一定量的水分,造成纯度不足,吸光度较低。本文中,样品经干燥前标准物质的浓度-吸光度值线性曲线计算,可溶性糖测定值偏高12%(以干燥后标准物质为基准)。因此,可溶性糖测定过程中务必定期将葡萄糖标准物质进行干燥处理。
CaCO3是否加入对苹果样品中可溶性糖测定结果影响不大,而且加入CaCO3时平行样品之间吸光度值相差较大,因此可溶性糖测定过程中无需加入CaCO3。
苹果中可溶性糖主要为果糖,其次为蔗糖和葡萄糖[10]。3,5-二硝基水杨酸比色法中,以葡萄糖(还原性糖)为标准品,并将样品中的蔗糖酸化分解成为果糖(还原性糖)和葡萄糖。相近,已废标准GB 6194—1986[16]中将标准品蔗糖进行酸化,使其转化成还原性糖(果糖和葡萄糖),同时将样品中蔗糖转化为还原糖,依此测定水果、蔬菜中可溶性糖含量。然而,样品中和水溶液中蔗糖转化效率可能存在差异,果糖与葡萄糖还原效率也可能不同。水果中可溶性糖组成存在差异,多数果品以葡萄糖、果糖和蔗糖中的某一种为主[6]。因此,将葡萄糖、果糖和蔗糖在检测仪器中分别进行测定可能是可溶性糖含量更为准确的测定方法。
