含油微藻的选育及其冷冻保藏研究
2021-07-24李澜鹏廖莎王鹏翔孙启梅师文静李晓姝张霖彭绍忠
李澜鹏,廖莎,王鹏翔,孙启梅,师文静,李晓姝,张霖,彭绍忠
(中国石油化工股份有限公司大连石油化工研究院,辽宁 大连 116045)
近10 年来,中国的石油消费量和石油进口量快速增加,要依赖进口来补充。能源多元化是保障能源安全,实现可持续发展的一个重要方向。生物燃料是传统化石燃料的理想替代品[1]。
微藻作为细胞工厂具有诸多优势,如生长周期短、可以捕集CO2、光合效率高,CO2固定效率一般可达陆生植物的10~50 倍[2]。微藻生长速度快还能积累淀粉、油脂等高附加值产品,且不占用耕地,有广阔的发展前景[3,4]。
藻种是重要的自然资源,藻种的保藏是一项重要的基础研究工作[5]。从自然界获得优良藻种来之不易,保障藻种在科研和生产过程中的优良性能,减少藻种的退化和死亡,具有十分重要的意义[6]。常用的微藻保存方法有继代法保存、固定化法保存、超低温保存、浓缩低温保存、冷冻真空干燥保存和低温甘油生理盐水保存[7,8]。目前在微藻养殖技术的开发和微藻育种方面开展了许多有益的工作,纷纷建立了自己的藻种资源库。各类藻种库一般采用低温液体传代保藏法和琼脂固体传代保藏法保藏藻种,但保藏时间一般不超过1 年,频繁传代容易污染藻种,引发突变,导致藻种性能下降。本文从自然界中筛选到10 株产油微藻,选取5 株作为研究对象进行分子生物学鉴定,研究含油微藻的冷冻保藏方法,为含油脂类微藻的稳定保藏提供数据支持。
1 材料与方法
1.1 材料
1.1.1 试剂
二乙酸荧光素购自Sigma。
1.1.2 仪器
显微镜,徕卡公司;智能光照培养箱,杭州会尔公司;冷冻离心机,日本日立公司;冷冻干燥机,美国SIM 公司;微型生物反应器(BioLector),M2P-Labs;紫外分光光度计,美国PE 公司;CASY,德国INNOVATIS 公司。
1.2 藻种的筛选
1.2.1 微藻的筛选及分离纯化
将采自东北地区水域含有浮游微藻的藻液水样用纱布过滤去掉较大的沉淀物,取100 mL 滤液转入500 mL 的三角摇瓶中,加入100 mL BG11 培养基进行富集培养[9]。培养基成分为:NaNO31.5 g,K2HPO4·3H2O 0.04 g,MgSO4·7H2O 0.075 g,CaCl2·2H2O 0.036 g,柠檬酸0.006 g,柠檬酸铁铵0.006 g,EDTA 0.001 g,NaCO30.02 g 和A5+Co 溶液1 mL。其中A5+Co 溶液的配方为:H3BO32.86 g,MnCl2·H2O 1.81 g,ZnSO4·7H2O 0.222 g,CuSO4·5H2O 0.079 g,Na2MoO4·2H2O 0.390 g 和Co(NO3)2·6H2O 0.049 g。在恒温光照振荡摇床中进行,培养温度为25~28℃,光照强度为3 000 Lux,光暗时间比为14∶10,摇床转速为120 r·min-1,培养至溶液呈现明显绿色的富集藻液。
采用稀释涂布法对分离纯化富集藻液。采用梯度法稀释富集藻液,用无菌滴管移取1~2 滴稀释藻液于琼脂的边缘,均匀涂于平板的琼脂表面封口膜密封,在温度为25℃,光照强度为3 000 Lux,光暗时间比为14∶10 的恒温光照培养箱中培养。培养到长出单菌落后挑取单克隆进行平板划线,重复多次直至得到纯种微藻。
1.2.2 藻种的培养
得到的纯种微藻经静置培养至对数生长期后,按接种量5%分别接种至微藻柱式光照反应器上进行生长评价,反应器中装液量为200 mL,温度为25~28℃,光暗比为14∶10,通入空气量为0.5 L·min-1,每天通入大约1 min CO2来调节培养液的pH,培养至稳定期。
1.3 藻种冷冻保藏的方法
选择5 株生长快速且含油量高的藻种为目标藻种的新鲜藻液.分别离心(4 000 r·min-1,3 min),去离子水洗两次后,加入新鲜培养基重悬,取出部分微藻加入不同保护剂,分别放置于-18℃和-80℃保藏。一个月后,将保藏微藻取出,解冻、摇匀、离心,用生理盐水洗两次,去除保护剂后一部分检测细胞活性评价,一部分接种到新鲜培养基进行生长评价。取5 种保护剂∶甘油(GLY)、二甲基亚砜(DMSO)、蔗糖(SUC)、聚乙二醇(PEG)和羟二基淀粉(HES)。确定保护剂后进一步考察保护剂浓度(10%、20%、30%、40%和50%)和3 个月、6 个月、9个月以及1 年保藏时间。
1.4 分析方法
1.4.1 生物量
采用Lambda45 UV/VIS Spectromete 在698 nm处检测生物量,取两个测量误差在±10%平行样的平均值。
取4 mL 藻液,7 000 r·min-1离心5 min,用去离子水洗涤2 次,置于80℃烘箱中烘至衡重,取两个测量误差在±10%平行样的细胞干重平均值。
1.4.2 油脂含量分析
采用乙酸乙酯正己烷法测定总脂含量[9]。称量100 mg 左右干藻粉(重量计为m),放入瓷研钵中,加入适量石英砂和液氮,待液氮挥发后,研磨破壁,放入离心管。加入体积比为1 的乙酸乙酯和正己烷混合有机溶剂,超声清洗仪处理20 min,50℃恒温水浴中提取45 min。提取后离心15 min,收集上清液至离心管中。提取液中加入等体积的蒸馏水,震荡混匀后离心4 min,收集上层有机相至已烘干的玻璃试管中,玻璃管净重为W0。80℃水浴蒸发玻璃试管中的溶剂后,80℃烘箱烘干至恒重,重量为W1。计算藻细胞的总脂含量为C(%):C=100×(W1-W0)/m。
1.4.3 细胞活力表征
对比荧光素二醋酸酯染色法(FDA)、I2-KI 试剂染色法、总叶绿素检测法和快速细胞计数法四种检测存活率的方法,建立了适合目标藻种检测方法。用新鲜培养的藻液计算微藻活细胞的活力,以死细胞做对照。在10 mL 藻细胞液中加入1 mL 鲁哥氏溶液,于黑暗中放置48 h,使细胞固定。固定后的细胞已全部失去活性,但细胞个体没有破碎分解[10]。固定后的藻细胞液在3 000 r·min-1转速下离心,用培养基重悬3~4 次,直到将鲁哥氏溶液清洗干净,溶液变成无色。重悬后的细胞作为死亡细胞进行染色或检测。
碘染色法[11]:称取0.65 g I2和2.0 g KI 于烧杯中,加少许去离子水,搅拌使其溶解,用去离子水定容至500 mL,配置成0.01 N I2-KI 试剂贮存于棕色瓶中,放入4℃冰箱中。取1 mL 试剂加入样品中,振荡混匀进行染色。用吸管吸取少量目标微藻保藏样品置于载玻片中央,盖上盖玻片,在显微镜下计数细胞。相对存活率%=保藏后细胞数/保藏前细胞数。
总叶绿素检测法[12]:取新鲜藻液10 mL,4 000 r·min-1离心3 min,弃上清液,藻泥中加入适量的丙酮,冰浴研磨5 min,4 000 r·min-1离心后,上清液转入10 mL 容量瓶。继续用上述方法对藻体沉淀、萃取,纸质藻体沉淀成白色未知。定容后在紫外分光光度计上测定其吸收峰值。狭缝宽度0.5 nm,吸收峰I 波长663 nm,吸收峰II 波长645 nm,计算公式为:藻总叶绿素值=OD663×8.02+OD645×20.21。
快速细胞技术分析法。采用CASY 快速细胞活力分析仪,检测目标微藻活细胞和死细胞的活力范围,被检样品通过检测直接得到存活率。
二醋酸荧光素法[13]染色:将4.16 mg 二醋酸荧光素溶于10 mL 丙酮中配制成浓度为1 mmol 的母液,置于在-18℃冰箱中保存。新鲜藻液离心,用无菌去离子水清洗1~2 次,用去离子水悬浮细胞。取5 mL 上述稀释藻液,加入60 μmol FDA,振荡混匀进行荧光染色,每5 min 振荡一次,于室温下避光放置30 min。染色结束后取样镜检。同时,取样点在48 孔荧光分析用黑板上,每孔1 mL,置于BioLector在525 nm 下检测荧光值(FDA 激发波长为480 nm),2 个平行样。细胞活力的计算公式为:相对细胞活性(%)=(处理组保藏后稀释液的荧光值/对照细胞悬液的荧光值)×100%。以水作空白对照。
2 结果与分析
2.1 细胞活性评价
对比四种细胞活性表征方法的结果如下。理论上采用I2-KI 试剂染色微藻细胞,存活细胞的核及色素体被染色后变为深褐色,而死亡细胞的内含物则基本不被染色,据此可以确定微藻的存活率[12]。I2-KI 试剂微藻染色情况如图1 所示,外观上显示,I2-KI 试剂起到一定的染色效果,但从显微镜检观察看,染色效果不明显,无法判断微藻是否存活。

图1 藻细胞的I2-KI 染色Fig.1 I2-KI staining of the microalga
微藻细胞中的叶绿素含量反应微藻的生长和存活状态。检测发现:新鲜细胞总叶绿素为302.9098,死细胞总叶绿素为144.2848(空白对照0)。死藻细胞值与空白差异较大,表明该方法检测误差较大。
采用CASY 快速细胞活力分析仪检测活细胞和死细胞的活力范围时,把细胞悬浮在容器中,以恒定的速度通过一个精确的圆孔,通过电极进行测量。测量细胞孔时,体积不同表现出不同的电解量。完整的细胞被当作绝缘体,具很高的电阻。相反,死细胞细胞膜不再成为电阻,从而得到细胞的分布。经CASY 分析仪得到目标微藻细胞分布图(图2),4.0~6.15 为活细胞,6.15~15 为死细胞。

图2 微藻细胞分布Fig.2 Distribution of microalgae cells
1966 年,Rotman 和Papermaser 提出采用荧光素二醋酸酯(FDA)染色来显示细胞生活力[14,15]。荧光素二醋酸酯自身不产生荧光,它进入细胞后,与胞内的内酯酶发生反应分解产生荧光素,使细胞发出荧光。死细胞内酯酶失活,不显示荧光。早期,人们采用美蓝(0.02%)和沙黄(0.1%)染色鉴定蓝藻细胞活力。该方法简单快捷,但效果不稳定。郭厚良采用二醋酸酯分析蓝藻细胞生活力[16]。对比研究表明:该方法可行、可靠。目标微藻染色后取样镜检结果见图3。以水做空白,检测得空白荧光值(FDA)为0.964,死细胞荧光值1.007,活细胞荧光值为44.901。死细胞荧光值和空白基本接近,表明方法检测比较准确。在此基础上考察生物量同FDA 的关系,当OD689小于5.0 时,OD 与FDA 成近似线性关系,OD 对FDA 的影响不太大。因此,当OD689<5.0时,相对细胞活性(%)=(处理组保藏后稀释液的荧光值/OD)/(对照细胞悬液的荧光值/OD)×100%;当OD689>5.0 时,相对细胞活性(%)=(处理组保藏后稀释液的荧光值/ 对照细胞悬液的荧光值)×100%。
图3 微藻细胞二醋酸染色Fig.3 FDA staining of the microalgae
2.2 自然界中含油藻种的选育
从东北地区水域种筛选出17 株微藻,经摇瓶光照培养至对数生长期后,以5%的量接种至柱式光照反应器上进行筛选评价(图4)。培养第4 d 微藻进入快速生长阶段,随后缓慢生长,以生长为指标评价挑选出HCSB1、MHB3、MHJB4、SFB1、SSB1、SSB6、SSB7、SHJB1、SHJB2 和Y3 10 株藻种的油脂产量。
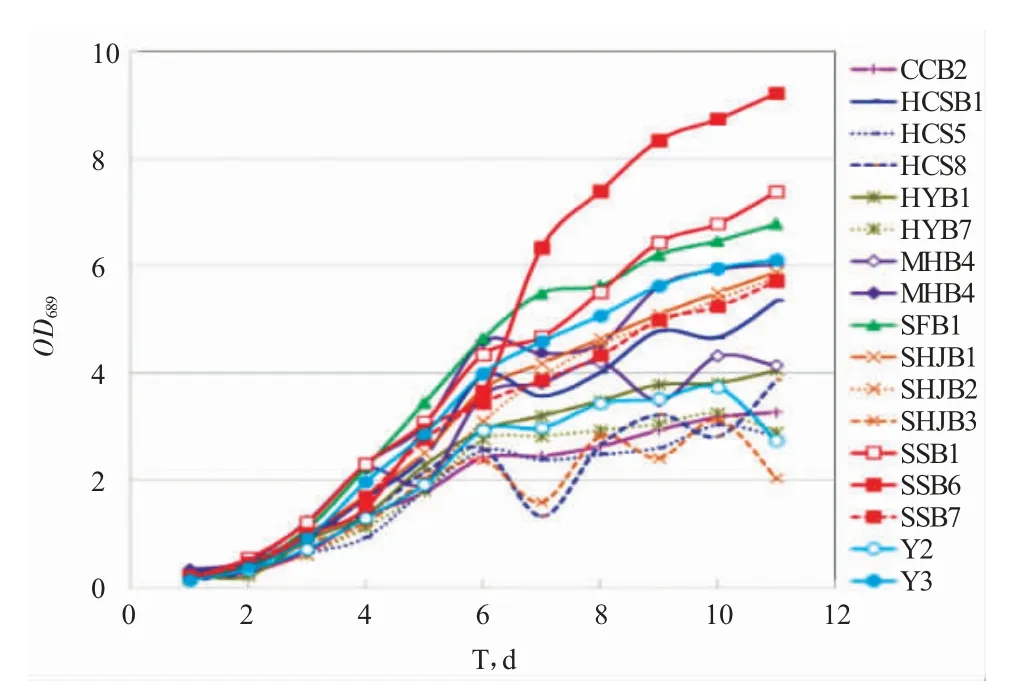
图4 筛选藻种的生长情况Fig.4 Growth curves of selected microalgae
经过柱式光照生物反应器培养至稳定期,测定了10 株生长较快的微藻生长及油脂含量(表1)。10株微藻中SHJB1 和Y3 生长相对较慢,油脂产率几乎都在20 mg·L-1·d-1以上,其中HCSB1 生物量最大达到1.8305 g·L-1,SSB7 油脂产率最大达到29 mg·L-1·d-1。由表2 可知:HCSB1 油脂含量较低,综合微藻来源地区、微藻形态、生长速率和油脂含量,选择HCSB1、MHB4、SHJB1、SFB1 和SSB6 作为研究对象考察冷冻保藏方式对含油微藻的影响,用18S rDNA 测定了5 株微藻菌株的基因片段,运用NCBI 数据库中的BLAST 工具进行序列比对,获得目标同源序列;然后运用Clustal W 对获得的同源序列进行多重比对,根据此结果,运用MEGA7.0 软件,基于最大似然算法,选1 000 次重复的bootstrap 进行分析,构建系统发育树确定了微藻种属(表2)。
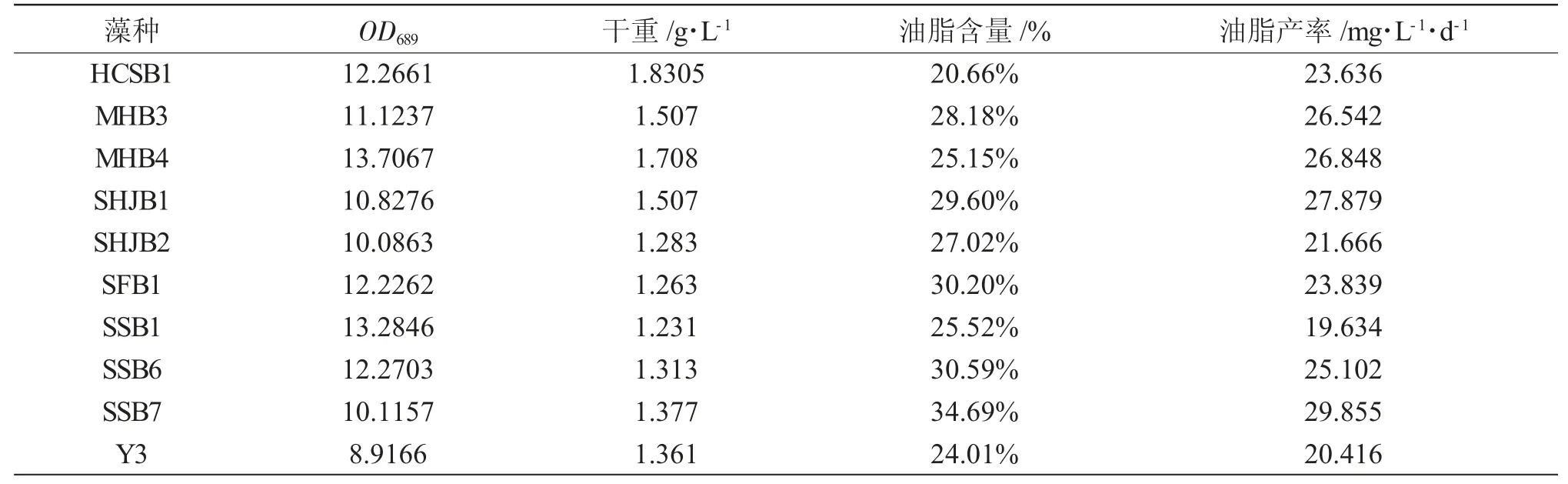
表1 藻种生物量及油脂含量Tab.1 Biomass and oil content of selected microalgae

表2 藻种的鉴定与表征Tab.2 Identification and morphology of the microalgae
2.3 冷冻保藏方法
2.3.1 保护剂对微藻冷冻保藏的影响
按能否渗透到细胞内,保护剂种类通常分为渗透型和非渗透性两种[17]。本研究选取渗透型保护剂甘油(GLY)和二甲基亚砜(DMSO),非渗透型保护剂蔗糖(SUC)、聚乙二醇(PEG)和羟二基淀粉(HES)。五种保护剂对不同微藻保护作用程度不同(图5)。聚乙二醇(PEG)对微藻的保护效果最差,复苏培养后生长也最差。综合比较甘油(GLY)、二甲基亚砜(DMSO)和蔗糖(SUC)保藏效果相对较好。综合两个温度段,总体考量甘油(GLY)和二甲基亚砜(DMSO)对五种微藻的保藏效果更好。
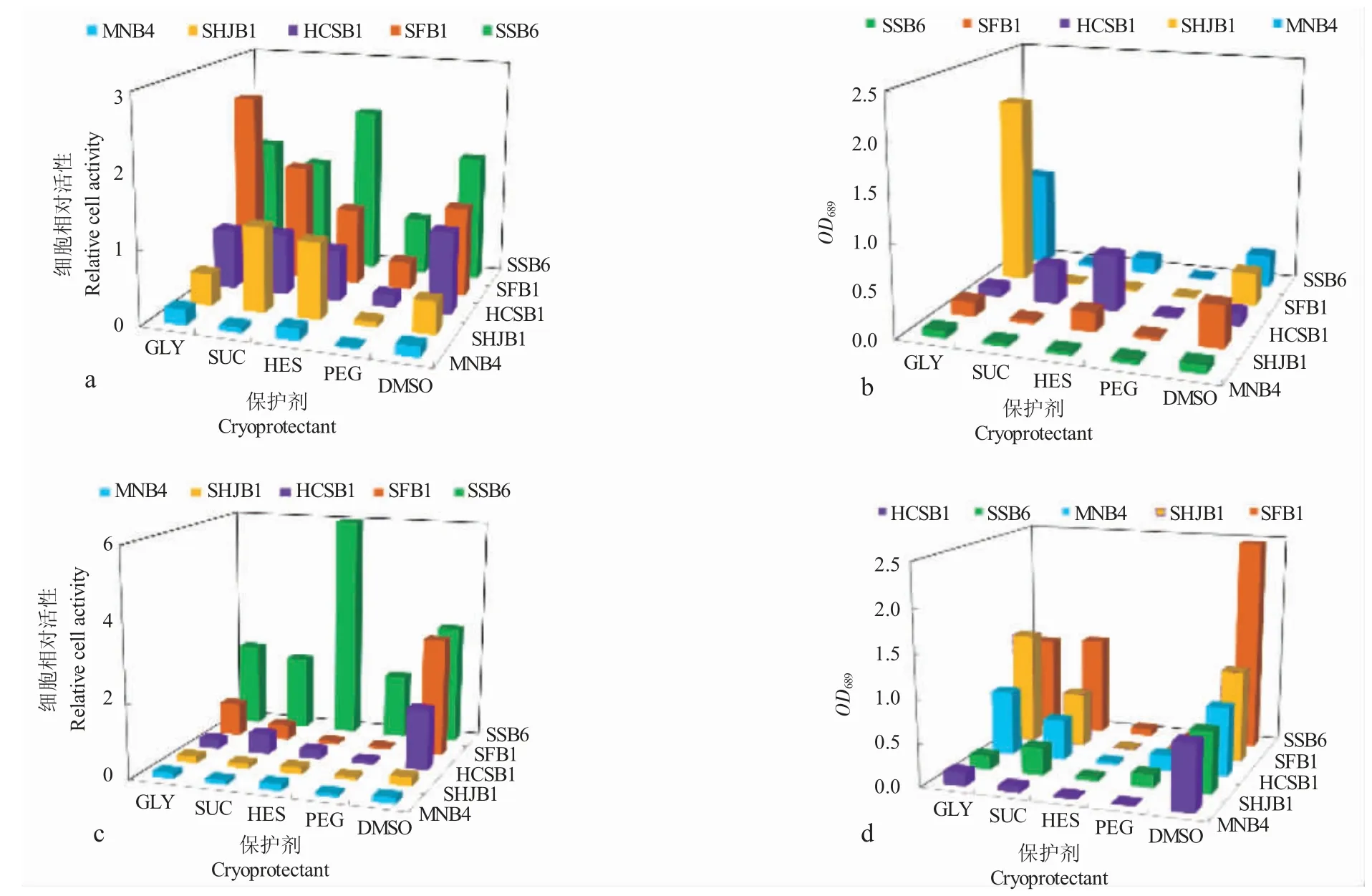
图5 不同保护剂的保藏效果Fig.5 The effect of different cryoprotectants on cryopreservation
2.3.2 保护剂浓度对微藻冷冻保藏的影响
渗透性保护剂在保护细胞的同时,也具有一定程度的毒害作用。保护剂的浓度是微藻冷冻保藏的重要指标。-18℃下,甘油(GLY)保藏SSB6、MHB4、SFB1、HCSB1 和SHJB1,最佳保护浓度分别为50%、40%、10%、50%和30%;二甲基亚砜(DMSO)保藏SSB6、MHB4、SFB1、HCSB1 和SHJB1,最佳保护浓度分别为30%、40%、10%、50%和30%(图6)。试验表明,同种微藻,相同保护剂浓度,甘油(GLY)保藏微藻的存活率高于二甲基亚砜(DMSO);同种微藻不同保护剂,最佳保护剂浓度基本一致。
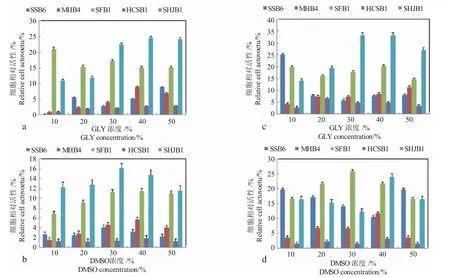
图6 不同浓度保护剂的保藏效果Fig.6 The effect of different cryoprotectant concentrations on cryopreservation of the microalgae
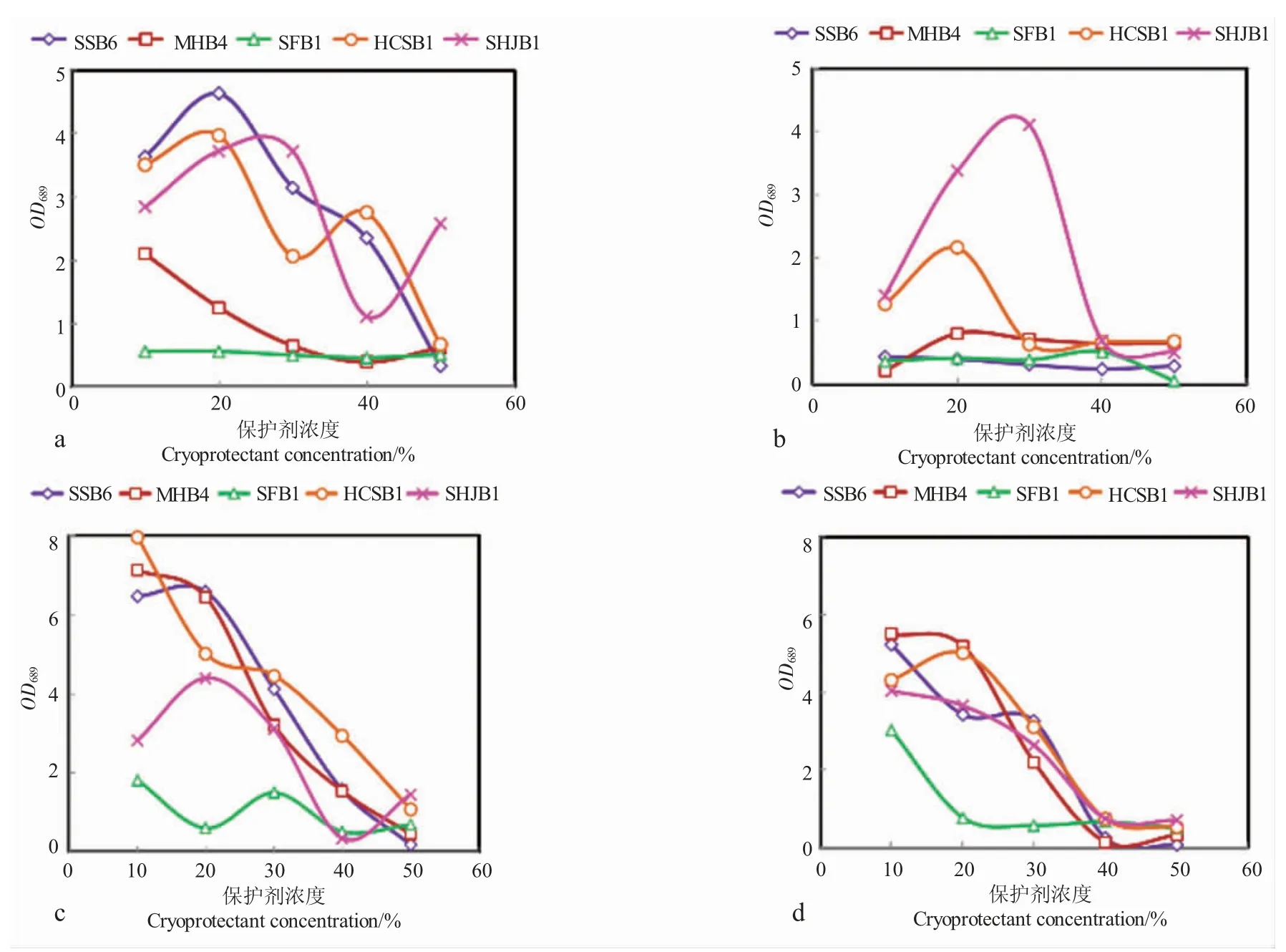
图7 不同浓度保护剂保藏微藻的复苏效果Fig.7 The effect of microalgae cryopreservation on resuscitation
采用-18℃20%甘油对5 种微藻均保藏一年,保藏前后生物量和油脂含量的变化如图8。除SFB1外,其他4 株微藻保藏前后生物量和油脂含量均保持稳定。结果表明,该方法适用于多数含油微藻,且可保持至少一年。

图8 微藻保藏一年的生物活性Fig.8 The cell activity after storing for one year
3 讨论
3.1 藻种选育及细胞活力表征
本研究从东北地区河流或湖泊中筛选出10 株具有产油性能的微藻,最高生物量达到1.8305 g·L-1,最高油脂产率达29 mg·L-1·d-1。从中挑选出5 株作为研究对象进行18S rDNA鉴定,分别为Scenedesmus、Desmodesmus、Monoraphidium、Chlorella 和Mono -raphidium。4 种染色方法表征细胞活力,原理和使用仪器各不相同。碘染色法,染色前后变化不大,无法准确判断死活细胞;总叶绿素法快捷,但结果不太准确;快速细胞计数法,方便结果准确,但CASY 快速细胞活力分析仪容易发生毛细管堵塞;FDA 染色法,方便快捷,可同时分析多个样品且结果相比准确。值得注意的是,二醋酸酯染液应现用现配,放置时间过长染色效果下降,气温超过20℃,细胞的荧光也会很快消退[16]。对比4 种细胞活力表征方法,二醋酸荧光素检测快速且准确。
3.2 不同保护剂对藻种冷冻保藏的影响
微藻处于冷冻状态时代谢活动几乎停止,达到长期保存的目的。但过低的温度使微藻细胞内的水分形成冰晶,引起细胞,特别是细胞膜的损伤。采取快速冷冻,微藻细胞内产生的冰晶小,减少对细胞的损伤;冷冻时添加保护剂也能缓解对细胞的损伤。甘油(GLY)和二甲基亚砜(DMSO)为渗透性保护剂,是许多化合物良好的溶剂,这种保护剂容易进入细胞,在胞内与水很好地互溶,发生水合作用保持水分且增加溶液粘性,防止冷冻过程细胞脱水及产生冰晶,更好地保持细胞活性。蔗糖(SUC)、聚乙二醇(PEG)和羟二基淀粉(HES)均属于非渗透性保护剂,它们只能吸附在细胞表面形成黏液层,阻止水分进出细胞,同时利用增大溶液黏度来阻止冰晶的生长对细胞的破坏。
本研究结果表明,渗透性保护剂的效果优于非渗透性保护剂。从细胞活性和细胞复苏的结果比较看,保藏效果不能单一从细胞活性角度,应综合细胞复苏的效果来验证。从整体综合来看,-18℃保藏微藻时,两种保护剂浓度为20%时,微藻生长较好;-80℃保藏微藻时,两种保护剂浓度为10%时,微藻生长较好。当保护剂浓度超过20%时,大多数微藻表观细胞活力未受影响。细胞复苏生长结果表明,高浓度的保护剂对微藻具一定毒害,影响细胞生长。二甲基亚砜(DMSO)比甘油毒性更大,因此采用-18℃20%甘油(GLY)或-80℃10%甘油(GLY)对微藻进行冷冻保藏,该方法适用于大多数含油微藻,且可保藏微藻至少1 年,微藻细胞生物量和油脂含量稳定,为未来微藻生产生物柴油奠定了基础。
