不同开口饵料对黑斑原仔鱼生长和消化酶活性的影响
2021-07-24王万良王金林曾本和周建设
王万良,王金林,曾本和,周建设
(西藏自治区农牧科学院水产科学研究所,西藏 拉萨 850000)
1 材料与方法
1.1 材料
1.2 方法
实验在平列槽中进行,每个平列槽(280 cm×50 cm×25 cm)用网一分为三,隔离规格为60 cm×50 cm×25 cm,确保环境一致,共设置11 个处理,每个处理3 个平行,每个平行仔鱼300 尾,共计9 900尾。每个处理分别投喂微粒子饲料(Ⅰ组)、冰冻摇蚊幼虫(Ⅱ组)、搅碎的猪肝(Ⅲ组)、微粒子饲料+螺旋藻(9∶1)(Ⅳ组)、摇蚊幼虫+螺旋藻(9∶1)(Ⅴ组)、猪肝+螺旋藻(9∶1)(Ⅵ组)、微粒子饲料+螺旋藻+摇蚊幼虫(4∶1∶5)(Ⅶ组)、微粒子饲料+螺旋藻+猪肝(4∶1∶5)(Ⅷ组)、微粒子饲料+螺旋藻+轮虫(4∶1∶5)(Ⅸ组)、微粒子饲料+苍蝇幼虫(1∶1)(Ⅹ组)和人工配合饲料(Ⅺ组)。
表1 黑斑原鱼苗人工配合饲料配方Tab.1 Formula of artificial compound diet for Glyptosternum maculatum

表1 黑斑原鱼苗人工配合饲料配方Tab.1 Formula of artificial compound diet for Glyptosternum maculatum
注:饲料营养成分为实测值a.多维中(mg/kg 饲料):盐酸硫胺素(98%)25,维生素B2(80%)45,盐酸吡哆醇(99%)20,维生素B12(1%)10,维生素K(51%)10,肌醇(98%)800,泛酸钙(98%)60,烟酸(99%)200,叶酸(98%)20,生物素(2%)60,维生素A(500 000 IU/g)32,维生素D(500 000 IU/g)5,维生素E(50%)240,维生素C(35%)2000,抗氧化剂(克氧灵,100%)3,稻壳粉1470.2;b.多矿中(mg/kg 饲料):CoCl2·6H2O(1%)50,CuSO4·5H2O(25%)10,FeSO4·H2O(30%)80,ZnSO4·H2O(34.5%)50,MnSO4·H2O(31.8%)45,MgSO4·7H2O(15%)1200,亚硒酸钠(1%)20,碘酸钙(1%)60,沸石粉8485Notes:The diet nutrient contents are measured a.Vitamin premix provides(mg/kg diet):Thiamin(98%)25,Riboflavin(80%)45,Pyridoxine-HCl(99%)20,Vitamin B12(1%)10,VitaminK(51%)10,Inositol(98%)800,Pantothenicacid(98%)60,Niacin acid(99%)200,Folic acid(98%)20,Biotin(2%)60,Retinolacetate(500,000 IU/g)32,Cholecalciferol(500,000 IU/g)5,Alphatocopherol(50%)240,Ascorbic acid(35%)2000,Anti-oxidants(Oxygenlinggrams,100%)3,and ricehuskpowder(100%)1470.b.Mimeral premix provides(mg/kg diet):CoCl2·6H2O(1%)50,CuSO4·5H2O(25%)10,FeSO4·H2O(30%)80,ZnSO4·H2O(34.5%)50,MnSO4·H2O(31.8%)45,MgSO4·7H2O(15%)1200,Sodium selenite(1%)20,Calcium iodine(1%)60,and Zoelite 8485
实验期间,保持水温12~13℃,溶氧6 mg/L,每天下午5:50~6:00 投喂1 次,投喂时关闭进水阀门,每个平列槽用遮光板遮盖,次日7:00 清污。每周下午13:00~14:00 之间定期在平列槽静水条件下用1%盐水浸泡10 min。
每天统计死亡仔鱼尾数。每7 d 测定1 次生长,每个平行随机选取5 尾仔鱼,经麻醉后用游标卡尺逐尾测量全长(吻端至尾鳍末端),轻轻吸干体表水分后用万分之一天平称量体质量,整个实验持续6周共42 d。死亡率(%)=死亡尾数/总尾数×100。由于仔鱼个体较小,实验结束时不同实验组各取6尾,按照重量(g)体积(mL)比1∶9 的量加入预冷的0.65%生理盐水,整鱼剪碎后在4℃下以3 500 r/min离心10 min,取组织匀浆上清液,即为粗酶提取液,相关消化酶活力参照Engrola 等[12]方法测定。
数据采用SPSS17.0 软件进行统计分析,差异显著性测验采用单因素方差分析(One-way ANOVA)和Duncan's 多重比较。
2 结果与分析
2.1 不同开口饵料对黑斑原仔鱼死亡率的影响
由表2 可知,养殖7 d 时,Ⅱ组鱼死亡率最低,显著低于Ⅵ组(P<0.05),与其他各组差异不显著(P>0.05);养殖14 d 时,Ⅸ组鱼死亡率最高,显著高于Ⅱ组、Ⅲ组、Ⅳ组、Ⅴ组、Ⅶ组和Ⅺ组(P<0.05),与其他各组差异不显著(P>0.05);养殖21 d 时,Ⅹ组鱼死亡率最高,与Ⅰ组、Ⅲ组、Ⅵ组、Ⅷ组、Ⅸ组、Ⅺ组差异不显著(P>0.05),显著高于其他各组(P<0.05);养殖28 d 时,Ⅵ组鱼死亡率最高,与Ⅷ差异不显著(P>0.05),显著高于其他各组(P<0.05);养殖35 d 时,Ⅷ组鱼死亡率最高,显著高于其他各组;养殖42 d 时,Ⅱ组鱼死亡率最低,与Ⅴ组差异不显著(P>0.05),但显著低于其他各组(P<0.05),Ⅵ组死亡率最高,显著高于其他各组(P<0.05)。试验最终死亡率由低到高依次为Ⅱ组<Ⅴ组<Ⅳ组<Ⅰ组<Ⅶ组<Ⅹ组<Ⅸ<Ⅺ组<Ⅷ组<Ⅲ组<Ⅵ组,即摇蚊幼虫<(摇蚊幼虫+螺旋藻)<(微粒子饲料+螺旋藻)<微粒子饲料<(微粒子饲料+螺旋藻+摇蚊幼虫)<(微粒子饲料+苍蝇幼虫)<(微粒子饲料+螺旋藻+轮虫)<人工配合饲料<(微粒子饲料+螺旋藻+猪肝)<猪肝<(猪肝+螺藻)。
表2 不同开口饵料对黑斑原仔鱼死亡率的影响Tab.2 The effect of different weaning diets on the mortality of larval Glyptosternum maculatum

表2 不同开口饵料对黑斑原仔鱼死亡率的影响Tab.2 The effect of different weaning diets on the mortality of larval Glyptosternum maculatum
注:同列中标有不同小写字母者表示组间差异显著(P<0.05),标有相同小写字母者表示组间差异不显著(P>0.05),下同Note:means with different letters in the same column are significant differences among the groups(P <0.05),and the means with the same letter in the same column are not significant differences among the groups(P >0.05),et sequentia
2.2 不同开口饵料对黑斑原体质量的影响
由图1 可知,开口7 d、14 d 和21 d 时,各试验组鱼体质量变化均呈递增趋势。开口7 d 时,Ⅹ组鱼体质量最快,显著高于Ⅰ组和Ⅲ组(P<0.05),与其他各组差异不显著(P>0.05);开口14 d 时,Ⅳ组鱼体质量增长最慢,显著低于Ⅴ组和Ⅹ组(P<0.05),与其他各组差异不显著(P>0.05);开口21 d 时,Ⅴ组体质量增长最快,显著高于Ⅲ组、Ⅵ组、Ⅷ组和Ⅺ组(P<0.05),与其他各组差异不显著(P>0.05);开口28 d 时,Ⅲ组、Ⅵ组、Ⅷ组体质量呈负增长,Ⅲ组增长最慢,显著低于其他各组(P<0.05);开口35 d时,Ⅱ组体质量增长最快,显著高于其他各组(P<0.05),与Ⅴ组、Ⅶ组、Ⅹ组差异不显著(P>0.05);开口42 d 时,Ⅶ组生长最快,与Ⅱ组、Ⅴ组差异不显著(P>0.05),但显著高于其他各组(P<0.05)。
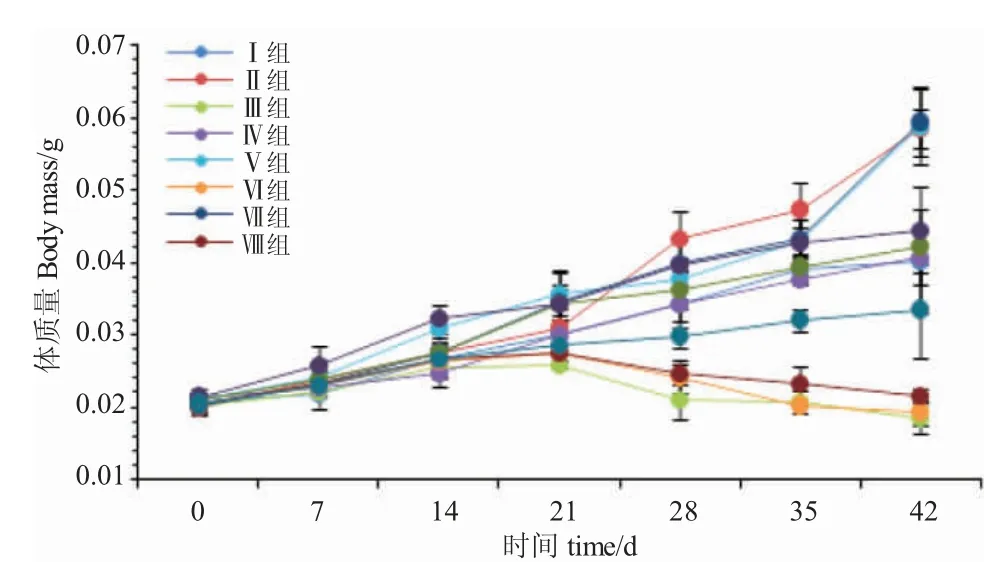
图1 摄食不同开口饵料的黑斑原仔鱼体质量的增长Fig.1 Growth of body weight of the larval Glyptosternum maculatum fed different diets
2.3 不同开口饵料对黑斑原全长的影响
由图2 可知,开口7 d、14 d 和21 d 时,各处理组鱼的全长均呈现递增趋势。开口7 d 时,Ⅰ组鱼全长增长最慢,显著低于其他各组(P<0.05),与其他各组间差异不显著(P>0.05);开口14 d 时,Ⅴ组鱼全长增长最快,与Ⅹ组差异不显著(P>0.05),但显著高于其他各组(P<0.05);开口21 d 时,Ⅰ组鱼全长增长最慢,与Ⅲ组、Ⅷ组和Ⅹ组差异不显著(P>0.05),显著低于其他各组(P<0.05);开口28 d 时,Ⅲ组和Ⅵ组鱼全长开始呈现负增长,二者差异显著(P<0.05),其他各组均呈现正增长,Ⅳ组增长最快,与Ⅱ组、Ⅴ组、Ⅶ组、Ⅷ组和Ⅹ组差异不显著(P>0.05),但显著高于Ⅰ组、Ⅺ组(P<0.05);开口35 d时,Ⅶ组鱼全长增长最快,与Ⅰ组、Ⅱ组、Ⅳ组、Ⅴ组差异不显著(P>0.05),显著高于其他各组(P<0.05);开口42 d 时,Ⅶ组鱼全长增长最快,与Ⅱ组、Ⅴ组差异不显著(P>0.05),显著高于其他各组(P<0.05),Ⅲ组鱼全长增长最慢,显著低于其他各组(P<0.05)。
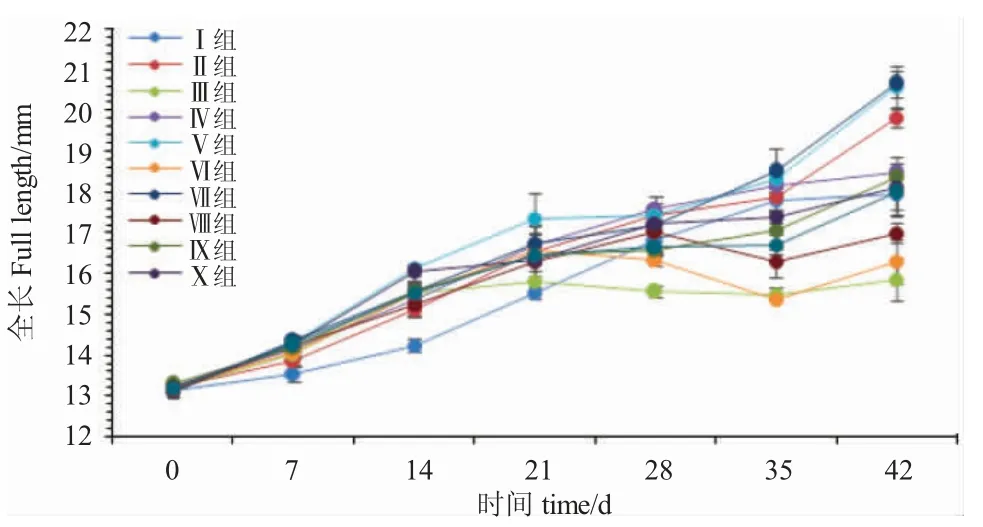
图2 摄食不同开口饵料的黑斑原仔鱼全长的增长Fig.2 The growth of the larval Glyptosternum maculatum fed different weaning diets
2.4 不同开口饵料对黑斑原仔鱼消化酶活性的影响
表3 不同开口饵料对黑斑原仔鱼消化酶变化Tab.3 Changes of digestive enzymes of different diets to the larva of the Glyptosternum maculatum

表3 不同开口饵料对黑斑原仔鱼消化酶变化Tab.3 Changes of digestive enzymes of different diets to the larva of the Glyptosternum maculatum
3 讨论
3.1 不同开口饵料对黑斑原仔鱼存活和生长的影响
早期生活期是鱼类在整个生命过程中对外界环境最敏感的时期,也是死亡率最高的重要阶段[13,14]。开口饵料对鱼类早期生活阶段的存活和后期生长具有直接的影响,与仔鱼开口摄食后,对饵料的种类、大小、密度及营养等密切相关。开口饵料的选择已成为鱼类苗种培育最主要的研究内容之一[15-18]。在自然水体中,黑斑原属于杂食性鱼类,口裂宽大、下位,具有发达的口腔齿,成鱼主要以小型鱼类和藻类为主。本研究结果表明,黑斑原仔鱼对开口饵料的选择性较低,除了猪肝饵料组之外,不管是单一饵料,还是组合饵料对其能够开口投喂,经过42 d 养殖死亡率均在15%以内,且投喂摇蚊幼虫单一饵料组死亡率最低,仅为3.78%;从生长来看,投喂组合饵料(微粒子饲料+螺旋藻+摇蚊幼虫)终末体质量和体全长增长均最快,死亡率为9.33%,可见,就单一饵料而言,天然饵料进行黑斑原仔鱼开口优于微粒子饲料和人工配合饲料,这与罗非鱼Oreochroms mossambcus[19]、纳氏鲟Acipenser naccarii[20]、四川裂腹鱼Schizothorax kozlovi[21]和半刺厚唇鱼Acrossocheilius hemispinus[22]进行开口饵料研究所得的结果相一致。然而,猪肝不适宜作为黑斑原仔鱼开口饵料,主要原因可能是平列槽中的水体有限,搅碎的猪肝容易影响水体水质和摄食,造成死亡率较高和生长缓慢;而投喂(微粒子饲料+螺旋藻+摇蚊幼虫)饵料生长最快的主要原因可能是组合饵料营养成分较为全面,对黑斑原仔鱼生长和存活均具有显著促进作用。
3.2 不同开口饵料对黑斑原仔鱼消化酶变化
通常,鱼类在早期发育过程中,消化系统具有一定的可塑性,消化酶活性的强弱对鱼类消化吸收具有重要的影响,与其早期存活和生长关系很大,通过调节自身消化酶活性实现机体内储存营养物质的有效利用,维持正常的新陈代谢[22-24]。本次实验中,采用不同饵料对黑斑原进行投喂,消化酶也产生了相应的变化。
目前有关鱼类蛋白酶活性的研究结果尚不一致。有的认为,肉食性鱼类蛋白酶活性高于草食性鱼类,但鲤(杂食性)蛋白酶活性又高于鳗鲡(肉食性),甚至还有报道称,鱼类蛋白酶活性差异跟食性的变化不明显[25,26]。而本实验结果表明,不同饵料对黑斑原仔鱼蛋白酶活性有显著影响,投喂肉食性饵料消化酶远高于人工配合饵料。鱼类的各个器官均分布有淀粉酶和脂肪酶,通常认为淀粉酶活性与鱼类的种类存在差异较大,脂肪酶的活性与鱼摄食食物脂肪含量呈正相关[27]。赵月月等[28]采用不同饵料研究了对稀有鲫Gobiocypris raru 仔稚鱼的消化酶活性,结果淀粉酶和脂肪酶变化均无显著性差异。然而本研究结果表明,投喂不同开口饵料对黑斑原仔鱼淀粉酶和脂肪酶变化存在显著差异,摇蚊幼虫试验组胰淀粉酶活性和脂肪酶活性最高,与上述结果不一致。
3.3 小结
结合死亡率、生长和消化酶变化总体分析,组合饵料(微粒子饲料+螺旋藻+摇蚊幼虫)对黑斑原仔鱼开口效果较好。建议在标准化鱼苗养殖中选择微粒子饲料+螺旋藻+摇蚊幼虫开口投喂。但对黑斑原整个幼鱼阶段和成鱼期的饵料选择和营养需求还未知,有待进一步研究。
