红尾仙女虾养殖群体ISSR 反应体系建立及遗传多样性分析
2021-07-24谭舜杨逸文蒋小美姜波徐建荣韩晓磊
谭舜,杨逸文,蒋小美,姜波,徐建荣,韩晓磊
(1.常熟理工学院,江苏 常熟 215500;2.南京仙夏生物科技有限公司,江苏 南京 210000)
仙女虾(fairy shrimp)是节肢动物门Arthropoda鳃足纲Branchiopoda 无甲目Anostraca 一类物种的统称,品种繁多,在世界各地均有分布,是平时不易见到的季节性水生浮游动物。目前,仙女虾的研究和利用较为成熟的是重要的海水鱼虾蟹幼体开口饵料海水卤虫[1]。红尾仙女虾Branchinella thailandensis 隶属于钗额虫科Thamnocephalidae 枝额虫属Branchinella,为淡水仙女虾,生活史较为简单。红尾仙女虾虾卵进行干燥处理后可长时间保存,适合长距离运输,其初孵的无节幼体体长0.3~0.5 mm,适合鱼虾蟹类初孵幼体开口摄食,故可作为新型淡水生物开口饵料[2]。因红尾仙女虾生命周期较短,仅2~3 个月,对生境要求较高,多生活在水质良好的暂时性水体;季节性较强,只在初夏秋末有小规模爆发,在自然界活体较少,处于较为稀有的状态。因此,红尾仙女虾仅在印度和泰国有少量研究,主要涉及其地理群体分布、暴发地自然生境条件和鸟、鱼携带休眠卵情况及黑斑病和杆菌病两种病害等研究[3-7]。从2008 年至今,在新疆、云南、河北和江苏等省先后报道了淡水仙女虾的自然存在,但其相关研究乃至人工养殖还处于空白状态[8,9]。现阶段,我国淡水养殖业急需一种类似于海水卤虫的淡水开口活饵料,红尾仙女虾可以适时加以开发利用,具有广阔的市场前景。
简单重复序列间扩增(inter simple sequence repeat,ISSR)分子标记技术操作简单、稳定快速,无需预先了解基因组序列特点,降低了实验难度和实验成本,已被广泛应用于水生动物遗传多样性分析、遗传作图、系统进化关系等领域[10-13]。本研究对红尾仙女虾养殖群体的ISSR 分子标记反应体系进行探索和优化,由此研究分析了其遗传多样性,为了解红尾仙女虾的遗传背景,乃至种质资源评定、保护及利用等工作提供基础资料。
1 材料与方法
1.1 材料
本实验用的24 个红尾仙女虾样本为苏州市长江特色水产培育繁殖养殖研究中心提供的人工养殖F4代成体,活体保存于-80℃冰箱待用。所用引物参照UBC 公司2006 年公布的ISSR 引物序列,由苏州金唯智生物科技有限公司合成,用于ISSR 反应的PCR buffer、Mg2+、dNTP、Taq DNA 聚合酶等均购于TaKaRa 公司。
1.2 方法
1.2.1 基因组DNA 提取
选取红尾仙女虾剥离肠道的全部组织,基因组DNA 的提取参照韩晓磊等[14]的方法并略加改进。用分光光度计(Thermo Scientific NanoDrop 2000)测定基因组DNA 的浓度,并通过凝胶成相系统(UVP Biospectrum 410)检测DNA 的完整性,检测合格的DNA 样本置-20℃保存备用。
1.2.2 退火温度的优化及引物筛选
以检测后得到的24 个红尾仙女虾DNA 的混合样为DNA 模板,按通用PCR 条件对90 个ISSR引物进行初筛,选择扩增条带较多、信号强和背景清晰的引物。退火温度范围设置为48~59℃,PCR 仪自动生成12 个梯度,分别为48℃、49℃、50℃、51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃。
1.2.3 ISSR-PCR 正交试验
针对25 μL 的PCR 体系,选择Mg2+、引物、Taq DNA 聚合酶因素3 水平3 进行L9(34)正交实验(表1)。正交试验中,PCR 反应体系总体积为25 μL,除表1 中变化因素外,每管中2.5 μL 的10×PCR Buffer、2 μL 的dNTP 和1 μL 的模板DNA 固定不变,ddH2O 根据其他试剂的用量定容至25 μL,所用引物为上文中提取筛选出的引物。

表1 红尾仙女虾ISSR-PCR 正交试验Tab.1 The orthogonal experiment of ISSR-PCR in fairy shrimp Branchinella thailandensis
1.3 数据统计与分析
对红尾仙女虾养殖群体ISSR 的电泳图谱进行人工读带,相同引物得到的电泳迁移率一致的条带被认为具有同源性,是相同位点的产物,无条带或模糊条带的记为0,有条带的记为1,得到0,1 数据矩阵。利用POPGEN32 计算多态位点比率、遗传相似度和遗传多样性,并进行分析。
2 结果与分析
2.1 引物筛选和正交试验
通过引物初筛实验,对90 个ISSR 引物进行筛选;通过PCR 扩增后的电泳检测,确定扩增条带较多、信号强和背景清晰的引物并记录,以便于后续实验。
PCR 过程中需要多种试剂联合反应,各因素都会影响其结果,Mg2+、引物和Taq 酶等条件不同,其结果差异很大。由图1 可知,在9 个不同条件处理中,3 种因素的不同组合浓度不同,扩增结果也明显不同。泳道4、6、7 的多态性较低,泳道5、6、7 条带强度较高,其原因受多种因素所致。泳道2、3 条带清晰,多态性高,背景对比度好。经过比较,以特异谱带多态性高、背景对比度好、主带清楚、副带明显为标准,考虑到实验的成本以及效果等因素,确定该引物ISSR-PCR 的最佳反应体系为:25 L 反应体系中包含Taq 酶0.5 U,引物1.25 μL,Mg2+3.0 μL,模板DNA 1 μL,dNTP 2 μL,10×PCR Buffer 2.5 μL,其他引物以同样方法确定最佳反应体系(表2)。
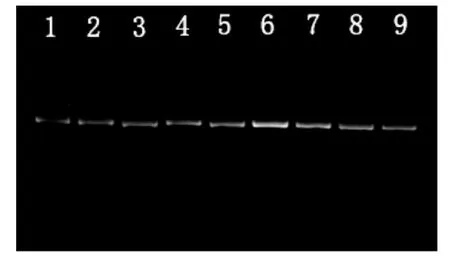
图1 引物866 的ISSR-PCR 扩增正交试验结果Fig.1 Results of ISSR-PCR orthogonal test for primer 866
表2 ISSR-PCR 正交试验设计结果Tab.2 The orthogonal design ISSR-PCR
2.2 退火温度梯度PCR
根据已筛选的8 个引物及其建立的红尾仙女虾ISSR 反应体系,优化这8 个引物的退火温度。结、,果发现引物不同,其最佳退火温度不同。由温度梯度PCR 结果(图2)可知,当温度较低时(48~52℃),谱带背景较低,且上半部分扩增条带不清楚。温度梯度逐渐提高时(53~59℃),上半部分背景提高,条带逐渐增多,更加清晰。
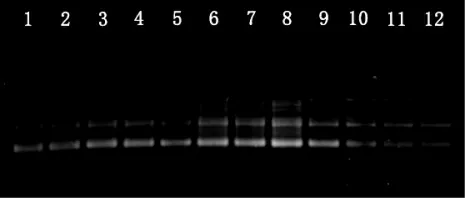
图2 不同退火温度对引物874 的ISSR-PCR 扩增结果的影响Fig.2 Effect of different annealing temperature on ISSRPCR results of primer 874
2.3 ISSR-PCR 反应最佳条件确定
根据引物筛选、正交试验和退火温度梯度试验结果,最终确定红尾仙女虾的8 个ISSR 引物的最佳反应体系(表3)。

表3 不同引物的ISSR-PCR 反应最佳条件Tab.3 The optimal conditions of different primers for ISSR-PCR
2.4 ISSR 扩增
本实验选定效果最好的6 个ISSR 引物,对红尾仙女虾人工养殖群体的24 个DNA 样品进行PCR 扩增,6 个ISSR 引物扩增出来的条带数在5~8之间,共扩增出37 个可统计的位点。图3 为引物809 在红尾仙女虾养殖群体24 个个体间的ISSR 扩增谱图。

图3 引物809 在红尾仙女虾养殖群体中的ISSR 扩增结果Fig.3 The ISSR amplification of primer 809 in cultured populations of fair shrimp B.thailandensis
2.5 养殖群体遗传多样性
在红尾仙女虾养殖群体扩增出的37 个扩增位点中,多态位点为32 个,多态位点比率为86.49%;由POPGEN32 计算得出,Nei's 指数为0.2570,Shannon's 指数为0.3962(表4)。

表4 6 个ISSR 引物在24 个红尾仙女虾个体间的扩增情况Tab.4 The amplification of 6 ISSR primers in 24 individuals of fair shrimp B.thailandensis
3 讨论
3.1 ISSR 反应体系建立
简单重复序列(SSR)广泛分布于真核生物基因组DNA 中,蕴含着大量的遗传信息,ISSR(Inter-simple sequence repeat)引物可选择性地对简单重复序列区进行扩增,检测遗传信息[10,11]。本研究显示,ISSR 反应体系不仅展现了红尾仙女虾基因组DNA 微卫星的分布特征,也提供了其部分遗传背景信息。ISSR 技术多态性高、成本低、重复性好,特别是无需预先了解研究对象基因组序列特点即可做出分析,这对鲜有分子生物学研究的红尾仙女虾,乃至仙女虾类生物都是一个很好的选择。然而,ISSR 是基于PCR 的分子标记技术,易受反应体系和条件的影响;不同物种的最适PCR 条件参数也有一定程度的差异,其扩增结果势必受到反应体系的DNA 模板、Taq 酶、引物、Mg2+以及退火温度等因素的影响[15,16],因此,有必要建立并优化ISSR-PCR 的反应体系,以保证其分析结果的特异性、稳定性和可靠性。本研究在保证红尾仙女虾DNA 模板质量的前提下,选取Taq 酶、引物和Mg2+3 个主要因素进行正交实验,并通过优化退火温度,建立了红尾仙女虾ISSR 反应体系,为进一步开展红尾仙女虾分子遗传学研究奠定了基础。
3.2 遗传多样性水平
遗传多样性是生物多样性研究的重要内容,是物种适应多变的环境条件、维持长期生存和进化的遗传基础[17]。平均多态位点比率是衡量生物群体遗传多样性的参数[18]。本研究中红尾仙女虾养殖群体平均多态位点比率为86.49%,与具有较高遗传多样性水平的两性卤虫Artemia sinica、平滑真刺水蚤Euchaeta plana、精致真刺水蚤Euchaeta concinna 和萼花臂尾轮虫Brachionus calyciflorus 的野生群体ISSR 数据[19-23]比较发现,红尾仙女虾养殖群体与两性卤虫野生群体处于同一水平,且高于平滑真刺水蚤、精致真刺水蚤和萼花臂尾轮虫的野生群体,揭示红尾仙女虾养殖群体遗传多样性处于较高水平;Nei's 指数和Shannon’s 指数分析比较同样得出以上结论。
人工养殖群体受奠基者效应、人工选择以及遗传漂变等作用,主要是亲本近交效应、人为选择压力和稀有等位基因缺失等因素的影响,致使养殖群体遗传多样性比野生群体有不同程度的降低[24,25]。本研究中,虽然红尾仙女虾是人工养殖F4代群体,但依然保持着较高的遗传多样性水平,究其原因:红尾仙女虾是浮游动物且初始个体较小(0.3~0.5 mm),在养殖过程中其亲本基础群体的数量均在万级以上,这在很大程度上降低了瓶颈效应和近交衰退的发生概率;红尾仙女虾属于低等浮游生物,具有较强的生境适应和种群恢复能力,加之所提供的养殖环境为人工营造的较适宜的生境条件,故养殖环境所产生的人为选择压力较小;在人工养殖环境下,稀有等位基因势必出现一定程度的缺失,但所占比例有限,这也是养殖群体种质相对纯化的必然趋势,但其具体的缺失程度和影响还有待更深入的研究。综上,红尾仙女虾养殖群体的遗传多样性处于较高水平,人工养殖环境对其遗传多样性的影响较小,能保证其优良的经济性状和丰富的遗传变异。
