肠内肠外营养支持序贯对重症患者营养状况、炎症因子及并发症的影响
2021-07-24崔小丽宋春蒙
崔小丽,宋春蒙
(周口市中医院重症医学科,河南 周口 466000)
重症医学科收治的患者病情均较重,在严重创伤、休克、感染等应激状态下,患者处于长期高负荷、高代谢状态,机体新陈代谢系统出现异常,不能自主获取营养,有较高的营养风险[1],可产生营养底物的合成、组织器官的结构功能、细胞的能量代谢等异常,导致患者营养不良或营养失衡[2],影响患者病情进展和治疗难度。营养不良状况如未及时改善,则会严重损害患者脏器功能,使患者病情加重,甚至增加临床病死率。营养治疗可为机体提供较全面的营养物质,并恢复氮平衡,维持患者组织器官功能的正常运行状态,还有调理机体新陈代谢、改善机体免疫功能的作用,有助于患者疾病的转归和预后[3]。肠外营养可在一定程度上改善患者营养状况,但易损伤机体肝功能[4],诱发血糖和血脂异常的发生。肠内营养可直接经肠吸收,符合人体生理过程。本文旨在探索重症患者采用肠内肠外营养序贯的方法对其营养状况、炎症因子及并发症的影响。
1 资料与方法
1.1 一般资料选取2017年1月至2019年1月间98例经营养风险筛查有营养风险重症患者作为研究对象,按照干预方法不同分为对照组和观察组,各49例。两组重症患者干预前基线资料比较,差异无统计学意义(P>0.05),见表1。
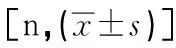
表1 两组一般资料比较
1.2 纳入与排除标准纳入标准:(1)营养风险筛查(nutrition risk screening,NRS2002)评分[5]≥3分;(2)患者无明显的肠道消化吸收功能异常;(3)患者家属知情并签署知情同意书。排除标准:(1)患者合并胃肠道手术史;(2)患者合并严重消化系统疾病;(3)患者合并严重器质性病变;(4)患者合并糖尿病病史及其他营养代谢的内分泌疾病史;(5)患者合并恶性肿瘤。
1.3 治疗方法两组患者在治疗原发病基础上,给予营养支持。患者摄入能量按104.5 KJ/(kg·d)进行营养支持,持续1周。
对照组:给予肠外营养支持,通过中心静脉置管泵注营养液,总量为700~1800 mL,速度50~80 mL/h,营养液包括中/长链脂肪乳注射液(C8~24)[四川国瑞药业有限责任公司,100 mL:10 g(大豆油):10 g(中链甘油三酸酯):1.2 g(卵磷脂):2.5 g(甘油),H20123286],复方氨基酸注射液(18AA-Ⅱ)[必康制药新沂集团控股有限公司,500 mL:25 g(总氨基酸),H20066335],注射用脂溶性维生素(Ⅱ)[西安远大德天药业股份有限公司,每支含维生素A棕榈酸酯:1940 μg(3300 IU);维生素D2:5 μg(200 IU);维生素E:9100 μg(10 IU);维生素K1:150 μg,H20060489],注射用水溶性维生素(晋城海斯制药有限公司,每瓶中组分为:硝酸硫胺:3.1 mg;核黄素磷酸钠:4.9 mg;烟酰胺:40 mg;盐酸吡哆辛:4.9 mg;泛酸钠:16.5 mg;维生素C钠:113 mg;生物素:60 μg;叶酸:0.4 mg;维生素B12:5.0 μg;甘氨酸:300 mg;乙二胺四乙酸二钠:0.5 mg;对羟基苯甲酸甲酯:0.5 mg,H20055089)。
观察组:给予序贯肠内肠外营养支持,首先给予肠内营养支持,通过鼻饲管给予肠内营养支持,肠内营养液为肠内营养混悬液(TPF)[纽迪希亚制药(无锡)有限公司,1.5 kcal/mL,H20030011],总量300~500 mL/d,速度15~20 mL/h,肠内营养能量不足部分通过肠外营养给予补充,肠外营养支持方法同对照组,泵注速度20~30 mL/h,直至满足患者所需摄入总量。
1.4 观察指标
1.4.1 营养状况 于营养支持前、营养支持后1周抽取患者空腹静脉血5 mL,低温离心取血清。采用全自动生化分析仪AU5800(美国贝克曼库尔特有限公司)检测ALB、PA及TRF水平,比较营养状况。
1.4.2 炎症因子 于营养支持前、营养支持后1周抽取患者空腹静脉血5 mL,应用酶联免疫吸附法,采用美国BIO-RAD伯乐680全自动酶标仪(北京东迅天地医疗仪器有限公司),检测TNF-α、hs-CRP、PCT、IL-10水平。
1.4.3 并发症 统计记录营养支持期间并发症发生情况,包括腹泻、感染、电解质紊乱和高血糖等。
1.5 统计学方法采用统计学软件SPSS 21.0对数据进行处理,计量资料以“均数±标准差”表示,行t检验。计数资料用百分数(%)表示,行卡方检验。P<0.05提示差异有统计学意义。
2 结果
2.1 两组患者营养支持前后营养状况指标比较营养支持前,两组重症患者TRF、PA、ALB水平比较,差异无统计学意义(P>0.05);营养支持后,以上三项指标水平均提高(P<0.05),且观察组水平提高更明显(P<0.05),见表2。
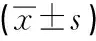
表2 两组患者营养支持前后营养状况指标比较
2.2 两组患者营养支持前后炎症因子水平比较营养支持前,两组重症患者TNF-α、hs-CRP、PCT、IL-10水平比较,差异无统计学意义(P>0.05);营养支持后,两组患者以上指标水平均降低(P<0.05),且观察组水平降低更明显(P<0.05),见表3。
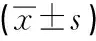
表3 两组患者营养支持前后炎症因子水平比较
2.3 两组患者营养支持前后并发症比较观察组患者营养支持期间并发症发生率低于对照组(P<0.05),见表4。
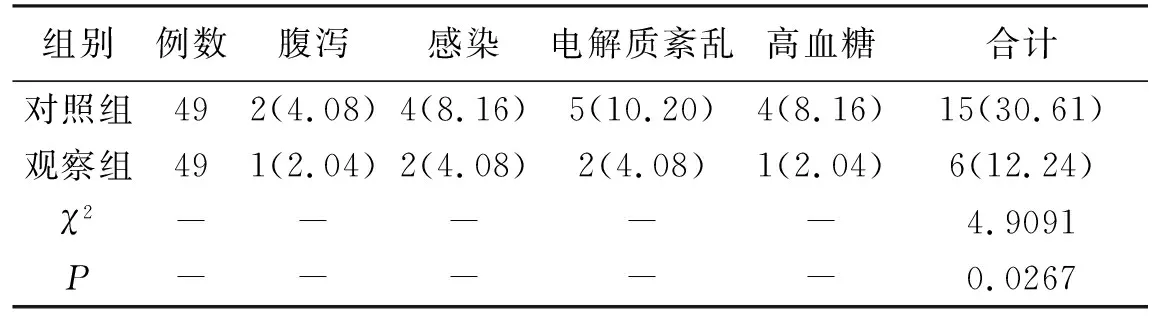
表4 两组患者营养支持前后并发症比较 [n(%)]
3 讨论
重症患者常合并营养不良、免疫力低下、代谢功能紊乱、消化功能损伤、吞咽困难等症状,且常因疾病或治疗,造成患者无法进行正常进食,进而患者的营养状况受到影响,可发生高代谢症状,影响临床疗效[6]。营养不良还容易导致消化道溃疡和感染等并发症,对患者造成较大影响,并增大治疗难度。营养支持能够预防营养不良的发生,并可纠正机体营养不良状态。肠外营养支持能补充机体所需能量和基本营养物质,维持机体正氮平衡,但相关并发症的发生率高[7]。肠内营养支持不仅能提供营养支持,还能改善患者粘膜屏障和免疫功能,有利于维护肠道内环境的稳定。本文结果显示,重症患者采用肠内肠外营养序贯的方法可改善其营养状况,减轻炎性反应,降低并发症。
重症患者常合并营养不良等症状,且患者常无法正常进食,从而影响患者的营养状况[8]。临床常采用TRF、PA、ALB指标,用于评价患者营养状况。本文结果显示,营养支持后,两组患者TRF、PA、ALB水平均提高,且观察组TRF、PA、ALB水平提高更明显,说明重症患者采用肠内肠外营养序贯的方法可改善其营养状况。肠内肠外营养支持序贯时,肠外营养支持能提供机体所需的能量与营养物质需要,肠内营养更符合机体生理需求,能恢复患者胃肠道功能,肠内肠外序贯营养支持整合肠内肠外营养支持的优点,保护患者胃肠道功能和结构,提高患者胃肠道免疫功能,并提供充足的能量,且经过正常生理途径代谢、循环的营养物质,改善机体蛋白质的合成和代谢功能,患者的营养状况得到最大程度的改善。与郑伟等[9]的研究结果一致,其研究结果表明序贯肠内外营养支持可改善重症患者患者营养状况。
炎症因子是各种应激反应刺激机体产生的一种细胞活性因子,可反映机体疾病的严重程度,并可诱发患者炎性反应,影响治疗效果。本文结果显示,营养支持后,两组患者TNF-α、hs-CRP、PCT、IL-10水平均降低,且观察组TNF-α、hs-CRP、PCT、IL-10水平减低更明显,说明重症患者采用肠内肠外营养序贯的方法可减轻其炎性反应。肠内肠外营养支持序贯时,肠外营养支持减少机体能量流失,改善患者营养状况,减轻应激反应。肠内营养支持能保持机体肠道黏膜的完整性,恢复胃肠道黏膜的分泌功能,符合人体生理功能,改善机体肠道消化功能,维持肠道的屏障功能,同时预防肠道菌群失调,增强机体胃肠粘膜的抵抗力。与赵辉等[10]的研究结果一致,其研究结果表明序贯肠内外营养支持可降低患者炎症因子。
单独肠外营养支持可减少食物对胃肠道的刺激,减弱胃肠道的吸收功能,静脉输注液会加重患者呼吸系统和循环系统的负担,并对机体血管造成刺激,增加应激反应[11],机体正常代谢功能受到影响,引发感染、电解质紊乱、高血糖等并发症。单独肠内营养液类型、感染、基础疾病等因素会导致患者腹泻等并发症的发生[12]。本文结果显示,观察组患者营养支持期间并发症发生率小于对照组,说明重症患者采用肠内肠外营养序贯的方法可降低患者并发症的发生。肠内肠外营养支持序贯时,肠内营养支持可直接将营养物质供给肠黏膜细胞,肝脏同时收到供给,促进机体门静脉系统血液循环,使胃肠道激素分泌增多,改善患者内脏血液灌注量,保护机体肠道黏膜屏障,促进机体肠蠕动,从而降低患者胃肠道并发症。胃肠外营养支持,有利于蛋白质的合成和维持肠道黏膜屏障功能正常状态,患者肠道免疫功能得到改善,减少了菌群移位等感染发生的几率。与崔赢等[13]的研究结果一致,其研究结果表明序贯肠内及肠外营养支持可减少患者并发症的发生。
综上所述,重症患者采用肠内肠外营养序贯的方法有利于患者恢复胃肠功能,改善其营养状况,减轻炎性反应,降低并发症。
