cGMP对大鼠酒精偏好的影响
2021-07-23张洪艳王琦玉关艳中
高 青,杨 涛,张洪艳,王琦玉,关艳中
(牡丹江医学院,黑龙江 牡丹江 157011)
酒精成瘾是一种复杂的慢性脑病,高复发率是酒精成瘾在临床治疗中面临的重大挑战之一,既往研究指出酒精成瘾治疗后3个月的复发率达到60%~70%,1年后复发率达到80%~90%,因此预防复发十分必要[1]。研究表明,酒精可通过对γ-氨基丁酸(γ-aminobutyric acid,GABA)神经元的抑制作用来激活VTA中的多巴胺能环路[2]。cGMP在谷氨酸能、胆碱能和多巴胺能信号通路中起重要作用,cGMP参与酒精引起的抑制性突触长时程增强(Long-Term Potentiation of GABAergic synapse,LTPGABA)[3]。然而,cGMP对VTA区大鼠饮酒偏好的研究比较少见。本实验我们通过建立SD大鼠主动饮酒模型,外源性注射cGMP类似物以及鸟苷酸环化酶的抑制剂观察对大鼠饮酒偏好的影响。
1 材料和方法
1.1 实验动物健康雄性SD大鼠48只,体重170~210 g。哈尔滨医科大学动物实验中心提供,实验动物生产许可证号:SYKX(黑)2015-007。实验动物饲养于SPF级实验室,室内安静整洁,温度控制在(22±2)℃,单笼饲养(12 h黑夜/12 h白昼,早8:00开灯),食物和水供应充足。动物适应一周后开始实验,所有动物饲养与使用均符合牡丹江医学院动物福利和伦理委员会批准。
1.2 主要试剂食用酒精(浓度≥95%),8-Br-cGMP(美国Sigma公司),ODQ(美国Sigma公司),cGMP ELISA试剂盒(美国abcam公司)。
1.3 实验仪器脑立体定位仪(上海玉妍公司),微量进样针(上海玉妍公司),微型颅骨钻(深圳瑞沃德有限公司),双管套管针、帽芯、注射内管(深圳瑞沃德有限公司)。
1.4 实验方法
1.4.1 制作动物模型 选取雄性SD大鼠18只,随机分为对照组(n=6)和饮酒组(n=12)。每个鼠笼放置两个做好标记的瓶子,一瓶为20%的酒精水溶液,另一瓶为饮用水,24 h后将20%酒精瓶换成水瓶(此时两瓶均为饮用水),再过24 h,20%酒精瓶替换其中一瓶饮用水,并且交换两个瓶子的位置,以排除位置偏好的影响。每天早8:30~9:30配置新酒精溶液并更换隔离服进动物房,饮水瓶每天更换新鲜饮用水。每天分别记录酒精和水的消耗量,如此重复28 d,大鼠饮酒量及饮酒偏好达到稳定水平,并且每天酒精摄入量低于3.15 g/(kg·24 h)的大鼠被淘汰[4],即成功制作酒精成瘾大鼠模型。所有大鼠于每周固定时间称重一次用于观察体重变化以及排除个体差异。20%酒精的饮酒偏好[5](%)=酒精消耗量/(酒精消耗量+水消耗量)×100。
1.4.2 VTA区cGMP含量的测定 在1.4.1制作动物饮酒模型基础上,建模成功后再把饮酒组分为末次饮酒与戒断72 h组。ELISA法检测cGMP含量。步骤如下:将大鼠麻醉后断头取脑,切取VTA脑组织于液氮下快速冷冻,冷冻后将组织取出用研磨棒充分研磨,液氮蒸发后,快速称重。然后以10体积0.1 M盐酸裂解组织,10000 rpm离心约10 min。离心后取上清液按照试剂盒操作步骤加样检测。
1.4.3 药物对间歇性饮酒模型饮酒偏好的检测 选取SD大鼠30只,按照1.4.1制作动物饮酒模型,并在建模第21天时VTA区埋置套管,然后继续间歇性饮酒至28 d。建模成功后酒精戒断72 h,随机分成假手术组(n=6)、8-Br-cGMP组(VTA区微量注射8-Br-cGMP,n=6)、8-Br-cGMP的溶剂对照组即ACSF组(VTA区微量注射ACSF,n=6)、ODQ组(VTA区微量注射ODQ,n=6)、ODQ的溶剂对照组即DMSO组(VTA区微量注射DMSO:ACSF=1的混合液,n=6)。将大鼠用七氟烷麻醉后固定于脑立体定位仪上,经套管在每侧VTA区注射给药0.5 L,注射时间为1 min,注射后留针1 min以便药物扩散。其中8-Br-cGMP溶于ACSF中,给药浓度是10 g/0.5 L;ODQ溶于DMSO中,给药之前用ACSF按1∶1稀释,最终给药浓度是0.187 g/0.5 L[6]。观察给药后6 h内饮酒偏好情况[7]。
1.5 统计学处理实验结果统计处理均采用SPSS 18.0统计软件分析,作图采用GraphPad Prism 7.0,实验数据用“均数±标准差”表示,两组均数间比较采用t检验,多组间比较采用One way ANOVA方差分析,P<0.05认为差异具有统计学差异。
2 结果
2.1 建模期间体重变化实验前对照组与饮酒组大鼠体重无统计学差异(P>0.05),实验结束时对照组与饮酒组大鼠体重亦无统计学差异(P>0.05),见图1。
图1 对照组与饮酒组体重变化
2.2 建模期间饮酒量及酒精偏好变化随着饮酒次数的增加大鼠酒精摄入量逐渐升高,经过14次饮酒循环后酒精消耗量及饮酒偏好达到稳定基线,酒精摄入量为(4.23±0.55)g/(kg·24 h),饮酒偏好为(58.25±5.14)%,见图2、图3。
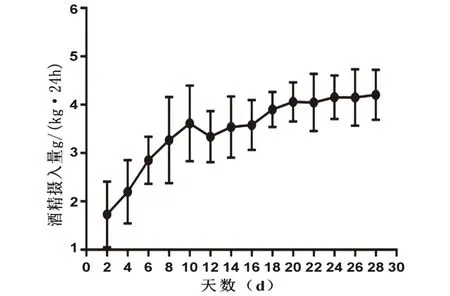
图2 饮酒组酒精摄入量变化
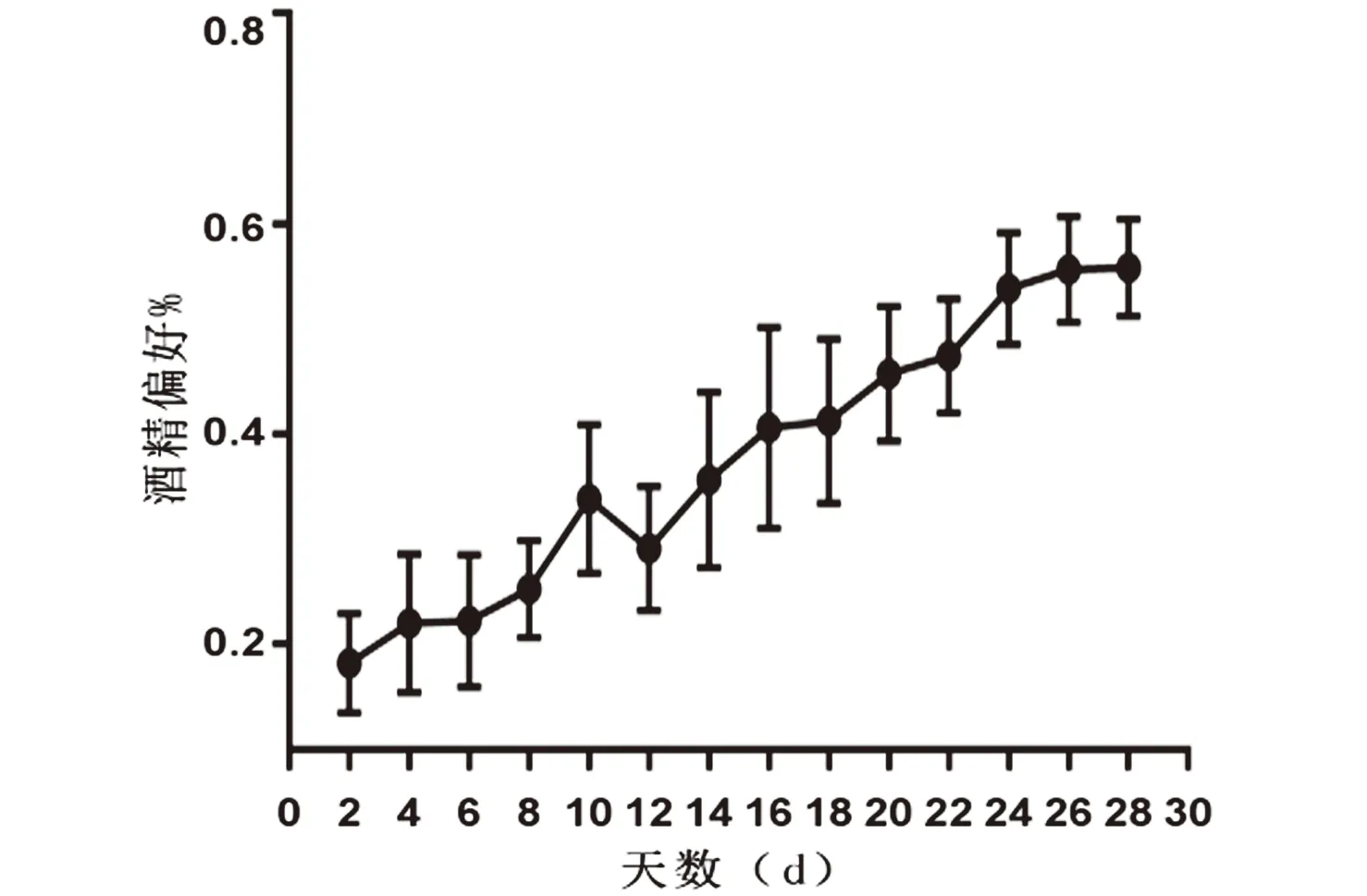
图3 饮酒组饮酒偏好变化
2.3 VTA区cGMP含量的变化经ELISA检测,与对照组比较,末次饮酒组和戒断72 h组cGMP含量明显增加,差异有统计学意义,见图4。
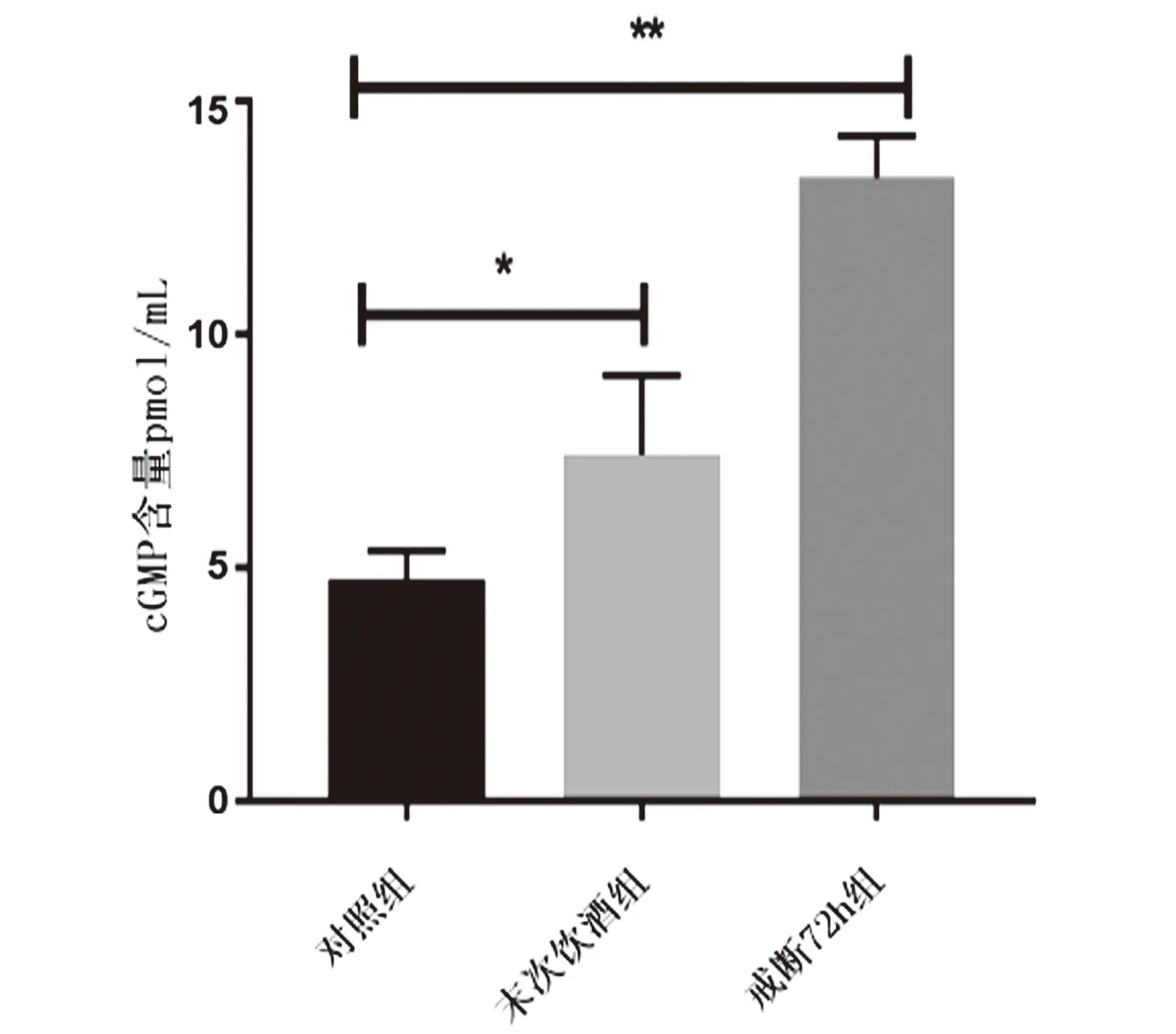
图4 VTA区cGMP含量
2.4 药物对间歇性饮酒模型饮酒偏好的影响
2.4.1 8-Br-cGMP对间歇性饮酒大鼠饮酒偏好的影响 给药后6 h内饮酒偏好结果:与假手术组和ACSF组比较,8-Br-cGMP组明显增加,差异有统计学意义(F=7.89,P=0.005),见图5。
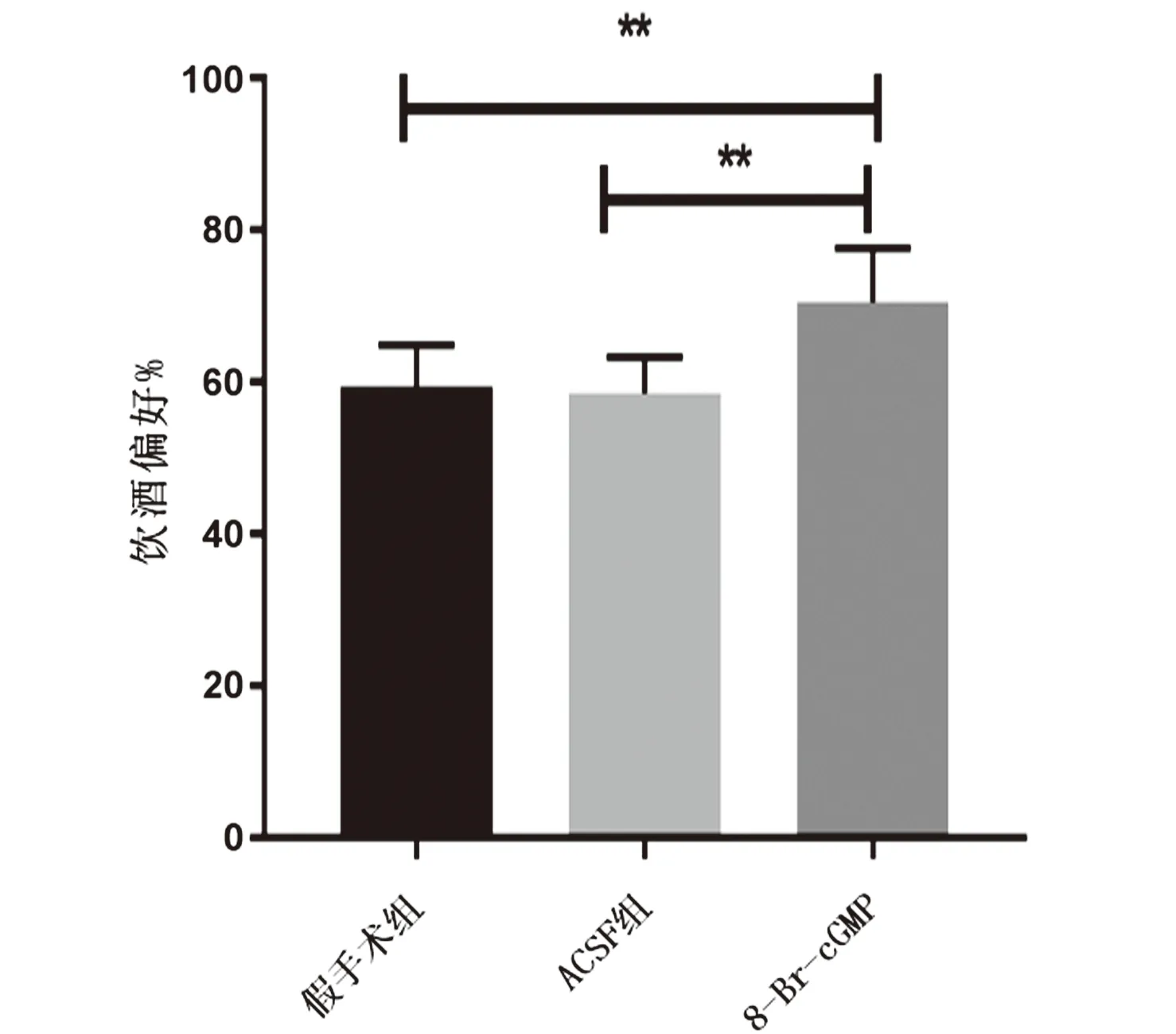
图5 戒断72 h后给药6 h内饮酒偏好结果
2.4.2 ODQ对间歇性饮酒大鼠饮酒偏好的影响 给药后6 h内饮酒偏好结果:与假手术组和DMSO组比较,ODQ组明显降低,差异具有统计学意义(F=23.47,P<0.001)。见图 6。
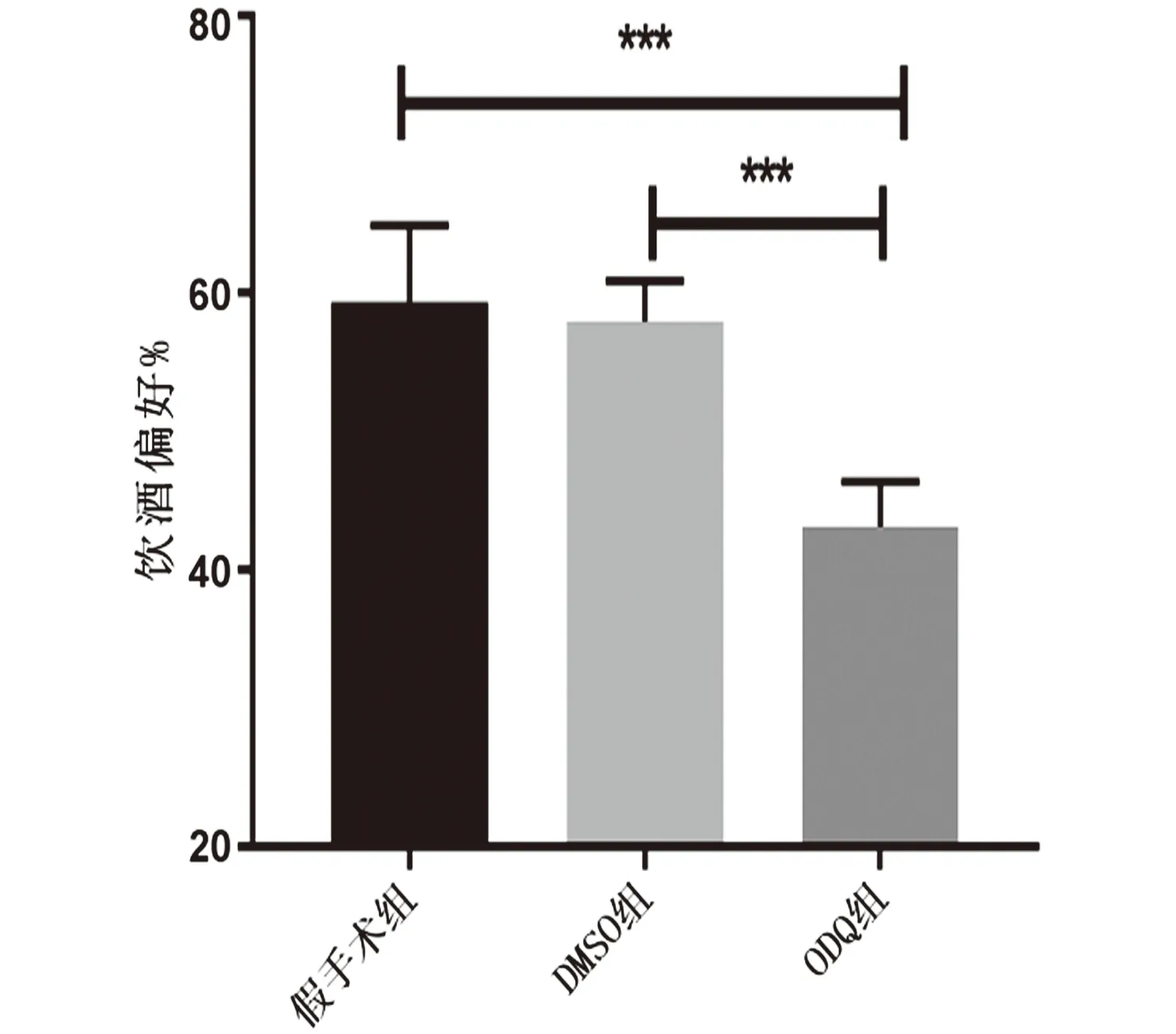
图6 戒断72 h后给药6 h内饮酒偏好结果
3 讨论
酒精成瘾是一种失控且紊乱的饮酒行为,被定义为一种病理状态行为综合征[8]。酒精成瘾除了机体对酒精产生耐受,停止饮酒后出现戒断症状(如出现不同程度的认知障碍,特别是在智力、记忆、和运动技能等方面)外,还突出表现为强迫性觅酒行为,对酒的强烈渴求和反复滥用[9]。酒精成瘾患者的病程较长、复发率较高、治疗难度大、危害程度重,其影响因素一直是科学研究的焦点问题。
VTA是一个已知的编码奖赏和厌恶的大脑区域,酒精在VTA中的作用可诱导神经适应,导致酒精的奖励效应相对增强[10-11]。所以我们本次实验主要研究VTA脑区。cGMP作为细胞内重要第二信使,由鸟苷酸环化酶作用产生。以往研究已证明cGMP与中枢神经系统(Central Nervous System,CNS)的认知、焦虑、成瘾、精神分裂症和抑郁症等多个方面有关[12]。cGMP能抑制与成瘾相关脑区多巴胺的释放,急性酒精刺激可增加大鼠某些神经元中cGMP水平[13]。也有研究表明,酒精成瘾患者戒断后脑脊液中cGMP含量在急性震颤谵语状态下显著升高。可见cGMP与酒精成瘾之间关系密切。
本实验采用雄性SD大鼠间歇性主动饮酒28 d,饮酒量及酒精偏好达到了稳定状态,成功建立了酒精成瘾大鼠模型,模型建立成功后给予酒精戒断72 h,ELISA法检测到此时VTA区cGMP含量明显增加。已知8-Br-cGMP是一种cGMP的可溶类似物;ODQ被认为是大脑中有用的鸟苷酸环化酶抑制剂,并被用于探索cGMP在参与阿片类药物戒断相关的神经化学和行为反应中的作用[14]。当鸟苷酸环化酶被ODQ抑制时,突触刺激和外源性一氧化氮供体均不能诱导LTPGABA[15]。当向大鼠VTA区外源性注射8-Br-cGMP和ODQ后再饮酒时,结果证明8-Br-cGMP可以增加酒精戒断大鼠的饮酒偏好,ODQ可减轻饮酒偏好。由此可见cGMP在VTA区确实对酒精成瘾大鼠的酒精偏好行为具有调节作用。有研究表明在慢性高浓度(7.2%,v/v)饮酒模型中大鼠大脑皮层、纹状体和海马中cGMP水平均明显升高,即使在戒断24 h后,海马cGMP水平仍显著升高[16];Shen[6]曾指出在SD大鼠海马内注射8-Br-cGMP对吗啡诱导的条件性位置偏爱巩固过程有增强作用;KURAUCHI[17]曾指出ODQ可消除酒精引起的cGMP升高和心肌氧消耗的降低;在慢性吗啡依赖的大鼠中,ODQ可以抑制蓝斑核中纳洛酮诱导的戒断症状,这与我们的结果是一致的。
综上所述,本研究发现cGMP在间歇性主动饮酒大鼠酒精戒断后再饮酒时的饮酒偏好中具有重要调节作用,外源性注射cGMP类似物或鸟苷酸环化酶的抑制剂可明显增强或降低酒精戒断大鼠的饮酒偏好,这为预防酒精复发的临床治疗提供了新方向。
