一氧化氮对间歇性主动饮酒大鼠戒断后再饮酒时酒精偏好的影响
2021-07-23张洪艳王琦玉徐璐璐熊君伟关艳中
杨 涛,高 青,张洪艳,王琦玉,王 雪,徐璐璐,熊君伟,关艳中
(牡丹江医学院,黑龙江 牡丹江 157011)
酒精使用障碍(Alcohol use disorders,AUD)是全球最普遍的精神障碍之一,研究酒精导致机体适应性改变的相关分子机制和特定神经回路,对于临床治疗和预防具有重要作用[1]。AUD涉及许多脑区,其中VTA是已知与酒精奖赏效应密切相关的脑区[2]。一氧化氮(NO)是中枢神经系统和外周神经系统最重要的信号分子之一[3]。有研究表明,NO参与饮酒行为,腹腔注射NO合酶抑制剂L-NAME抑制NO的形成可降低酒精依赖大鼠酒精摄入量和偏好[4]。但与酒精奖赏行为密切相关的VTA区NO是否调控饮酒行为还未见报道。本研究通过向VTA注射NO信号阻断剂,观察间歇性主动饮酒大鼠再次饮酒时的酒精偏好,明确VTA中NO对酒精偏好的影响,从而为临床治疗及预防提供理论依据。
1 材料及方法
1.1 实验动物成年雄性Sprague-Dawley(SD)大鼠,体重为180~220 g。购自哈尔滨医科大学动物实验中心,实验动物生产许可证号:SYKX(黑)2015-007。SD大鼠单笼饲养于SPF级动物房,温度(22±2)℃,环境湿度56%左右,保持昼夜节律12 h/12 h(即早8:00到晚20:00)。笼中食物和水充足,通风系统良好。所有动物饲养与使用均已通过《美国国立卫生研究院实验动物护理和使用指南》以及符合牡丹江医学院实验动物管理条例。
1.2 实验试剂及制备无水乙醇(浓度≥95%),C-PTIO(美国Sigma公司),L-NAME(美国Sigma公司),C-PTIO、L-NAME使用0.9%生理盐水溶解。
1.3 20%酒精间歇性主动饮酒模型的建立大鼠在SPF级动物房单笼饲养适应一周后,在第1 d,大鼠给予两个瓶子,一瓶装有20%(容积比v/v)酒精,另外一个瓶子装有等量饮用水,记录两个瓶子的位置。24 h后,记录大鼠饮水量(mL)和饮酒量(mL),然后将20%的饮酒瓶用装有等量饮用水的水瓶置换出来,此时笼内均为饮水瓶;第3天,再用20%酒精瓶替换其中一瓶饮用水,并且交换20%酒瓶和水瓶的位置(与第1天位置相反),以防止大鼠对饮用溶液的位置偏好。如此重复28 d。
1.4 酒精偏好的测定建模成功后,大鼠酒精戒断72 h后,再次给予20%酒精,记录再次饮酒时6 h内的饮酒量与饮水量。酒精偏好的计算为消耗的酒精量占总液体消耗量的百分比,即酒精偏好(%)=酒精消耗总量(mL)/(酒精消耗总量+水的消耗总量)(mL)×100%[5]。
1.5 实验动物分组及处理雄性SD大鼠30只,随机分为对照组(n=6)和饮酒组(n=24)。对照组大鼠给予两个等量饮用水瓶,每天记录饮水量。饮酒组大鼠按照1.3的方法建立酒精依赖模型。在第21天对照组与饮酒组大鼠进行脑立体定位埋置套管后,继续饮用水或20%酒精至28 d。饮酒组和对照组大鼠定期进行称重并记录体重。饮酒组建模成功后酒精戒断72 h,随机分为假手术组(正常做手术但VTA内不注射药物)、L-NAME组(每侧VTA按照0.5 μg/0.5 μL注入NO合酶抑制剂L-NAME)、C-PTIO组(每侧VTA按照1 μg/0.5 μL剂量注入NO清除剂C-PTIO)、生理盐水组(每侧VTA微量注射0.5 μL生理盐水)。微量注射时间为60 s,药物注射后留针60 s以便药物扩散。然后测定6 h内的饮酒偏好。
1.6 统计学处理实验结果使用SPSS 23.0统计软件,所有数据“均数±标准差”表示。数据作图采用 GraphPad Prism 7.0,不同组间使用One way ANOVA进行分析比较。多个样本均数间两两比较采用SNK法检验,P<0.05 被认为差异具有统计学意义。
2 结果
2.1 间歇性主动饮酒模型的建立
2.1.1 SD间歇性主动饮酒模型建立期间饮酒组体重变化 建模期间,对照组和饮酒组体重比较,发现实验前饮酒组与对照组大鼠体重比较无显著性差异(t=1.03,P=0.32)。实验结束时饮酒组体重与对照组大鼠体重比较亦无显著性差异(t=0.12,P=0.90)。提示酒精不影响大鼠生长及体重变化,见图1。
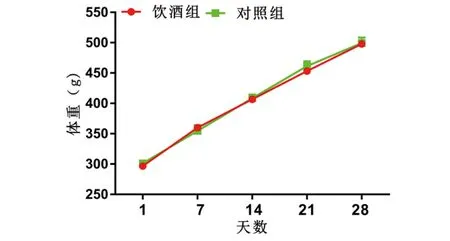
图1 饮酒组与对照组大鼠体重变化
2.1.2 SD大鼠间歇性主动饮酒模型的建立 结果显示,随着饮酒次数的增加,SD大鼠酒精摄入量(图2A)与饮酒偏好(图2B)逐渐升高,最终维持在稳定基线,提示酒精依赖模型构建成功,见图2。
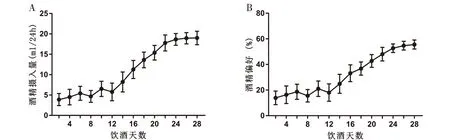
图2 饮酒组大鼠酒精摄入量、酒精偏好变化
2.2 NOS抑制剂L-NAME对饮酒偏好的影响L-NAME注射后,6 h内酒精偏好比较结果显示,与生理盐水组和假手术组相比,L-NAME组酒精偏好明显降低,差异具有统计学意义(F2,15=38.89,P<0.001),见图3。
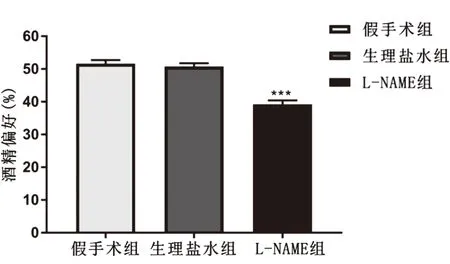
图3 L-NAME注射后6 h内酒精偏好变化
2.3 NO清除剂C-PTIO对饮酒偏好的影响C-PTIO注射后,6 h内酒精偏好比较。结果显示,与生理盐水组和假手术组相比,C-PTIO组酒精偏好明显降低,且差异具有统计学意义(F2,15=37.56,P<0.001),见图4。
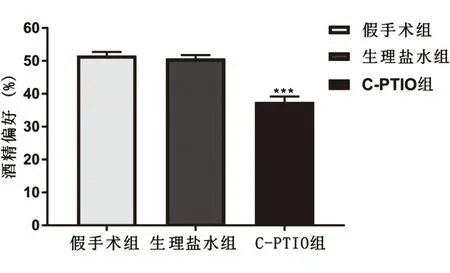
图4 C-PTIO注射后6 h内酒精偏好变化
3 讨论
AUD包括酒精依赖与酒精成瘾,是一种复杂的慢性疾病,在高收入和中等收入国家尤为突出,会造成巨大的个人和社会经济负担[6]。对酒精相关刺激的反应性增强和执行功能受损是AUD的标志[7]。因此研究酒精在体内诱发的神经适应对于临床治疗及预防具有重要作用。
持续饮酒可诱导AUD模型[8]。但在AUD的临床前研究中,一个主要的挑战仍然是通过何种饮酒模式,以引出实验动物摄入高饮酒量,并模拟从低或中度饮酒到过度饮酒的渐进转变。20%酒精间歇性主动饮酒模型是一种低成本、简单、易得的酒精摄取方案,可有效诱导几种远交系大鼠(包括SD大鼠)自愿饮用大量酒精从而构建酒精依赖模型,以便更深入地了解酒精奖赏效应相关机制[9]。自愿酒精摄入量和饮酒偏好的增加是20%酒精间歇性主动饮酒模型的主要特征。与之前报道类似,本实验中发现随着饮酒范例的增加,SD大鼠的酒精摄入量和酒精偏好稳定增加,提示成功建立大鼠酒精依赖模型。此外,有研究报道间歇性酒精摄入戒断后会导致动物随后摄入更多的酒精[10],我们前期研究也发现20%酒精间歇性主动饮酒模型中,酒精戒断72 h后大鼠再饮酒量显著增加。因此在本研究中,SD大鼠在酒精戒断72 h后对VTA进行微量注射。
AUD是由参与酒精奖赏效应的特定神经回路调节[11],有研究表明NO信号通路之间的密切相互作用可能是导致AUD发生的神经生化基础[12],干预NO信号可能对治疗AUD有益。因此为了明确与酒精奖赏效应密切相关的VTA中NO对酒精偏好的影响,我们向酒精依赖大鼠VTA微量注射了NO清除剂C-PTIO、NO合酶抑制剂L-NAME,结果显示C-PTIO与L-NMAE均可以明显降低SD大鼠戒断后再次饮酒时的酒精偏好,提示NO可能对饮酒行为具有调控作用。
综上所述,我们发现20%酒精间歇性主动饮酒可以诱导SD大鼠酒精依赖,VTA微量注射C-PTIO或者L-NAME均可以明显降低大鼠戒断后再次饮酒时的酒精偏好,提示NO涉及的信号通路可能参与了饮酒行为,对AUD的临床治疗及预防具有指导意义。
