丁苯酞对帕金森细胞模型的保护作用
2021-07-23郭宝娟白雨鑫杨晓帆
周 倩,郭宝娟,王 慧,梁 军,白雨鑫,杨晓帆,陈 培
(牡丹江医学院1.基础医学院病理学与病理生理学教研室;2.基础医学院组织与胚胎学教研室;3.第一临床医学院病理学教研室;4.附属红旗医院康复科,黑龙江 牡丹江 157011)
帕金森病(Parkinson disease,PD)是临床上最常见的神经变性疾病之一,病理特征表现为中脑黑质多巴胺能神经元的缺失和α-突触核蛋白的聚集[1]。目前临床上常规使用的多巴胺替代疗法只能缓解部分临床症状,无法减缓多巴胺能神经退行性变的进展。抗氧化治疗在一定程度上为帕金森的治疗开辟了新的方向。丁苯酞由中国医学科学院自主研制从芹属种子中提取分离出来的化合物,目前用于缺血性脑卒中的治疗。许多新的研究成果发现丁苯酞帕金森病也发挥了重要的保护作用[2],同时临床研究也发现了丁苯酞在帕金森病患者中也有一定的疗效,但药理作用涉及许多复杂的分子机制,有待进一步研究。
1 材料与方法
1.1 细胞与试剂人神经母细胞瘤(SH-SY5Y)细胞(购自于上海酶研生物有限公司)、丁苯酞(购自中国食品药品检定研究所,药物纯度>99.98%)、MPP+(购自美国Sigma公司)、NO试剂盒(购自上海碧云天公司)、α-突触核蛋白及β-actin一抗(购自affinity生物公司)。
1.2 主要仪器CO2恒温培养箱、-80 ℃冰箱、4 ℃低温离心机、低温高速离心机、酶标仪、100~1000 μL微量移液器、分析天平、电子显微镜(日本OLYMPUS-IX71)、蛋白电泳和转膜设备、凝胶成像系统。
1.3 实验方法
1.3.1 细胞培养 将SH-SY5Y细胞株置于DMEM/F12=1∶1(含10 %的胎牛血清)的培养基,37 ℃,5% CO2孵育箱中培养,每2~3 d细胞换液1次,镜下观察细胞密度达到70%~80%时可以进行传代及相关实验。
1.3.2 镜下观察各组细胞形态变化 使用前期实验的最适浓度结果来处理细胞。Control组:正常含血清培养基进行培养;MPP+组:1 mmol/L MPP+培养24 h;丁苯酞组:10 μmol/L丁苯酞预处理保护3 h后加入1 mmol/L MPP+处理直至24 h。模型构建完成后,镜下观察各组细胞的状态,并采集照片。
1.3.3 细胞NO浓度的检测 取对数生长期的SH-SY5Y细胞,消化并调节细胞密度为5×104个/mL,接种于96孔板中,每孔100 μL,设4个复孔,培养24 h后更换培养液处理细胞;分组如下:Control组、MPP+组、丁苯酞组;取出Griess Reagent I和II放置至室温,用细胞培养液稀释标准品。标准品的浓度取0、1、2、5、10、20、40、60、100 μM,在96孔板中加入标准品及各实验组的上清液50 μL/孔,最后每孔内加入50 μL Griess Reagent I和Griess Reagent II,酶标仪540 nm测定OD值,绘制出标准曲线,即可确定样品中NO的浓度。实验重复三次。
1.3.4 Western blot检测蛋白表达 取对数生长期细胞,以1×106个/孔接种于六孔板中,按照1.3.2分组处理成功后弃去培养基,PBS轻轻冲洗2遍,用加入PMSF的RIPA裂解液冰上裂解30 min,提取细胞内总蛋白,采用BCA法测定蛋白浓度。根据蛋白分子量,配制15 %分离胶,80 V 30 min,120 V 60 min进行蛋白分离。湿转法将蛋白转移至PVDF膜,用5 %的脱脂奶粉封闭120 min,加入一抗4 ℃孵育过夜。次日,TBST冲洗3次后二抗室温孵育1 h。TBST洗膜3次后用ECL发光液进行化学发光显影,β-actin 作为内参。应用Image J软件对条带进行灰度值比较。实验重复三次。
1.4 统计学方法采用GraphPad Prism 7.0软件进行统计学分析。实验数据以“均数±标准差”表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 镜下观察各组细胞形态变化镜下观察细胞,A组为正常细胞,大部分呈多边形,少数细胞呈圆形,有些细胞可见长的突起,有分枝,并相互交叉构成网络,贴壁能力强;与A组相比,B组细胞总体数量减少,细胞突起明显减少、缩短,折光性改变,贴壁能力降低,出现漂浮死亡的细胞;加入丁苯酞保护后C组中细胞损伤程度有所减轻,存活细胞数量增加,贴壁能力增强,漂浮死亡细胞减少,见图1。
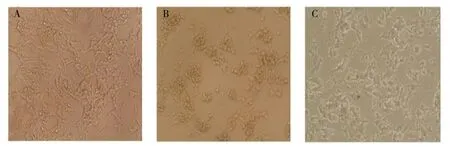
图1 各组细胞的形态学特点(×100)
2.2 丁苯酞抑制SH-SY5Y细胞NO的生成检测结果表明,与Control组相比,MPP+组细胞内NO浓度增加(P<0.001);加入丁苯酞保护后,细胞内NO浓度降低(P<0.001),提示丁苯酞可以抑制细胞内NO的生成,见图2。
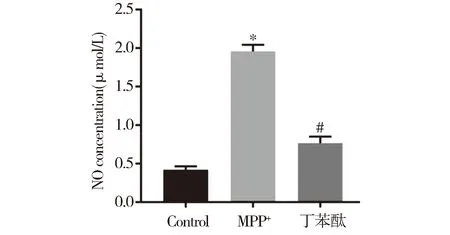
图2 丁苯酞对SH-SY5Y细胞内NO生成的影响
2.3 丁苯酞减少SH-SY5Y细胞内α-突触核蛋白表达检测结果表明,与Control组相比,MPP+组可以观察到α-突触核蛋白的表达明显增加(P<0.001);丁苯酞加入保护后,与MPP+组相比,α-突触核蛋白的表达降低(P<0.001);提示丁苯酞可以抑制细胞内α-突触核蛋白的表达,对神经元细胞产生保护作用,见图3。
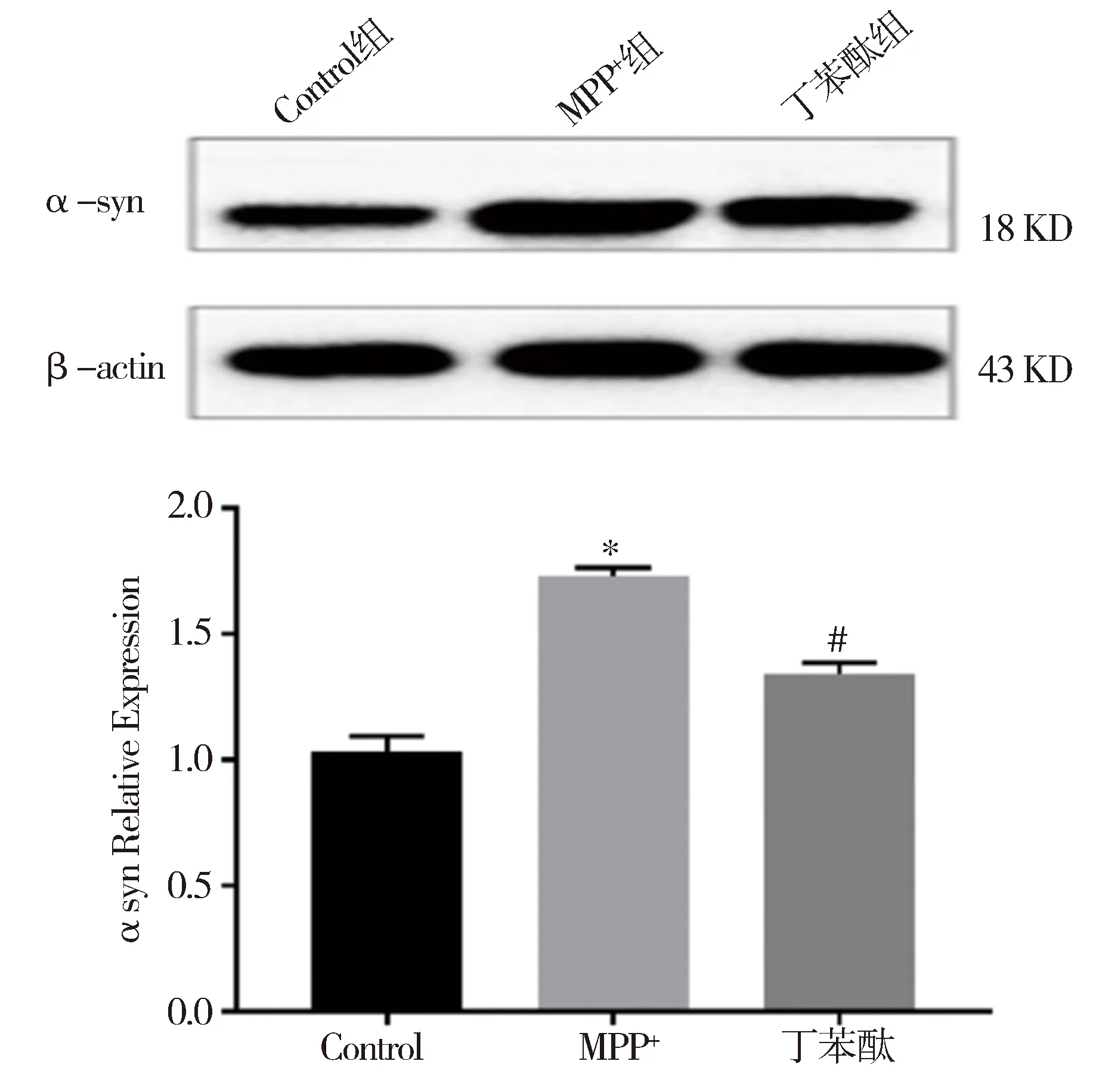
图3 丁苯酞对SH-SY5Y细胞内α-突触核蛋白表达的影响
3 讨论
PD发病主要见于中老年人群,以静止性震颤、运动迟缓、姿势步态异常等为主要临床表现,除此之外还有嗅觉、自主神经、认知异常等非运动症状[3]。发病机制十分复杂,临床治疗难度高。到目前为止,尽管有不同的预防策略可以在一定程度上缓解帕金森病相关症状,但无法最终治愈帕金森病。伴随着我国老龄化基本国情的加快,帕金森病的不可治愈性、病理过程的复杂性、巨大的医疗费用、心理负担的产生,尤其是晚期常常表现为痴呆症和独立生活能力的丧失,甚至是残疾,严重影响帕金森病患者的日常生活质量[4]。目前,帕金森病的发病原因及具体机制仍然不清楚,而氧化应激在神经退行性疾病的发生发展中具有重要推动作用[5-6]。
SH-SY5Y细胞(人神经母细胞瘤细胞),能够分泌TH、多巴胺转运蛋白等活性物质,在生理、生化许多方面都与多巴胺能神经元细胞极为相似,符合帕金森的病理学特征,并且相对而言易获得和培养[7]。MPP+化学结构与多巴胺相似,它可以穿过血脑屏障作用于多巴胺能神经元细胞,诱发神经炎症、氧化物增加、金属离子增加。因此目前被广泛应用于研究帕金森病的多巴胺能神经元模型[8]。
在前期实验中通过CCK8法测细胞存活率已经获得MPP+组的最适浓度为1 mmol/L,丁苯酞的最适浓度为10 μmol/L,在此基础上进行下一步相关机制的探究。本实验结果显示经过MPP+处理后,SH-SY5Y细胞内氧化物NO明显增加,说明细胞内处于高氧化应激状态,且帕金森病理学标志性物α-突触核蛋白表达显著增加。但是经过丁苯酞预处理保护3 h后,与MPP+组相比,观察到细胞内NO减少,α-突触核蛋白表达也降低,说明细胞内由MPP+引起的氧化应激被有效改善,同时还抑制了SH-SY5Y细胞内α-突触核蛋白的聚集。
综上所述,实验证实了丁苯酞的预处理对神经元确实存在一定的抗氧化作用,抑制神经毒性对神经元细胞的损伤,但其中具体的保护机制需要进一步挖掘。
