金骨莲胶囊HPLC指纹图谱及化学模式识别研究
2021-07-21肖金超张庆捷李勇军王爱民
刘 慧 ,肖金超 ,张庆捷,蒲 健,谭 丹,李勇军,王爱民,郑 林,黄 勇*
1.贵州医科大学贵州省药物制剂重点实验室/药用植物功效与利用国家重点实验室,贵州 贵阳 550004
2.贵州医科大学药学院,贵州 贵阳 550004
3.贵州益佰制药股份有限公司,贵州 贵阳 550008
4.贵州医科大学民族药与中药开发应用教育部工程研究中心,贵州 贵阳 550004
金骨莲胶囊(Jingulian Capsules,JGLC)源于经典苗药组方,由大血藤、八角枫、透骨香、汉桃叶和金铁锁5味药材为主要原料,采用水煮、浓缩等工艺精制而成的复方中药制剂,为治疗风湿痹症的全国苗药独家品种和贵州益佰制药股份有限公司的拳头产品[1-2]。具有祛风除湿、消肿止痛之功效(苗医:抬奥、抬蒙、僵见风)。收载于《国家中成药标准汇编》[3]和《国家基本医疗保险药品目录》[4]。临床上主要用于风湿痹症所致的关节肿痛、屈肿不利的治疗,疗效独特[5-7]。现行质量标准仅对大血藤、透骨香和金铁锁进行薄层色谱鉴别,以及对汉桃叶中富马酸进行含量限定(不低于0.01%),难以体现制剂的整体特性和内在品质。为了更全面地评价JGLC的质量,本研究采用HPLC法建立了12批JGLC指纹图谱,共标定了19个共有峰,经鉴定其中的9个色谱峰分别为富马酸、没食子酸、原儿茶酸、红景天苷、绿原酸、香草酸、表儿茶素、鹅掌楸苷、滇白珠苷A。在指纹图谱相似度评价的基础上,结合化学模式识别分析方法对12批JGLC进行质量研究,旨在为该制剂建立更系统、全面的质量控制标准提供借鉴与参考。
1 仪器与试药
1.1 仪器
Ultimate 3000型高效液相色谱仪,美国Thermo Fisher Scientific公司,包括系统控制器、输液泵(LPG-3400SD)、柱温箱(TCC-3000SD)、温控样品室(WPS-300SL)、UV-DAD检测器(DAD-3000)、脱气组件、低压梯度组件、Chromeleon 7色谱数据工作站和自动进样器;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;EL-240型电子天平,梅特勒-托利多仪器有限公司;WP-UP-IV-20型超纯水机,四川沃特尔科技发展有限公司。
1.2 试药
JGLC,规格:每粒装0.25 g,批号分别为180502、191001、191007、191005、190409、190410、191002、200708、200711、200707、200706、200710,依次编号为S1~S12,贵州益佰制药股份有限公司;大血藤(产地湖北,批号YL-17920190401)、透骨香(产地贵州,批号YL-17520190401)、汉桃叶(产地贵州,批号JYL-20191006)、八角枫(产地河南,批号YL-17720190401)、金铁锁(产地贵州,批号YL-17820190302)药材均由贵州益佰制药股份有限公司提供,经贵州医科大学药学院生药学教研室龙庆德教授鉴定,大血藤为木通科植物大血藤Sargentodoxa cuneata(Oliv.) Rehd.et Wils.的干燥藤茎;透骨香为杜鹃花科植物滇白珠Gaultherla yunnaensis(Pranech) Rehd.的干燥全株;汉桃叶为五加科植物白花鹅掌柴Schefflera leacantheVig.的干燥带叶茎枝;八角枫为八角枫科植物八角枫Alanglum chinese(Lour.) Hars及瓜木Alanglum platanifolum(Steb.et Zuce.) Harms的干燥枝根(白金条);金铁锁为石竹科植物金铁锁Psammosilene tunicoidesW.C.Wu et C.Y.Wu的干燥根。富马酸(批号181120,质量分数≥99%)、红景天苷(批号181020,质量分数≥98%)对照品购于北京世纪奥科生物技术有限公司;没食子酸(批号110831-201906,质量分数91.5%)、绿原酸(批号110753-201716,质量分数99.3%)对照品购于中国食品药品检定研究院;原儿茶酸(批号MUST-20110310,质量分数99.78%)对照品购于成都曼思特生物科技有限公司;香草酸(批号AF20020852,质量分数99.29%)、表儿茶素(批号AF8030805,质量分数98%)、鹅掌楸苷(批号AF91002701,质量分数≥98%)对照品购于成都埃法生物科技有限公司;滇白珠苷A(批号20190223,质量分数>98%)对照品为实验室自制。乙腈、甲醇为色谱纯;其他试剂均为分析纯;水为超纯水。
2 方法与结果
2.1 色谱条件
采用ACE Excel 5 C18-PFP(250 mm×4.6 mm,5 μm)色谱柱;流动相为乙腈-0.1%磷酸水溶液;梯度洗脱:0~40 min,5%~20%乙腈;40~50 min,20%~25%乙腈;50~55 min,25%~35%乙腈;体积流量为0.8 mL/min;进样量为10 μL;柱温为40 ℃;检测波长为210 nm。
2.2 溶液的制备
2.2.1 对照品溶液 分别精密称取富马酸、没食子酸、原儿茶酸、红景天苷、绿原酸、香草酸、表儿茶素、鹅掌楸苷、滇白珠苷A对照品适量,加入甲醇,制成质量浓度分别为1.120、1.002、1.038、1.046、1.182、0.402、1.032、0.950、1.116 mg/mL的对照品溶液。
精密移取各单一对照品溶液适量,用50%甲醇逐步稀释,最终配制成含富马酸、没食子酸、原儿茶酸、红景天苷、绿原酸、香草酸、表儿茶素、鹅掌楸苷、滇白珠苷A质量浓度分别为17.920、8.016、24.912、16.736、37.824、6.432、16.512、30.400、17.856 μg/mL的混合对照品溶液,置于4 ℃冰箱冷藏备用。
2.2.2 供试品溶液 取JGLC内容物1.0 g,精密称定,置于具塞锥形瓶中,精密加入50%甲醇25 mL,称定质量,超声处理(300 W、40 kHz)30 min,取出,冷却后称定质量,50%甲醇补足减失的质量,摇匀,取适量溶液过0.22 μm微孔滤膜,取续滤液,即得。
2.2.3 单味药材溶液 分别称取JGLC处方药材大血藤、透骨香、汉桃叶、八角枫、金铁锁各约50 g,根据制剂的处方工艺分别制备各单味药材样品。按“2.2.2”项下方法制备药材溶液,即得。
2.3 方法学考察
2.3.1 精密度试验 取同一份样品(批号191001),按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进行检测,连续进样分析6次,记录所得图谱,以15号峰鹅掌楸苷为参照峰(分离度良好,峰面积较大且为所有批次共有),计算主要色谱峰相对保留时间和相对峰面积的RSD。结果显示各色谱峰的相对保留时间的RSD为0.01%~0.08%,相对峰面积的RSD为0.30%~2.69%,说明该仪器精密度良好。
2.3.2 重复性试验 取同一份样品(批号191001),按“2.2.2”项下方法平行制备6份供试品溶液,按“2.1”项下色谱条件进行检测分析,以15号峰鹅掌楸苷为参照峰,计算主要色谱峰相对保留时间和相对峰面积的RSD。结果显示,各色谱峰的相对保留时间的RSD为0.02%~0.37%,相对峰面积的RSD为0.56%~4.73%,说明该分析方法重复性良好。
2.3.3 稳定性试验 取同一份样品(批号191001),按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件分别于0、2、4、8、12、24 h进行检测,以15号峰鹅掌楸苷为参照峰,计算主要色谱峰相对保留时间和相对峰面积的RSD。结果显示,各色谱峰的相对保留时间的RSD为0.03%~0.42%,相对峰面积的RSD为1.12%~4.77%,说明供试品溶液在24 h稳定性良好。
2.4 指纹图谱的建立及相似度评价
2.4.1 指纹图谱的建立 取12批JGLC(S1~S12),按“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进行检测,记录色谱图。将色谱图以AIA格式导入《中药指纹图谱相似度评价系统》(2012版)进行分析,以S1号样品的色谱图为参照图谱,设定时间窗宽度为0.1 min,对12批制剂进行多点校正后自动峰匹配,12批制剂的指纹图谱叠加图见图1,共标定了19个共有峰,其中15号色谱峰(鹅掌楸苷)保留时间适中、分离度良好,峰面积较大,作为参照峰(S)。以中位数法生成对照指纹图谱(R),结果见图1。

图1 12批JGLC的HPLC指纹图谱叠加图 (A) 及其对照指纹图谱 (R)Fig.1 HPLC superimposed fingerprint of 12 batches of JGLC (A) and its reference fingerprint (R)
2.4.2 共有峰的指认 按“2.1”项下色谱条件分别测定供试品溶液和混合对照品溶液,见图2。通过各峰的保留时间及化学成分的紫外光谱图对比,共指认了9个成分,分别为2(富马酸)、3(没食子酸)、6(原儿茶酸)、7(红景天苷)、9(绿原酸)、12(香草酸)、13(表儿茶素)、15(鹅掌楸苷)、16(滇白珠苷A)号峰。

图2 混合对照品溶液 (B) 和JGLC溶液 (C) 的HPLC图Fig.2 HPLC chromatogram of mixed reference substances solution (B) and JGLC solution (C)
2.4.3 共有峰的归属 通过将单味药材溶液和JGLC溶液的HPLC色谱图进行比较,对指纹图谱共有峰进行药材归属,见图3。1号为5味药材共有;2、8、11号峰来源于汉桃叶;5、7、10、12、15号峰来源于大血藤;16、17、19号峰来源于透骨香;3号为八角枫和大血藤共有;13号为大血藤和透骨香共有;4、9、14、18号峰为大血藤和汉桃叶共有;6号为大血藤、汉桃叶和透骨香共有。结果表明制剂与单味药材的相关性良好。

图3 JGLC及单味药材溶液HPLC图Fig.3 HPLC chromatogram of JGLC and its single herb solution
2.4.4 指纹图谱相似度评价 采用《中药指纹图谱相似度评价系统》(2012版)对12批JGLC的指纹图谱进行相似度计算,见表1。12批制剂的相似度均在0.910以上,说明该制剂各批次之间相似度良好,质量较稳定。

表1 12批JGLC相似度评价结果Table 1 Results of similarity evaluation of 12 batches of JGLC
2.5 化学模式识别
2.5.1 层次聚类分析(hierarchical clustering analysis,HCA)[8-9]运用SPSS 20.0软件,以12批JGLC的19个共有峰的相对峰面积为变量,采用Ward法,以欧氏距离作为度量标准进行HCA,见图4。当欧氏距离为20时,12批样品共聚为2类:S1~S7聚为一类;S8~S12聚为另一类。当欧氏距离为10时,12批样品共聚为3类:S1~S4、S7批次样品聚为第1类;S5~S6批次样品聚为第2类;S8~S12聚为第3类。

图4 12批JGLC (S1~S12) 指纹图谱的聚类分析树状图Fig.4 Dendrogram of hierarchical clustering analysis of 12 batches of JGLC (S1—S12)
2.5.2 主成分分析(principal component analysis,PCA)[10]以12×19峰面积数据矩阵为数据,运用SIMCA 11.0软件对12批JGLC进行PCA,特征值、方差贡献率及累计方差贡献率见表2。提取的前3个主成分的累积方差贡献率达到85.324%,表明前3个主成分能够反映JGLC的基本特征和大部分信息。图5为PCA得分图,将12批样品分为3类,结果与HCA基本一致,也进一步验证了聚类分析的分类结果。

图5 12批JGLC样品的PCA得分图Fig.5 PCA score plot of 12 batches of JGLC
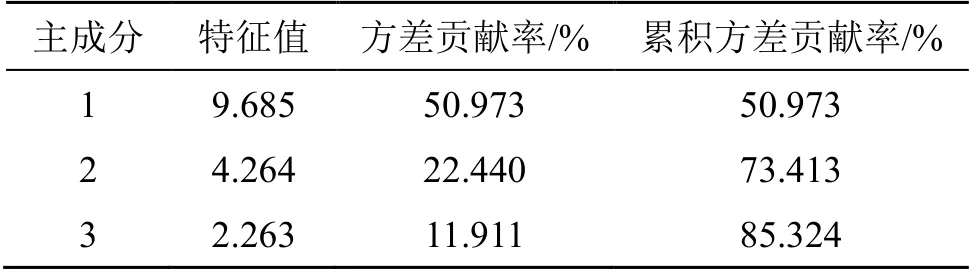
表2 JGLC PCA特征值与累积方差贡献率Table 2 Eigenvalue and total variance of PCA of JGLC
根据变量离原点的距离判定变量对主成分的权重影响,离远点越远则表明该变量对主成分的影响权重越大[11]。由载荷散点图(图6)分析得到5、14、9(绿原酸)、2和10号色谱峰对主成分1的贡献率较大;16(滇白珠苷A)、17、18、19、11、15(鹅掌楸苷)号色谱峰对主成分2的贡献较大。

图6 12批JGLC主成分模型载荷图Fig.6 Loading plot of 12 batches of JGLC
2.5.3 正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)[12-13]将12批样品的19个共有峰峰面积导入SIMCA 11.0,对12批样品进行OPLS-DA,在该模型下R2X为0.829,R2Y为1.000,Q2为0.907,均大于0.5,表明该模型具有较好预测能力[14-15]。为验证所建模型是否存在过拟合现象,进一步采用200次响应排序检验,结果所有通过随机排序计算得到的R2和Q2值均小于原始值,且Q2回归直线与Y轴有负截距图(图7),说明模型是有效的,不存在过度拟合[16],可用于JGLC差异标志物的筛选。12批样品共分为3类(图8)与聚类分析和PCA分类结果一致。

图7 OPLS-DA模型的200次响应排序检验Fig.7 200 response permutation tests for OPLS-DA model
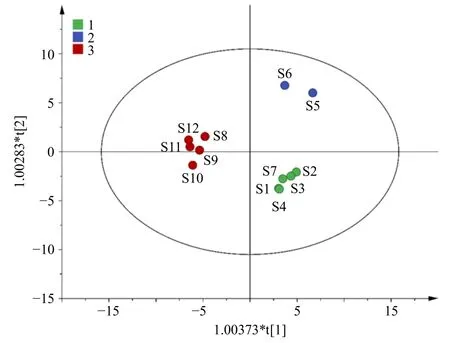
图8 12批JGLC OPLS-DA得分图Fig.8 OPLS-DA score plot for 12 batches of JGLC
为进一步筛选出导致12批样品产生差异的成分,通过提取OPLS-DA模型中19个变量的重要值(variable importance in projection,VIP),以VIP>1为标准[17],筛选出15(鹅掌楸苷)、14、6(原儿茶酸)、18、16(滇白珠苷A)、19、9(绿原酸)号峰(图9)可能是导致样品之间产生差异的主要原因,具有一定的标志性作用,该结果与PCA载荷图中寻找的重要性权重变量基本一致。

图9 JGLC的OPLS-DA的VIP值图Fig.9 VIP plot of OPLS-DA for JGLC
3 讨论
在供试品溶液制备方法考察时,分别考察了不同提取方式(超声、加热回流),不同提取溶剂(甲醇、75%甲醇、50%甲醇、25%甲醇、无水乙醇、75%乙醇、50%乙醇、25%乙醇和水),不同提取时间(15、30、60 min)对JGLC有效成分提取的影响,综合色谱峰数量及响应值,确定采用50%甲醇为提取溶剂,超声提取30 min,作为供试品的处理方法。
中药指纹图谱是一种综合的、可量化提供化学成分特征的色谱图,可通过表征中药复杂成分及内在质量的关系来较为全面地反映所含化学成分的种类及数量,从而评价中药质量的一致性及稳定性,在中药材及中药复方制剂的质量评价中已被广泛应用[18-21]。本研究首次采用HPLC法建立了12批JGLC的指纹图谱,标定了19个共有峰并结合组方单味药材溶液的色谱图进行比较,19个共有峰均得以归属,表明制剂与药材具有良好的关联性。提示可以从药材源头入手,以便更好地控制制剂的稳定性和均一性。通过与对照品进行比对,鉴定了9个色谱峰,分别为富马酸、没食子酸、原儿茶酸、红景天苷、绿原酸、香草酸、表儿茶素、鹅掌楸苷和滇白珠苷A。相似度评价结果显示各批次间的相似度均大于0.910,说明12批JGLC的相似度良好,质量较稳定。
从HCA结果来看,在不同年份及月份生产的JGLC中的化学成分含量存在一定的差异,可能与制剂所用的原药材来源、采收季节以及原药材批间质量差异有关。随后进行了无监督的PCA,该分类结果与聚类分析一致,也进一步验证了聚类分析的结果。在对JGLC进行一致性评价的同时进行了差异性评价,通过VIP法筛选出了对样品组分影响较大的成分,发现15(鹅掌楸苷)、14、6(原儿茶酸)、18、16(滇白珠苷A)、19、9(绿原酸)号峰为差异标志物,提示在今后该药品的生产过程中应重点关注这7个成分的变化,进而保证药品的质量,然而14、18、19号峰尚未知,后续将会进一步采用液质联用等手段对未识别的成分进行鉴定,以便更好地对JGLC进行质量控制。
综上所述,本实验所建立的JGLC指纹图谱方法简单、准确度高,可用于该药品的质量控制研究。
利益冲突所有作者均声明不存在利益冲突
