肉及肉制品中6种致病菌的GeXP多重PCR检测
2021-07-21杨梦婕徐玲丽马学军武桂珍
杨梦婕,徐玲丽,马学军,武桂珍
(1.国家卫生健康委员会医学病毒和病毒病重点实验室,中国疾病预防控制中心病毒病预防控制所,北京102206;2.上海爱博才思分析仪器贸易有限公司,上海200335)
近年来全球食源性疾病的发病率呈现出显著上升的趋势[1-2],患者死亡率较高[3]。食源性疾病指的是经过摄食途径进入到人体中的致病因子所引发的疾病,致病因子种类繁多,包括细菌、真菌和病毒等,而食源性致病菌以来源多样、能在食品中迅速繁殖为特点而成为首要的致病因子,严重威胁着食品安全与人类健康[4-5]。 有研究显示,肉及肉制品加工过程中发生的交叉污染导致的食物中毒发病率达到18.6%,单增李斯特菌、沙门氏菌、金黄色葡萄球菌、大肠杆菌等为重点致病菌检测对象[6],我国肉制品中致病菌的检测相关国家标准除上述4种致病菌外,还包含志贺氏菌、副溶血性弧菌等[7],这些肉及肉制品中常见的致病菌与多数食源性疾病的爆发有关。
我国国标中食源性致病菌的检测多沿用传统方法,耗时较长,不适宜应对和控制大规模食源性疾病的爆发及食物中毒应急处置。免疫学检测技术存在灵敏度偏低、检测通量小等缺点,市场上的商业化试剂盒成本高,不易普及推广。因此,建立一种准确、高效、灵敏的食源性病原菌检测体系显得颇为重要。本研究以大肠杆菌O157∶H7rfbE基因、金黄色葡萄球菌FemA基因、志贺氏菌ipaH基因、副溶血性弧菌tlh基因、单核细胞增生李斯特菌PfrA基因和沙门氏菌invA基因作为目标基因,建立了基于多重基因表达(gene expression profiler,GeXP)遗传分析系统的能同时检测上述6种食源性致病菌的多重聚合酶链式反应(polymerase chain reaction,PCR)检测方法。该系统采用占主导地位的荧光标记通用引物和特异性嵌合引物相结合建立多重PCR反应体系,利用毛细管电泳分离检测目标扩增片段的长度及其荧光信号,根据片段大小区分不同的致病菌[8],在短时间内实现对多个样本同时进行多种致病菌检测,为食源性致病菌的快速检测提供了新的参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与肉类样本
大肠杆菌 O157∶H7 标准菌株(CI21530CC)、金黄色葡萄球菌标准菌株(ATCC13565)、志贺氏菌标准菌株[CMCC(B)51592]、副溶血性弧菌标准菌株(ATCC17082)、单核细胞增生李斯特菌标准菌株(ATCC19115)、沙门氏菌标准菌株(CMCC(B)50115):上海SCIEX公司。
鸡肉、牛肉、猪肉、羊肉:市售。
1.1.2 主要试剂
细菌基因组DNA提取试剂盒:天根公司;多重PCR扩增试剂盒:凯杰公司;TSBYE培养基:上海广锐生物科技有限公司;DNA marker(DSS400,DSS600)、分离缓冲液、上样缓冲液、分离胶等:美国贝克曼库尔特有限公司。
1.2 仪器与设备
离心机、移液器:Eppendorf公司;PCR仪:Thermo公司;GeXP遗传分析系统:美国贝克曼库尔特有限公司。
1.3 方法
1.3.1 菌株基因组DNA提取
按照细菌基因组DNA提取试剂盒(Cat.#DP302)说明书进行基因组DNA提取。取1mL菌液,12000r/min离心2 min,收集菌体加溶菌酶、蛋白酶K及RNase进行菌体裂解,56℃加热30 min,然后相关溶液进行抽提、洗脱,最终得纯化 DNA60 μL,每 20 μL 分装(避免反复冻融)于-20℃冰箱保存备用。
1.3.2 引物设计及特异性验证
以大肠杆菌O157∶H7 rfbE基因、金黄色葡萄球菌FemA基因、志贺氏菌ipaH基因、副溶血性弧菌tlh基因、单核细胞增生李斯特菌PfrA基因和沙门氏菌invA基因作为目标扩增基因,所用引物序列参照SN/T 2641—2010《食品中常见致病菌检测PCR-DHPL法》。在所有正反向引物的5’端分别加入一段非同源性特异序列构成嵌合引物,该非同源性特异序列作为通用引物(Tag),Tag序列为 Tag-F:5’-AGGTGACACTATAGAATA-3’和 Tag-R:5’-GTACGACTCACTATAGGGA-3’,其中正向通用引物Tag的5’端标记荧光染料Cy5(Cy5-Tag-F)。所有引物由上海生工公司合成,其中Cy5-Tag-F引物采用高效液相色谱(high performance liquid chromatography,HPLC)纯化方式,其他特异性嵌合引物及反向通用引物采用聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE) 方式纯化。使用单重PCR法验证各引物特异性,确定各目的基因扩增片段的实际大小。引物序列与目的扩增产物大小见表1。

表1 引物序列与目的扩增产物大小Table 1 Sequences of the primers and the size of the PCR products

续表1 引物序列与目的扩增产物大小Continue table 1 Sequences of the primers and the size of the PCR products
1.3.3 GeXP多重PCR体系特异性及灵敏性验证
1.3.3.1 GeXP多重PCR体系的特异性验证
将6种标准菌株基因组DNA混合均匀作为GeXP多重PCR体系的模板,并向该体系加入对应的6对引物,并设立阴性对照(以非目标菌的DNA为模板)和空白对照(以无菌水为模板),根据扩增片段长度经过多次引物浓度调整优化,最终确定正反向混合引物中各嵌合引物的工作浓度为50 nmol/L~200 nmol/L,通用引物的工作浓度为10 μmol/L。多重PCR反应体系为:2*MIX 12.5 μL,正反向嵌合引物混合物各2.5 μL, 正反向通用序列引物(10 μmol/L)1 μL,DNA模板1 μL,RNase-无菌水补足至25 μL。 参考Temperature Swich PCR[9](TSP)原理反复优化多重PCR反应条件进行扩增, 扩增条件为:95℃,15s;95 ℃,30s;55℃,30 s;72 ℃,30 s,10 个循环;95 ℃,30 s;65℃,30s;72℃,30s,10 个循环;95℃,30s;48℃,30s;72℃,30 s,20 个循环。PCR结束后取1 μL PCR产物进行GeXP系统毛细管电泳,选用分析参数(Default GeXP Analysis Parameter DSS-600)进行PCR产物的片段分析。
1.3.3.2 GeXP多重PCR体系的灵敏性验证
将6种标准菌的菌悬液(106CFU/mL)分别以10倍梯度稀释后,提取基因组DNA进行GeXP多重PCR扩增,以验证该法的灵敏性。每个浓度均在非同日重复3次。同时构建重组质粒(人gapdh基因片段克隆至pTOPO-TA/Blunt Simple载体)作为该多重PCR体系的阳性内参。
1.3.4 实际样本检测
53份肉类样品均采购于正规超市和生禽市场,包括鸡肉15份(鸡肝、鸡翅、鸡头)、牛肉10份、猪肉20份(猪肝、猪耳、猪臀尖)、羊肉8份。对各种肉类随机取样15 g加入到TSBYE培养液中,37℃恒温培养过夜,第2天按细菌基因组DNA提取试剂盒说明书取1.5 mL培养物进行DNA提取,然后按1.3.3.1中GeXP多重PCR反应体系和条件进行扩增。
2 结果与分析
2.1 单重引物特异性验证
单重PCR扩增产物经GeXP系统毛细管电泳分析,各靶基因扩增片段大小与预期相符,且每种菌的特异性引物只针对该菌,与其它菌均无交叉反应,说明引物的特异性好。
2.2 GeXP多重PCR体系特异性验证
分别以6种标准菌株基因组DNA为样本,经GeXP多重PCR扩增后,每个反应只出现对应的特异峰,结果如图1所示,无非特异性峰出现,说明该多重体系的特异性好。
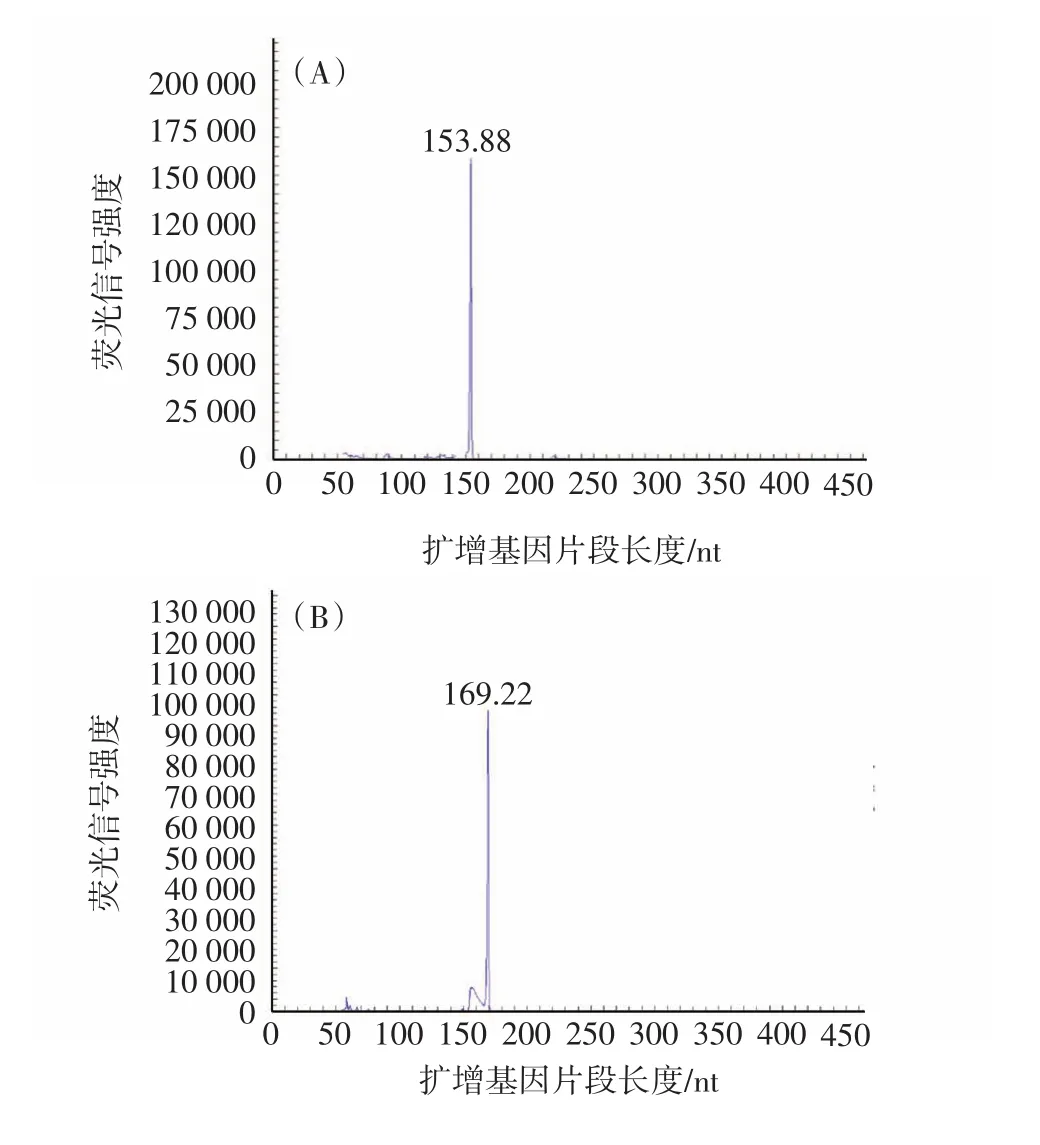
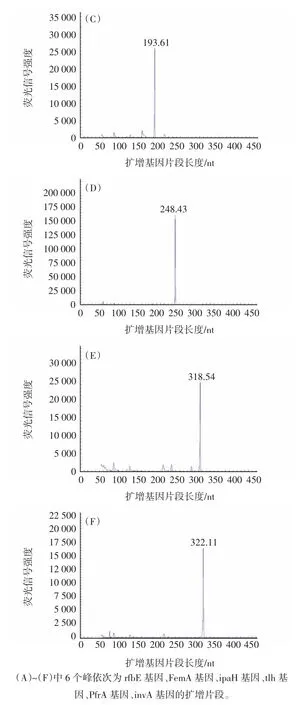
图1 多重PCR体系的特异性验证Fig.1 The specificity results of GeXP multiplex PCR system
2.3 GeXP多重PCR体系灵敏性验证
以 6 种标准菌株浓度分别为 106、105、104、103、102CFU/mL的混合液作待检样品,进行GeXP多重PCR方法的灵敏度分析,结果如图2所示。
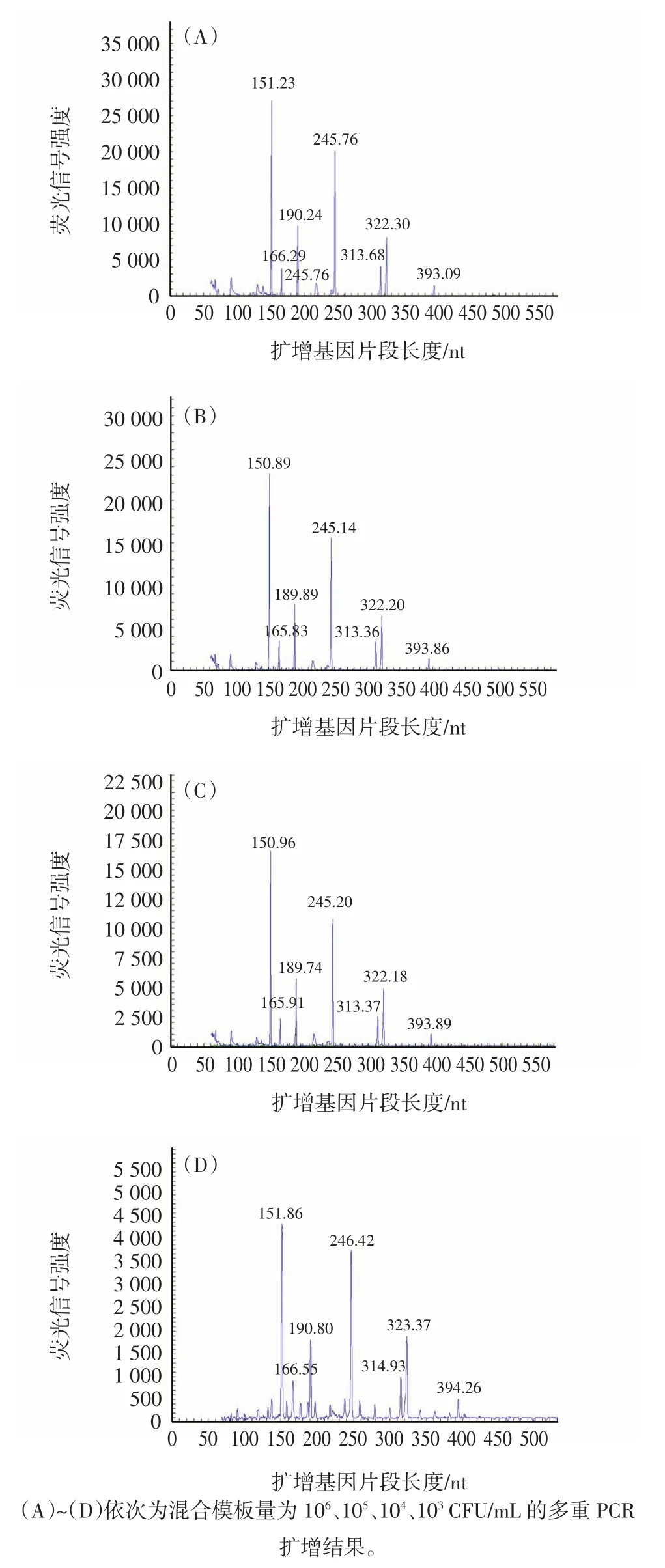
图2 多重PCR体系对混合模板灵敏性分析Fig.2 The sensitivity analysis of GeXP multiplex PCR system detection of mixed templates
结果表明,在103CFU/mL水平可以同时特异的检测出6种致病菌。每个浓度均在非同日重复3次,获得的结果相同(CV<10%)。
2.4 实际样本检测
53份肉类样品同时由SN/T 2641—2010和本研究建立的GeXP多重PCR法进行检测,结果对比如表2所示。
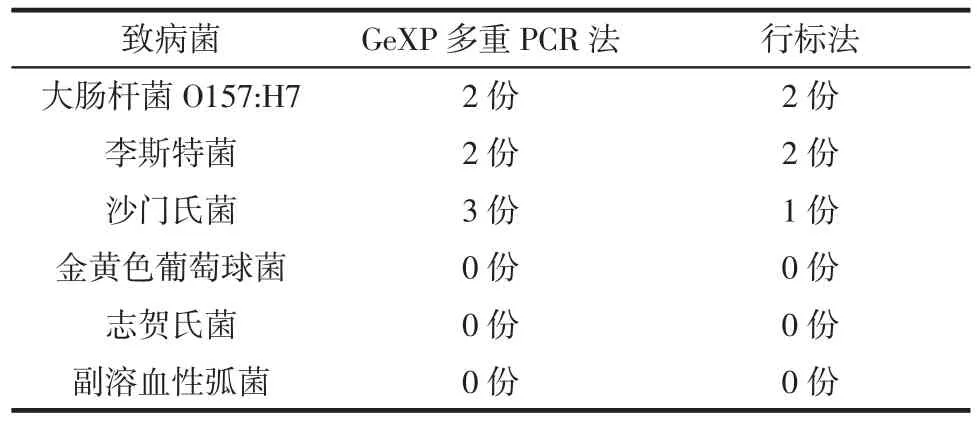
表2 随机样品中致病菌不同检测方法结果对比Table 2 The comparison results of different detection methods for pathogens in random samples
GeXP多重PCR法多检测出的2份沙门氏菌阳性产物进行测序,结果经BLAST比对与沙门氏菌的标准菌株同源性达99%;其他3种菌(金黄色葡萄球菌、志贺氏菌、副溶血性弧菌)GeXP多重PCR法检测均为阴性,经行标法检测结果也为阴性,两者一致。
3 结论与讨论
目前我国肉及肉制品中致病菌的检测方法主要是采用传统的选择性培养基分离培养,生化反应鉴定等方法,耗时费力,难以适应现代食品生产的检验需要,因此建立快速、准确、高效的检测方法有着非常重要的意义。近年来,由于多重PCR的高效性和经济简便,使得其越来越多地应用在食品致病菌检测领域,如双重PCR方法检测奇异变形杆菌与沙门氏菌,灵敏度分别为103CFU/mL和104CFU/mL;三重PCR技术快速检测禽肉制品中沙门氏菌、大肠杆菌和金黄色葡萄球菌,其灵敏度为102CFU/mL~103CFU/mL;多重PCR方法同时检测金黄色葡萄球菌、沙门氏菌、单增李斯特菌、副溶血性弧菌等致病菌,其灵敏度为103CFU/mL~104CFU/mL[10-12]。本研究建立的GeXP多重PCR法灵敏度与这些文献报道相似,但可同时检测6种致病菌,是基于一种新的基因表达谱定量分析平台[13],该平台将多重PCR和毛细管电泳技术相结合,采用通用引物和特异性引物相结合的方法,经多次优化后保持两者合适的比例以及各特异性引物的工作浓度比例,同时采用的三步法扩增温度(TSP法)及循环次数,使得整个体系扩增过程中由通用引物占据主导作用,有效降低因多重PCR的扩增偏爱性出现假阴性结果的概率[14];同时通过毛细管电泳直接显示产物片段长度,更直观简便判读检测结果。笔者已在前期工作中将该技术成功运用于人乳头瘤病毒[15]、食品中转基因成分[16]及细菌氨基糖苷类耐药基因[17]的检测。
本研究建立了一种特异性高和灵敏性好的可以单管同时检测肉及肉制品中6种常见致病菌的检测方法,检测限为103CFU/mL。但本方法也存在一些缺陷,毛细管电泳相对比较灵敏,故易出现交叉污染问题,因此要尽可能减少操作步骤及提高人员操作的稳定性;另外难以区分死菌和活菌造成的假阳性,如何消除死菌对检测结果的影响有待进一步研究。总之,该方法具有较强的实际应用价值,但仍需要大量实际样本的验证和进一步优化体系,希望进一步扩大检测通量,在食品安全监管领域有较强的实用推广应用价值。
