浸提时间对不同酒度枸杞浸提酒品质的影响
2021-07-21郭锦涛郝缙徐怀德李梅
郭锦涛,郝缙,徐怀德,李梅
(西北农林科技大学食品科学与工程学院,陕西杨凌712100)
枸杞(Lycium barbarum L.)是茄科枸杞属的一种,果实称枸杞子,是我国传统的药食兼用材料[1],含有多种活性物质,如黄酮、类胡萝卜素、多糖等[2],具有增强人体各项机理的功效,如滋补虚弱、益精气、去冷风、壮阳道、止泪、健腰脚等[3]。目前常见的枸杞深加工产品主要有枸杞果干、枸杞果汁和枸杞果酒等[4-5]。
枸杞浸提酒是将枸杞与白酒基酒按一定比例进行混合,在容器中浸泡一定时间,使枸杞内的生物活性成分浸入基酒中,制得的成品酒。枸杞浸提酒中含有如枸杞黄酮、枸杞多糖[6]、甜菜碱等多种活性成分。黄酮具有抗氧化[7]、改善血液循环[8]、降低血糖[9]等有益于人体的功能,是人体内不可或缺的一种功能性成分,适当地补充黄酮将会对人们的身体大有裨益。枸杞多糖构成成分有6种,分别为阿拉伯糖、葡萄糖、醋多糖、半乳糖、甘露糖、木糖和鼠李糖[10],在枸杞酒的功能中有着举足轻重的地位[11],具有医治不孕不育[12]、抗氧化[13-14]、延缓衰老[15]、抗肿瘤[16]、抗辐射[17]、降血糖[18]等多种功效。甜菜碱具有抗肿瘤、降血压、抗消化性溃疡及胃肠功能障碍等功能,还可用于治疗肝脏类疾病[19]。当甜菜碱作为饲料添加剂使用时,可以提供甲基供体[20]。
枸杞的浸提时间不同,其功效成分溶出程度不同,枸杞浸提酒的品质亦不同。因此枸杞在酒中的浸提时间是影响枸杞浸提酒品质的关键因素。本文比较了枸杞在不同酒度基酒浸提不同时间的品质变化规律(包括色泽、黄酮、多糖、甜菜碱及香气成分),以期获得不同酒度品质最佳的枸杞浸提酒。
1 材料与方法
1.1 材料与试剂
鲜枸杞(含水量 80%)、基酒(酒度 67% vol):青海兴诺杞业有限公司;乙醇、芦丁标准液、亚硝酸钠、硝酸铝、氢氧化钠、蒽酮试剂、浓硫酸、葡萄糖标准溶液、3,5-二硝基水杨酸、甲醇溶液、氨化甲醇、乙腈溶液(均为分析级试剂):国药集团试剂有限公司(上海)。
1.2 仪器与设备
JM-A5002电子天平:诸暨市超泽衡器设备有限公司;DGH-9070A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;UV-1780紫外可见分光光度计、LC-20A高效液相色谱仪:岛津仪器有限公司;GCMSQP2010 Ultra气相色谱质谱联用仪:日本岛津制作所。
1.3 方法
1.3.1 样品制备
将鲜枸杞与基酒按一定比例混合,得到酒度为42% vol、45% vol、53% vol的枸杞浸提酒,密封瓶盖。之后分别在枸杞浸泡 5、10、15、20、25 d 时进行取样,用于枸杞酒品质指标测定,并对样品按照酒度从低到高,浸提时间从短到长的顺序进行编号,依次命名为1号至15号,待测。
1.3.2 色泽测定
将样品按照酒度的不同分为3组,按照浸提时间从短到长的顺序依次对样品进行测定。色差仪先用标准黑白板校正,待自动校正完成之后,按下测试键,读出标准样的L*、a*、b*绝对值。用比色皿称取适量样品,放入色差仪内进行测定。记录该样品与标准样的色差值:dL*、da*、db*等。其余样品按照上述操作步骤重复操作[21]。
1.3.3 黄酮含量测定
芦丁溶液标准曲线制作[22]:称取10 mg芦丁标准品,用30%乙醇定容至50 mL,摇匀后制得0.2 mg/mL芦丁标准溶液。分别取 0、0.5、1.0、1.5、2.0、2.5、3.0、3.5 mL芦丁标准溶液于10 mL容量瓶内,加入0.3 mL质量浓度为5%的亚硝酸钠,摇匀之后静置6 min,再加入0.3 mL质量浓度为10%的硝酸铝,摇匀之后同样静置6 min,最后加入4 mL质量浓度4%的氢氧化钠,以30%乙醇定容至10 mL,摇匀后静置10 min,以不加芦丁的溶液为空白对照,在510 nm波长处测定吸光度。横坐标为吸光度值、纵坐标为芦丁浓度(mg/mL),得标准曲线:y=0.095 9x-0.001 1,R2=0.988 2。
样品含量测定:准确量取3 mL样品于10 mL容量瓶中,加入0.3 mL质量浓度为5%的亚硝酸钠,后续操作见标准曲线的绘制所述,根据标准曲线计算样品中黄酮的含量,结果以mg/mL表示。
1.3.4 多糖含量测定
1.3.4.1 总糖含量测定
总糖含量使用蒽酮-硫酸法进行测定[23]。
标准曲线制作:取0.2 g蒽酮,将其倒入100 mL体积分数为80%的硫酸中,制得蒽酮试剂[24]。准确称取烘干至恒重的葡萄糖50 mg,取水补至50 mL,量取10 mL移至100 mL容量瓶,定容即得0.1 mg/mL葡萄糖溶液。 分别吸取 0、0.1、0.2、0.3、0.4、0.5 mL 至试管,在冰浴条件下加入4 mL蒽酮试剂,加水定容至5 mL。沸水浴中煮沸10 min,冷却至25℃后在620 nm下测定吸光度。横坐标为吸光度值、纵坐标为葡萄糖浓度(mg/mL),得标准曲线:y=0.016 4x+0.000 2,R2=0.998 2。
样品总糖含量测定:准确量取1.0 mL样品至试管,在冰浴条件下加入4 mL蒽酮试剂,沸水浴中煮沸10 min,冷却至25℃后在620 nm下测定吸光度。根据标准曲线计算样品中总糖含量,结果以mg/mL表示。
1.3.4.2 还原糖含量测定
还原糖标准曲线制作[25]:准确称取1 g标准葡萄糖,将其加入到1 000 mL蒸馏水中,得到浓度为1 g/L的葡萄糖标准液。取7支25 mL刻度试管,按1号至7号编号,分别量取 0、0.2、0.4、0.6、0.8、1.0、1.2 mL 葡萄糖标准液至其中, 再分别加入 2.0、1.8、1.6、1.4、1.2、1.0、0.8 mL蒸馏水,之后每个试管内均加入1.5 mL 3,5-二硝基水杨酸试剂,摇匀之后在沸水浴的条件下加热5 min,取出之后立刻将其放入冷水中,待其冷却至25℃之后,再用蒸馏水定容至25 mL,充分摇匀。在540 nm波长下,用1号管作为参比调零,测定溶液的吸光度值[26]。横坐标为吸光度值、纵坐标为葡萄糖浓度(mg/mL),得标准曲线:y=0.0835x+0.0014,R2=0.9974。
样品还原糖含量测定:取25 mL刻度试管,准确量取2 mL稀释了100倍的样品和1.5 mL 3,5-二硝基水杨酸试剂,按照与制作标准曲线相同的方法操作。测定各管中溶液的吸光度值,根据标准曲线计算出还原糖含量[27]。
1.3.4.3 多糖含量测定

1.3.5 甜菜碱含量测定
枸杞甜菜碱含量测定[28]:称取10 mL样品于50 mL离心管中,以4 000 r/min离心4 min,过滤。吸取滤液5 mL,将其加入到已活化的Waters Oasis MCX固相萃取小柱中,需要同时控制自然流速,等待样液进入萃取小柱的吸附层后,依次使用5 mL 80%甲醇溶液、5 mL甲醇对其进行淋洗,最后用5 mL氨化甲醇进行洗脱,并重复洗脱一次[29]。将收集的洗脱液氮吹浓缩,使其接近干的状态,之后用2 mL乙腈溶液溶解定容,经0.45 μm滤膜过滤,待测定。
标准曲线制作:配制 0.000、0.039、0.078、0.156、0.312、0.625、1.250、2.500、5.000 mg/L 标准工作液,经0.45 μm滤膜过滤,取20 μL进行测定,外标法定量。以甜菜碱浓度x(mg/L)为横坐标,峰面积y为纵坐标绘制标准曲线,得标准曲线:y=2×106x+336 433,R2=0.979 1。
样品测定:色谱柱Atlantis HILIC(150 mm×4.6 mm,5 μm);流动相 乙腈-水;流速 1.0 mL/min;柱温 25 ℃;检测波长195 nm;进样体积20 μL。梯度洗脱条件如表1所示。

表1 梯度洗脱流动相配比Table 1 Gradient elution mobile phase ratio
1.3.6 香气成分测定
顶空固相微萃取[30]:准确称取5.0 g样品至15 mL顶空瓶中,加入1.00 g NaCl和800 μL 0.4 mg/mL环己酮,加盖密封。使用固相微萃取(solid-phase microextraction,SPME)萃取头(50/30 μm DVB/PDMS)在 40 ℃顶空萃取30 min,将萃取头插入气相色谱(gas chromatography,GC)仪进样口,解吸 5 min。
气相色谱条件:DB-LMS石英毛细柱(60 m×0.25 mm×0.25 mm);初始温度为40℃,保持该温度3 min,以4℃/min的速度上升到120℃,再以6℃/min的速度上升到240℃,保持该温度9 min。载气为氦气,进样口温度250℃,分流进样,分流比为10。
质谱条件:接口温度230℃;电子能量70 eV;放射电流150 μA;传输线温度280℃;离子源温度230℃;质子扫描范围35 aum~500 aum[31]。
1.4 数据处理与分析
采用Origin软件进行数据分析和绘图,每组试验均重复3次,结果以平均值表示。
2 结果与分析
2.1 浸提时间对不同酒度枸杞浸提酒色泽的影响
浸提时间对不同酒度枸杞浸提酒色泽的影响如图1所示。
dL*值反映样品的亮度变化,da*值反映样品的红/绿变化,db*值反映样品的黄/蓝变化。由图1(A)可知随着时间的延长,3种酒度的浸提酒dL*值先急剧下降,后呈平稳趋势,说明浸提酒的亮度先减小,后基本不变。由图1(B)、(C)可知随着时间的延长,da*值在5 d内迅速下降,10 d之后42% vol、45% vol酒da*值呈上升趋势,53% vol酒da*值呈下降趋势而db*值先快速上升后缓慢上升,说明浸提酒的颜色逐渐趋于红黄色,但在5 d~25 d内,浸提酒颜色变化不明显。枸杞浸提酒色泽的变化是因为随着浸提时间的延长,枸杞中的成分伴随着细胞的破裂溶解到酒中。
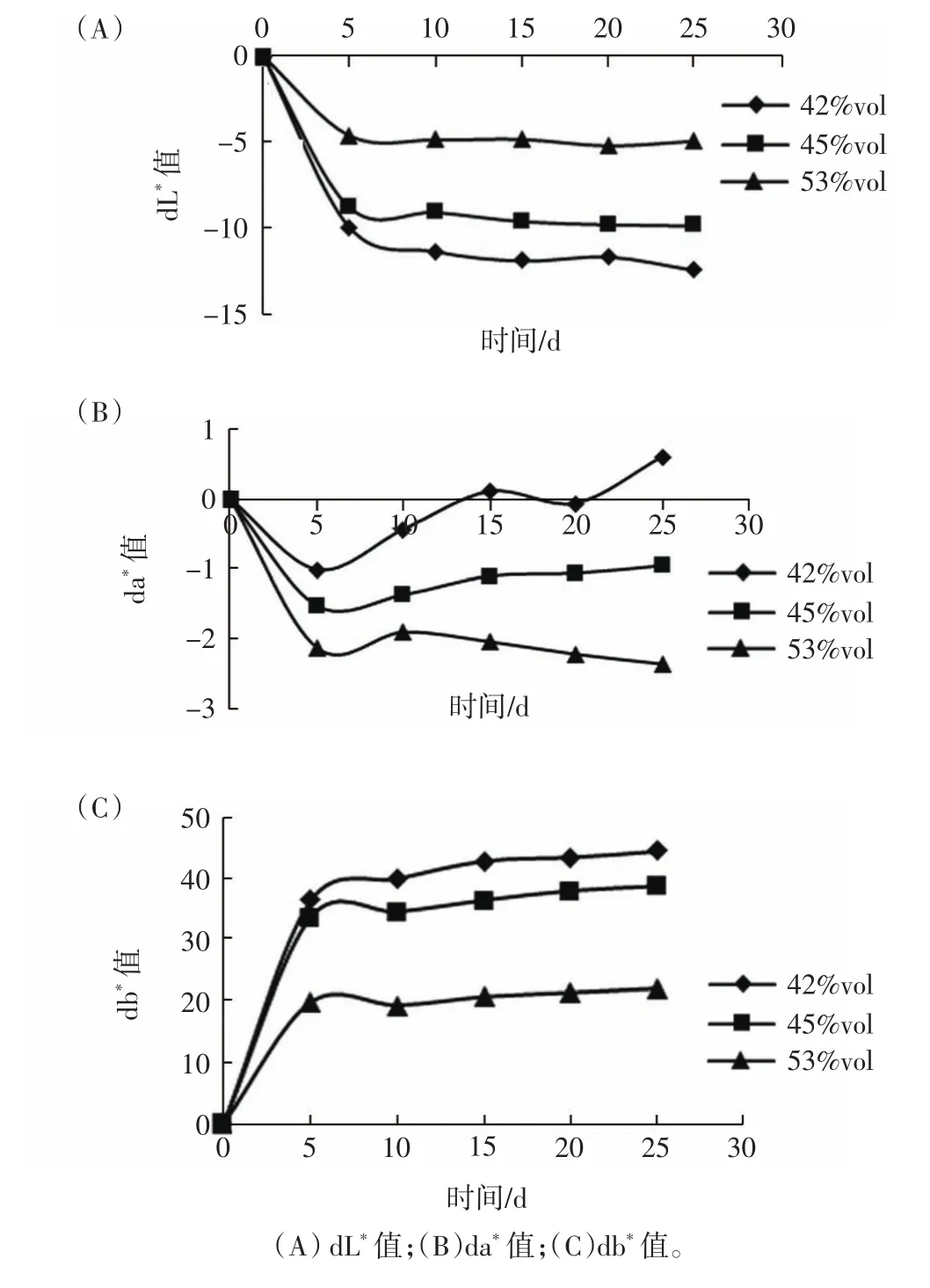
图1 不同酒度枸杞酒浸提不同时间的dL*、da*、db*值Fig.1 dL*,da*,db*value of Lycium barbarum wine with different degrees of alcohol extraction
2.2 浸提时间对不同酒度枸杞浸提酒黄酮含量的影响
浸提时间对不同酒度枸杞浸提酒黄酮含量的影响如表2所示。
由表2可知,42% vol和45% vol酒在浸提到第5天时黄酮含量达到最高,分别为0.051、0.049 mg/mL,之后随着浸提时间的延长含量基本不变,而53% vol酒在浸提到第15天时黄酮含量达到最高,最高含量为0.039 mg/mL。这是因为随着浸提时间的延长,黄酮的溶解量增加,最后含量基本保持不变。
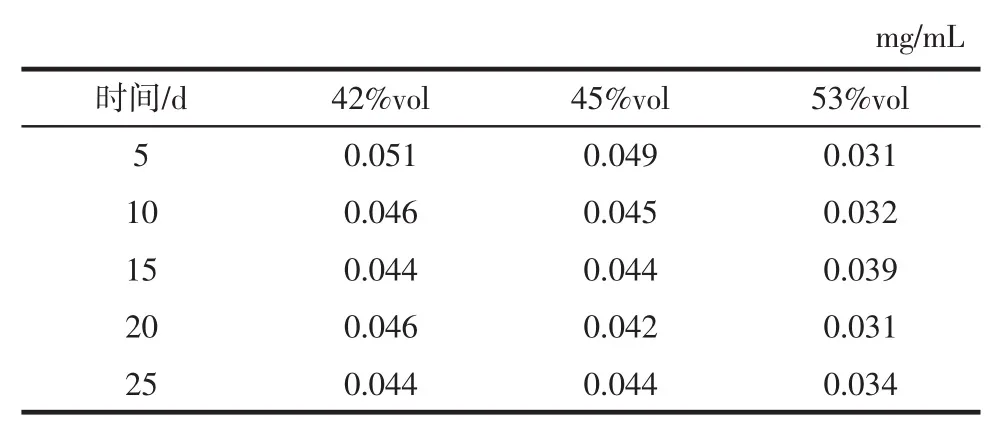
表2 不同酒度枸杞酒浸提不同时间的黄酮含量Table 2 Flavonoids content of Lycium barbarum wine with different degrees of alcohol extraction at different times
2.3 浸提时间对不同酒度枸杞浸提酒多糖含量的影响
浸提时间对不同酒度枸杞浸提酒多糖含量的影响如表3所示。
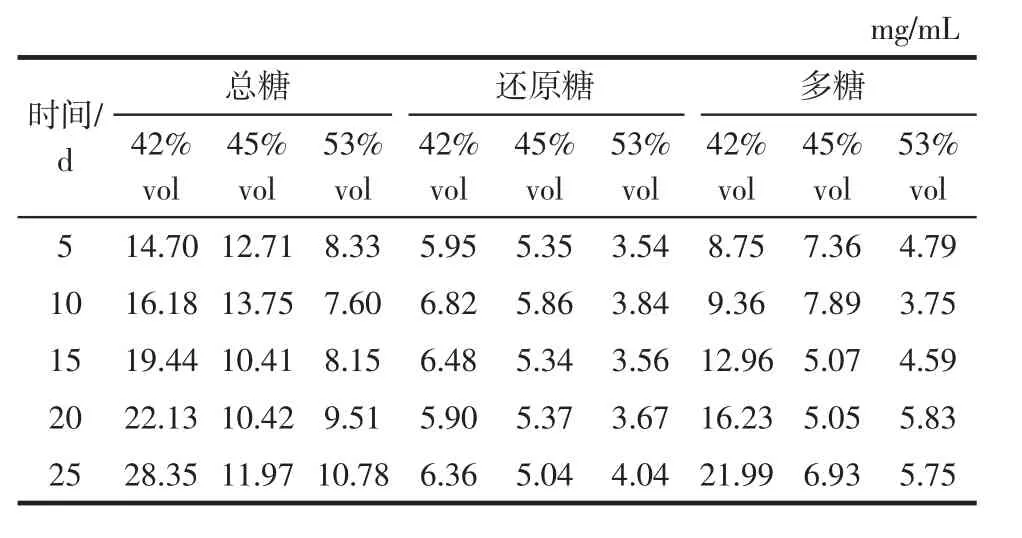
表3 不同酒度枸杞酒浸提不同时间的总糖、还原糖、多糖含量Table 3 The content of total sugar,reducing sugar and polysaccharide of Lycium barbarum wine with different degrees of alcohol extraction at different times
由表3可以看出42% vol枸杞酒中的枸杞多糖随着浸提时间的延长逐渐增加且增加量较为明显,从第5天的8.75 mg/mL增加到第25天的21.99 mg/mL,这可能是随着浸提时间的延长,加快了细胞的破裂,从而使多糖更好地溶解到水中,使枸杞多糖含量升高[32]。45% vol、53% vol枸杞酒中的枸杞多糖含量分别在第10天、第20天达到最大值7.89、5.83 mg/mL,而随着浸提时间的进一步延长,多糖含量稍有降低,这可能是多糖的结构发生变化,使多糖含量降低[32]。
2.4 浸提时间对不同酒度枸杞浸提酒甜菜碱含量的影响
浸提时间对不同酒度枸杞浸提酒甜菜碱含量的影响如表4所示。
由表4可知,42% vol酒中甜菜碱的含量随着浸提时间的增加而不断增大,在第25天有最大值1.904 mg/L,这可能是随着浸提时间增加,甜菜碱的溶出量不断升高,导致其含量逐渐升高。45% vol酒和53% vol酒中甜菜碱含量在第10天时分别达到最大值3.070、2.095mg/L,之后随着浸提时间的延长,甜菜碱含量逐渐下降。
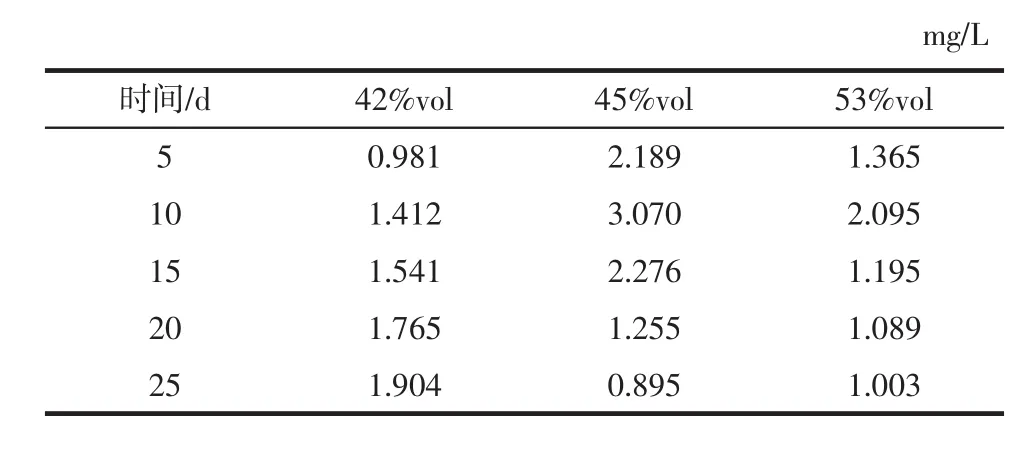
表4 不同酒度枸杞酒浸提不同时间的甜菜碱含量Table 4 Betaine content of Lycium barbarum wine with different degrees of alcohol extraction at different times
2.5 浸提时间对不同酒度枸杞浸提酒香气成分的影响
浸提时间对不同酒度枸杞浸提酒香气成分的影响如表5所示。
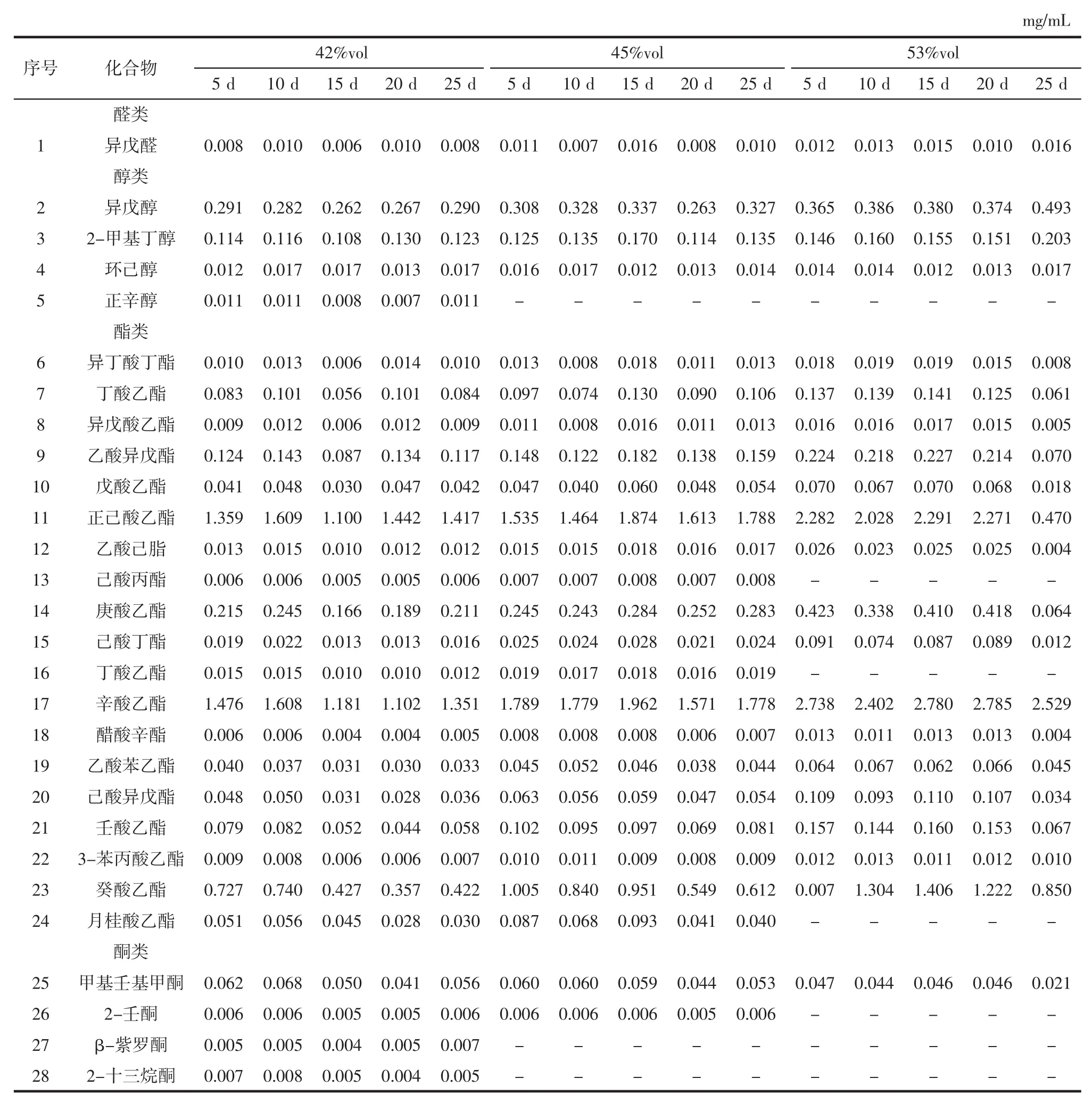
表5 不同酒度枸杞酒浸提不同时间的香气成分含量Table 5 The content of aroma components of Lycium barbarum wine with different degrees of alcohol extraction at different times
由表5可知,42% vol浸提酒共检测出28种香气成分,包括1种醛类,4种醇类,19种酯类,4种酮类,其中典型香气成分为辛酸乙酯,其含量在第10天时达到最大值即1.608 mg/mL;45% vol浸提酒共检测出25种香气成分,包括1种醛类,3种醇类,19种酯类,2种酮类,典型香气成分也为辛酸乙酯,其含量在第15天时达到最大值即1.962 mg/mL;53% vol浸提酒共检测出21种香气成分,包括1种醛类,3种醇类,16种酯类,1种酮类,典型香气成分同样为辛酸乙酯,其含量在第20天时达到最大值即2.785 mg/mL。
3 结论
不同酒度枸杞浸提酒在5 d~25 d内,色泽变化不是非常明显,即在任意一个浸提时间,浸提酒的色泽都可以被接受。3种酒度枸杞浸提酒在25 d内黄酮含量变化很小,42% vol和45% vol酒的黄酮含量在第5天达到最大值,53% vol酒的黄酮含量在15 d达到最大值。对于枸杞多糖的研究表明,42% vol酒中的枸杞多糖随着浸提时间的增加呈上升趋势,在第25天达到最大值,45% vol、53% vol酒的枸杞多糖含量分别在第10天、第15天达到最大值。对于甜菜碱含量来说,42% vol酒中甜菜碱的含量随着浸提时间增长不断升高,在第25天有最大值,而45% vol酒和53% vol酒中甜菜碱含量在第10天时达到最大值。此外,对3种酒度枸杞浸提酒的香气成分研究表明,典型香气成分均为辛酸乙酯,且 42% vol、45% vol、53% vol酒中辛酸乙酯的含量分别在第10、15、20天达到最大值。综合考虑得出42% vol枸杞浸提酒的枸杞最佳浸提时间为10 d,45% vol枸杞浸提酒的枸杞最佳浸提时间为10 d,53% vol枸杞浸提酒的枸杞最佳浸提时间为20 d。本研究为不同酒度枸杞浸提酒的开发提供了一定的理论参考。
