滁菊多酚氧化酶和过氧化物酶热钝化动力学研究
2021-07-21苗文娟何鑫夏玥杨东东孙昱韦海阳
苗文娟,何鑫,夏玥,杨东东,孙昱,韦海阳
(1.滁州学院生物与食品工程学院,安徽滁州239000;2.安徽启慧信息科技有限公司,安徽滁州239000)
滁菊又名“甘菊”、“白菊”,产于安徽省滁州市,素有“金心玉瓣、翠蒂天香”之美誉,是中国“四大名菊”之一[1]。滁菊富含黄酮、酚类、挥发油、氨基酸类及多糖等营养成分,具有抗肿瘤、抗炎、抑菌、抗病毒、抗氧化、调节机体免疫力等多种药理作用[2-6]。
新鲜采摘的滁菊新陈代谢活跃,极易腐败变色,有研究表明引起植物褐变的主要原因是酶促褐变和非酶褐变,其中多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)在酶促褐变过程中发挥主要作用[7]。褐变不仅改变了滁菊的颜色,而且还破坏了滁菊的风味和活性成分,严重限制了滁菊的加工利用。因此,有必要对滁菊中的PPO和POD酶学特性和钝化动力学进行分析,为滁菊的精准杀青工艺开发提供理论基础。
一级钝化动力学是最常用的钝酶、杀菌过程的描述方法[8]。在热钝酶理论研究中,多名研究者采用一级反应动力学研究酶钝化情况[9-11],KUBO等[12]研究了微波处理过程中温度和POD酶活性的变化情况,测定了钝酶反应的D值和Z值,表明一级钝化动力学可以很好地预测POD酶在微波处理过程中的活性变化情况。吴倩等[13]对橄榄PPO和POD的热失活动力学研究表明,高温处理能有效地钝化橄榄PPO和POD,且高温处理对橄榄PPO和POD的钝化过程符合两段模型,提高处理温度和延长处理时间能显著提高橄榄PPO和POD的钝化速率。杨明冠等[14]通过对苹果PPO进行超声钝化动力学研究,发现随着超声处理功率的提高和时间延长,苹果PPO的热敏感性降低,k值上升,D值下降,苹果PPO的钝化符合一级反应动力学模型。而关于滁菊PPO和POD的热钝化动力学研究尚未明确,因此对滁菊中酶热钝化动力学进行的研究,可为滁菊采摘后杀青过程中控制酶促褐变反应及提升滁菊品质提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
滁菊:2019年10月采自滁州市金玉滁菊生态科技有限公司种植基地;邻苯二酚(分析纯):阿拉丁试剂有限公司;愈创木酚(化学纯):国药集团化学试剂有限公司。
1.2 仪器与设备
L3S紫外可见分光光度计:上海仪电分析仪器有限公司;TGL-16M高速台式冷冻离心机:湖南湘仪实验室仪器开发有限公司;DF101S集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;PHS-3C pH计:上海越平科学仪器有限公司;BSA124S-CW电子分析天平:赛多利斯科学仪器有限公司。
1.3 方法
1.3.1 滁菊PPO粗酶液提取
称取新鲜滁菊10 g置于研钵中,加入适量石英砂,加入30 mL预冷的0.1 mol/L、pH6.5磷酸盐缓冲液,快速研磨后用绢布过滤,滤渣重新加入pH6.5磷酸盐缓冲液,重复上述操作,合并两次滤液于4℃、9 000 r/min条件下离心15 min,上清液转入100 mL容量瓶并定容即得PPO粗酶液。
1.3.2 滁菊POD粗酶液提取
称取新鲜滁菊10 g置于研钵中,加入适量石英砂,加入30 mL预冷的0.1 mol/L、pH6.0磷酸盐缓冲液,快速研磨后用绢布过滤,滤渣重新加入pH6.0磷酸盐缓冲液,重复上述操作,合并两次滤液于4℃、9 000 r/min条件下离心15 min,上清液转入100 mL容量瓶并定容即得POD粗酶液。
1.3.3 PPO酶活的测定
参照何军忠等[15]方法并加以修改:取2.0 mL磷酸盐缓冲液(0.1 mol/L,pH6.5)于比色皿中,加入 0.3 mL邻苯二酚底物溶液(0.35 mol/L),加入0.2 mL PPO酶提取液后迅速混匀,立即放入分光光度计于420 nm处测定吸光值(动力学测量模式),从0 s开始每20 s读数1次,计时1 min。每组平行测定3次并作空白对照。滁菊PPO酶活力定义为每分钟每克滁菊鲜样吸光值增加0.01为一个酶活力单位(U)。
1.3.4 POD酶活测定
参照宋丽军等[16]方法并加以修改:分别取配好的1 mL愈创木酚溶液(0.090 mol/L)和1 mL过氧化氢溶液(0.010 mol/L)于比色皿中,再加入0.15 mL粗酶液迅速混合均匀,以空白组作为对照,检测A470nm处的吸光度变化(动力学测量模式)。从0 s开始每20 s读数1次,计时1 min。以每分钟每克滁菊鲜样吸光度变化0.01为1个酶活力单位(U)。
1.3.5 滁菊PPO和POD最适温度的测定
分别取适量磷酸盐缓冲液和底物溶液置于试管中,在相应温度下水浴保温,按照1.3.3和1.3.4方法测定PPO和POD酶活力,考察温度对滁菊PPO和POD活性的影响。
1.3.6 滁菊PPO和POD热稳定性的测定
分别取5 mL滁菊PPO和POD粗酶液置于试管中,在50℃~100℃的水浴加热磁力搅拌器中进行热稳定性试验,采用磁力搅拌以保证水浴加热过程中样品受热的均匀性。各个温度下加热保温时间见表1。加热结束后立即取出样品置于冰水浴中,冷却至室温(25℃±5℃)后测定酶活,对照样为室温放置的PPO和POD酶溶液。采用残存酶活表示热处理前后PPO和POD酶活的变化。
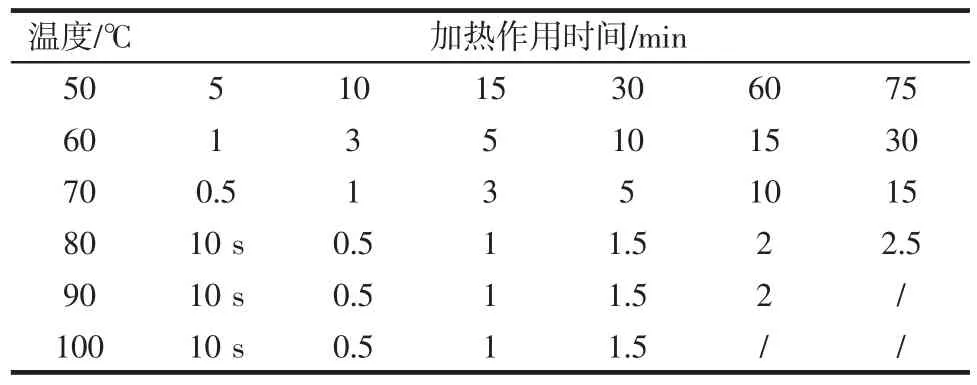
表1 滁菊PPO和POD热稳定性测定条件设置Table 1 Condition setting for the thermostability measurement of Chuju PPO and POD
1.3.7 动力学分析
参考XU等[17]与LING等[18]采用一级动力学描述一个特定的食品体系中酶的热失活。
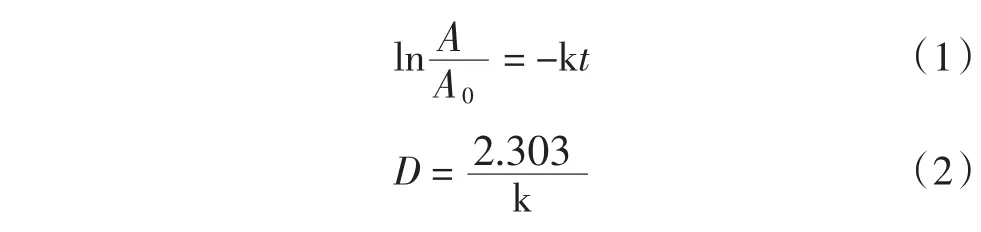
式中:t为热处理时间,min;A为t时刻的样品酶活;A0为初始酶活;k为失活速率常数,min-1;D为指数递减时间,min。
酶对温度的敏感性可以用Ea(J/mol)来表示,Ea可从失活速率常数的自然对数ln(k)与温度的倒数1/T(T为绝对温度)作图所得回归曲线的斜率中求出[17]。
1.4 数据处理
所有试验数据均重复3次,数据采用Excel 2007进行数据处理,用平均值±标准差的方式描述,采用Origin 2020软件绘图。
2 结果与分析
2.1 滁菊PPO和POD最适温度
温度对滁菊PPO和POD酶活性的影响结果见图1。
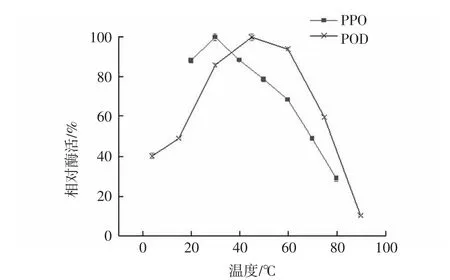
图1 温度对滁菊PPO和POD酶活性的影响Fig.1 The effect of temperature on PPO and POD activities of Chuju
由图1可见,滁菊PPO和POD的酶活性均随着温度的升高先上升再下降,但二者趋势线有一定差别。滁菊PPO的最适反应温度为30℃,同时在较低的温度范围内(40℃~60℃)酶活即开始下降。滁菊POD的最适反应温度是45℃,POD在30℃~60℃相对酶活力均可保持在85%以上。亳菊[19]PPO的最适反应温度是25℃,POD的最适反应温度是30℃~35℃[20],橄榄[21]中PPO最适反应温度60℃,POD最适反应温度40℃,由此可以看出不同来源的原材料中的PPO和POD酶学特性有较大差异。因此,在后期试验过程中选择在50℃以上温度对滁菊PPO和POD进行进一步热处理,并进行详细的动力学研究。
2.2 滁菊PPO和POD热稳定性分析
滁菊PPO和POD粗酶液分别在50℃~100℃处理一定时间后,残存酶活试验数据如表2所示。
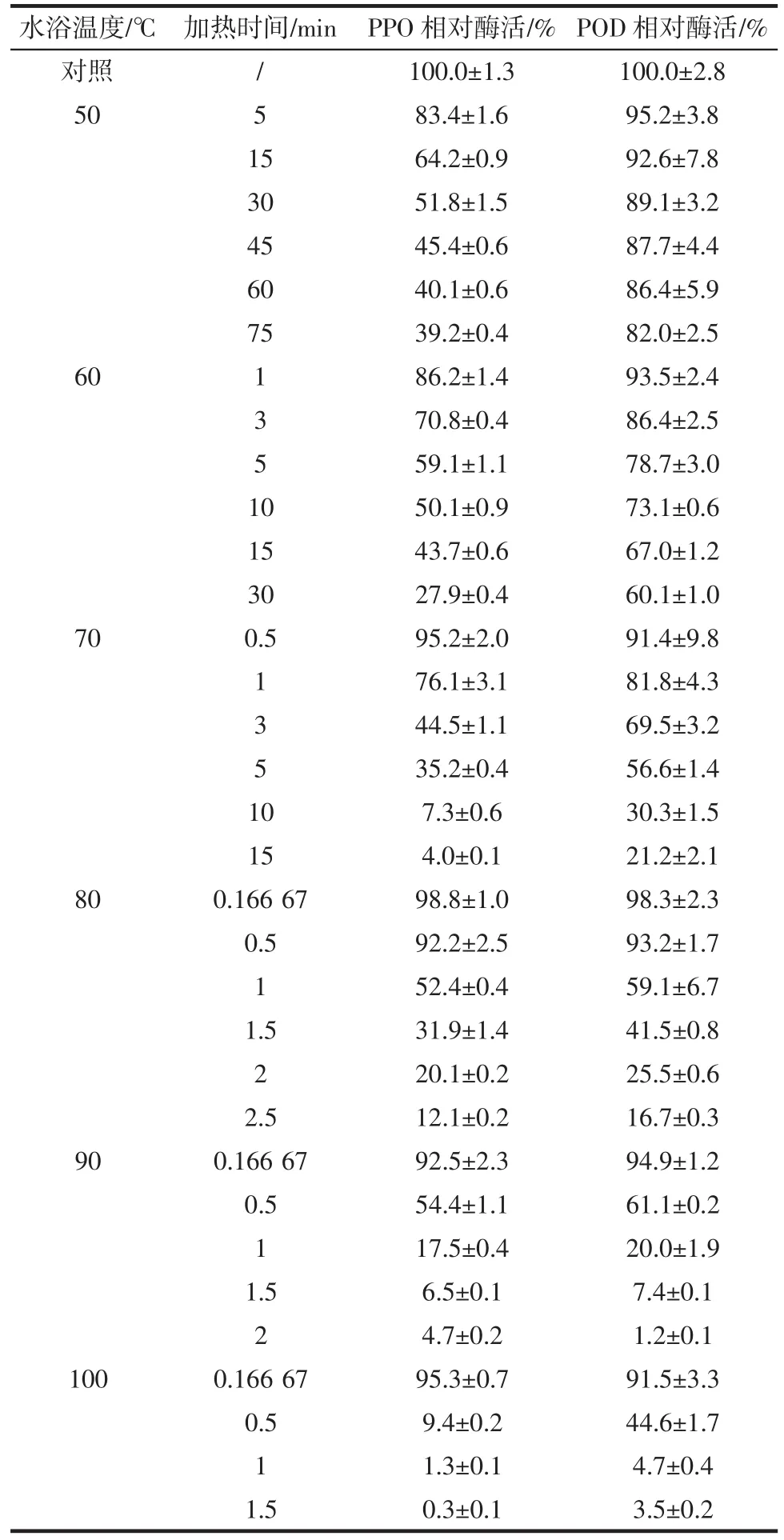
表2 热处理后PPO和POD相对酶活变化Table 2 The relative activity change of PPO and POD after heat processing
PPO和POD酶活随着加热时间的增加而降低,并且受到温度的显著影响。当PPO和POD在较低的温度下处理时,酶活下降速率慢,随着温度升高,酶活下降速率增大。结果表明,加热时间和温度对PPO和POD失活有显著影响。但需注意的是,在较低温度下,如50℃,即使处理60 min后PPO仍残存40.1%酶活,POD仍残存86.4%酶活,处理75 min后二者酶活仍未显著下降,表明在较低温度下延长处理时间对酶的钝化效果不显著。
同时,由表2对比分析可见,滁菊PPO和POD对温度的敏感性不同。在50℃处理30 min后PPO和POD的酶活分别降至初始值的51.8%和89.1%;60℃处理30 min后PPO和POD的酶活分别降至27.9%和60.1%;70℃处理1 min后PPO和POD的酶活分别降至76.1%和81.8%;80℃处理1 min后PPO和POD的酶活分别降至52.4%和59.1%,90℃处理1 min后PPO和POD的酶活分别降至17.5%和20.0%,100℃处理1 min后PPO和POD的酶活分别降至1.3%和4.7%,滁菊PPO对温度的敏感性高于POD。
2.3 滁菊PPO和POD的热失活动力学分析
2.3.1 热处理对滁菊PPO和POD的k值和D值影响
基于滁菊PPO和POD热稳定性数据,设计试验研究了PPO和POD在50℃~100℃下的详细热失活动力学。以加热时间为横坐标,ln(A/A0)为纵坐标作图,图2和图3分别是不同温度下加热后PPO和POD失活一级动力学变化情况。
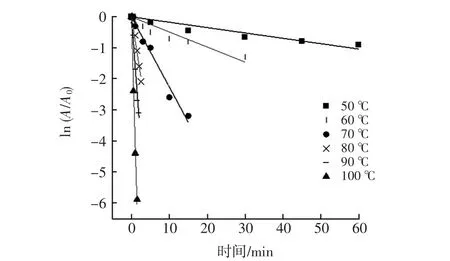
图2 滁菊PPO的一级钝化动力学拟合结果Fig.2 Fitting result of firs order inactivation kinetics of PPO in Chuju
由图2和图3可见,PPO和POD热失活线性拟合结果较好,说明PPO和POD的热钝化符合一级反应动力学,这与CAO等[22]对蓝莓汁中PPO和POD的热钝化动力学研究结果一致。同时滁菊PPO和POD拟合后的直线斜率均随着温度的增加而增加,说明升高温度会增强对PPO和POD酶活性的钝化效果。滁菊PPO钝化的拟合R2范围在0.810 2~0.981 5,POD钝化的拟合R2范围在0.701 4~0.985 9。
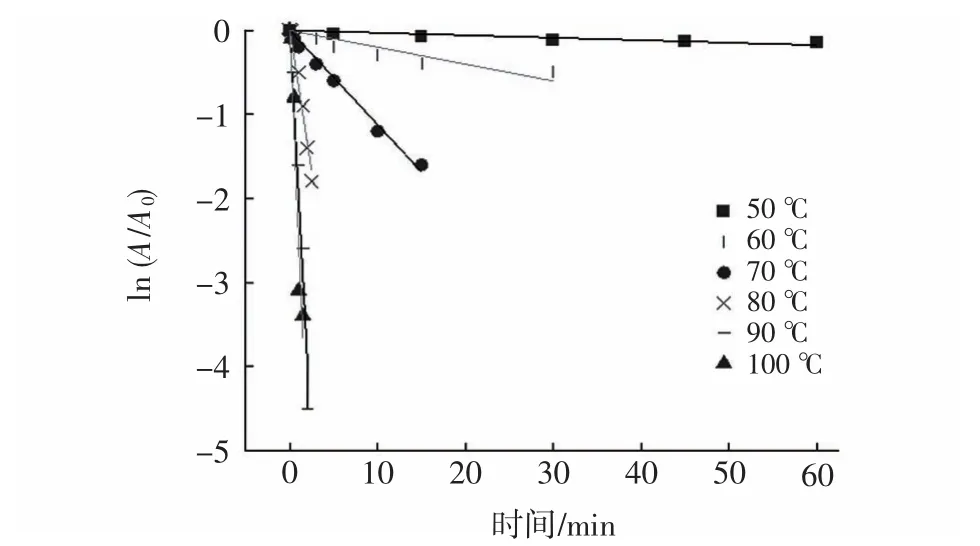
图3 滁菊POD的一级钝化动力学拟合结果Fig.3 Fitting result of first order inactivation kinetics of POD in Chuju
酶的失活反应速率常数k可以从相对酶活的自然对数ln(A/A0)与时间t作图所得的回归线斜率中求得[23]。根据图2、图3的拟合数据和公式1、公式2可以计算得到滁菊PPO和POD酶的热钝化动力学参数k值和D值,D值指的是在一定条件下钝化90%酶活所需的时间[24],D值可以反映酶对温度的敏感程度,D值越高,酶对温度敏感性越低,相同温度下钝化效果越差,具体数据如表3所示。
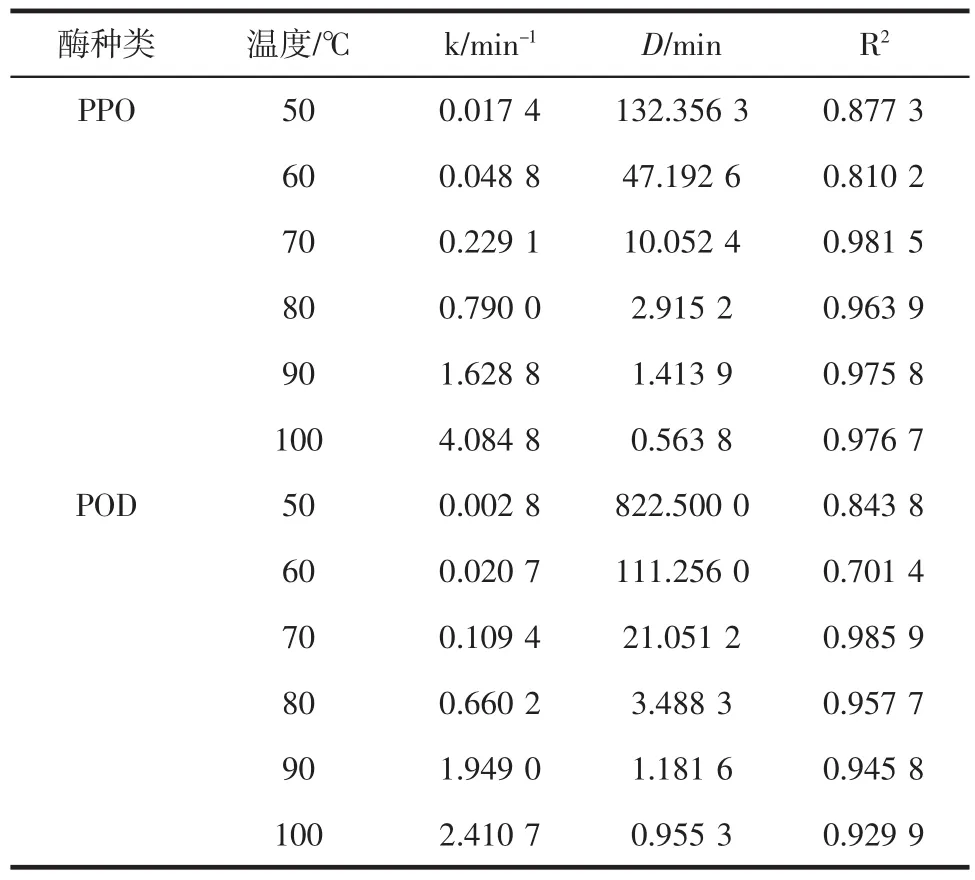
表3 滁菊PPO和POD一级热钝化动力学参数Table 3 Kinetic parameters of thermal inactivation of PPO and POD in Chuju
由表3可见,PPO和POD的k值随着温度的增加而增加,D值随着温度的增加而减小,说明升高温度会增强PPO和POD的钝化效果。
从各个温度下PPO和POD的D值变化,可以更容易发现两种酶对温度的敏感性差异,在相同温度下比如在60℃时,PPO的D值为47.192 6 min,POD的D值为111.256 0 min,而温度上升到70℃时,PPO的D值为 10.052 4 min,POD的 D值为 21.051 2 min,在100℃时,PPO的D值为 0.563 8 min,POD的D值为0.9553min,由此表明滁菊PPO较POD容易钝化。
2.3.2 热处理对滁菊PPO和POD酶的Ea值影响
滁菊PPO和POD的Ea拟合曲线见图4。
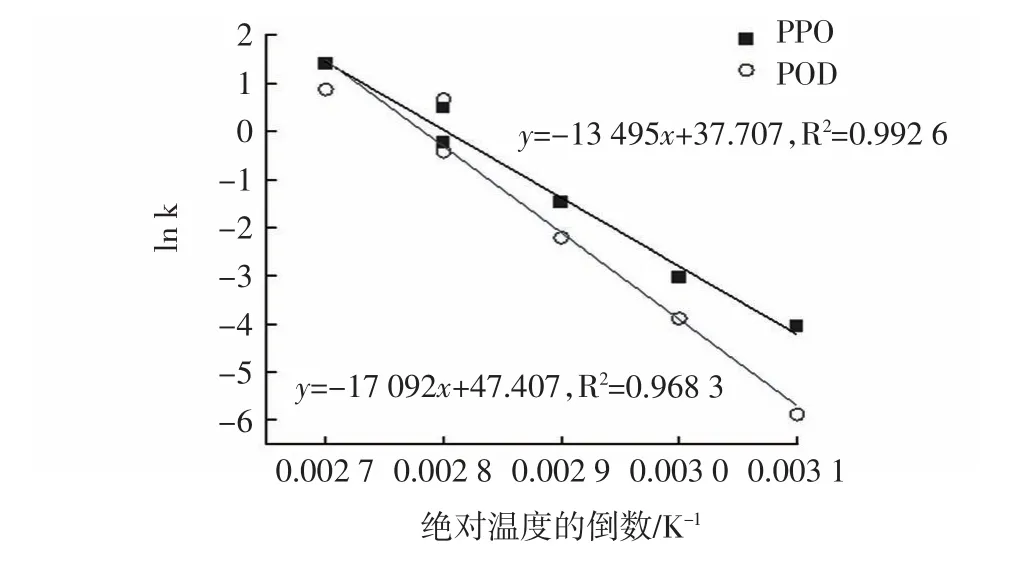
图4 滁菊PPO和POD的Ea拟合曲线Fig.4 Ea fitting curve of chuju PPO and POD
反应活化能Ea可通过Arrhenius方程求得,常用来评价反应温度对酶失活速率常数k的影响。Ea越小,代表反应速率越快。图4表明PPO和POD的ln k与温度的倒数之间具有良好的相关性,R2均在0.96以上。由其斜率求得热处理钝化PPO和POD的Ea分别为 13.495 kJ/mol和17.092 kJ/mol,即需要 13.459 kJ的能量才能将1 mol的PPO分子钝化,需要17.092 kJ的能量才能将1 mol的POD分子钝化。从活化能的数据也可以说明滁菊PPO较POD对温度更敏感,在热处理过程中更易失活。
通常认为Ea<40 kJ/mol时,则该反应的反应速率非常大[25]。因此,由上述数据可知高温下滁菊中PPO和POD虽反应活化能有一定差异,但均属于易于高温失活的酶,因此,对滁菊进行高温处理可有效钝酶。
3 结论
热处理对新鲜滁菊PPO和POD的钝化有显著效果,随着热处理温度的提高、热处理时间的增加,钝酶效果越好,当温度大于80℃对滁菊PPO和POD的热钝化效果较好,低温长时对降低PPO和POD酶的活性效果不佳。
通过对滁菊PPO和POD的热钝化动力学分析,确定了这两种酶的热失活动力学参数。动力学分析数据表明,在50℃~100℃的等温热处理过程中,滁菊PPO和POD的热失活符合一级动力学模型,随着处理温度的上升,滁菊PPO和POD钝化的k值逐渐增加,D值逐渐降低,滁菊PPO一级钝化模型线性拟合系数均在0.8以上,Ea=13.495 kJ/mol;滁菊POD一级钝化模型线性拟合系数均在0.7以上,Ea=17.092 kJ/mol;与滁菊POD相比,滁菊PPO的热稳定性较差,该结果为滁菊中PPO和POD酶的热钝化提供理论依据,也为滁菊杀青工艺研究提供了参考。
