香椿老叶黄酮含量及抗氧化性研究
2021-07-21李晨晨
李晨晨
(天津科技大学食品科学与工程学院,天津300457)
香椿又叫香椿头,为楝科,香椿属,是一种多年生落叶乔木,历史悠久,在我国的多个省份都有分布[1],叶子不易生虫,具有特殊的香气[2-3],其营养素含量在蔬菜中位于首列[4],是当今较为理想的绿色食品之一。香椿具有抗氧化、防衰老、抑菌、清热解毒、消炎化瘀、解除痉挛等多种生理功效[5-7]。目前香椿市场前景广泛,种植香椿的农户越来越多,但是人们利用的大多是香椿嫩芽、嫩叶、香椿木等部位,对于香椿老叶等副产品总是作废弃处理,造成了大量的资源浪费。一些研究结果表明,香椿老叶中含有一定量的黄酮类物质[8],这种物质具有很高的应用价值,首先黄酮可以有效清除体内的自由基,具有抗氧化、抗衰老等作用,常常应用于化妆品领域,深受消费者喜爱;其次,黄酮类化合物还具有降血糖[9]、降低胆固醇的功效,能够促进血液循环,对肿瘤[10-11]、心脑血管的发病率具有很好的抑制作用,除此之外,黄酮还可以提高机体免疫功能[12-13],抑制细菌增长[14],有效止痛、促进伤口愈合等。因此,香椿老叶的开发和利用具有一定的应用意义。
1 材料与方法
1.1 材料与试剂
安徽太和黑油椿、山东临朐香椿、河南焦作香椿、安徽太和青油椿、山东烟台西牟红椿的老叶:采集于天津科技大学种植基地;无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、过硫酸钾、抗坏血酸(均为分析纯):天津北方天医化学试剂厂;DPPH、ABTS:梯希爱(上海)化成工业发展有限公司;芦丁标准品(纯度为99.9%):上海时代生物科技有限公司。
1.2 仪器与设备
粉碎机(HK-02A):广州旭朗机械设备有限公司;电子天平(ESJ205-4):沈阳龙腾电子称量仪器有限公司;紫外可见分光光度计(SP-2102UV):上海光谱仪器有限公司;超声波清洗仪(KQ-400KDB):沈阳龙腾电子称量仪器有限公司;台式离心机(TDL-5-A):上海安亭科学仪器厂;电热恒温水浴锅(HWS26):上海一恒科技有限公司。
1.3 试验方法
1.3.1 黄酮提取液制备
取香椿老叶作为样品材料,晒干,粉碎机粉碎;取1 g香椿老叶粉末与一定体积分数的乙醇混合,超声一定时间,同时设置一定的温度;将上述溶液在4 800 r/min的离心机中离心20 min,离心完毕后,将上清液置于100 mL容量瓶中待用;滤渣再加入一定量的乙醇,同样用超声波进行辅助提取,重复上述步骤,合并两次滤液,用一定体积分数的乙醇稀释至容量瓶刻度,得到黄酮提取液[15]。
1.3.2 黄酮标准曲线的绘制
参照赵艳霞等[16]制作黄酮标准曲线的方法并作些许改动,准确称量10 mg芦丁标准品,将其放入100 mL容量瓶中,用60%的乙醇溶液溶解并进行定容,最终得到0.1 mg/mL的芦丁标准液;准备11个10 mL的容量瓶, 分别吸取 0、0.5、1、1.5、2、2.5、3、3.5、4、4.5、5 mL的芦丁标准液于10mL容量瓶中;分别加入1 mL 10 g/L亚硝酸钠溶液,摇匀,静置6 min,加入1 mL 20 g/L硝酸铝溶液,摇匀,静置6 min,加入2 mL 4 g/L氢氧化钠溶液,用60%乙醇定容,摇匀,静置12 min;以不添加芦丁标准液的试剂作为空白对照,在510 nm处测定不同溶液的吸光度;最后以芦丁溶液浓度作为横坐标,吸光度作为纵坐标,绘制黄酮的标准曲线。
1.3.3 黄酮含量测定及提取率计算
用移液枪吸取1 mL黄酮提取液置于10 mL容量瓶中,按照1.3.2方法步骤进行操作,最后对香椿老叶中黄酮的提取率进行计算。

式中:W为回归方程中对应的芦丁浓度,mg/mL;V为溶液反应的体积,mL;X为黄酮提取液总体积,mL;m为称取的香椿老叶粉末的质量,g。
1.3.4 单因素试验
参照刘玉梅等[17]的方法设置4个因素,乙醇体积分数 40%、50%、60%、70%,料液比 1∶20、1∶25、1∶30、1∶35(g/mL),超声温度 40、50、60、70 ℃,超声时间 30、40、50、60 min,分别按各因素不同梯度进行单因素试验,考察不同因素对黄酮提取率的影响。
1.3.5 正交试验
参照李思阳等[18]的方法选择单因素试验中的4个因素3个水平,以黄酮提取率为指标进行正交试验,每组试验3个重复,最后取平均值作为最终结果,试验因素水平见表1。

表1 L9(34)正交试验因素水平Table 1L9(34)orthogonal test factor and level
1.3.6 不同时期、不同品种香椿老叶黄酮含量比较
分别取不同时期(10月、11月、12月)、不同品种的香椿老叶(黑油椿、青油椿、临朐香椿、西牟红椿、焦作香椿)晒干,粉碎机粉碎。分别称取1 g香椿老叶粉末于锥形瓶中,根据单因素和正交试验得出的最佳提取条件进行提取,再将提取液于4 800 r/min离心20 min,将上清液置于100 mL容量瓶中,滤渣重复上述操作,合并两次上清液,并分别用60%的乙醇溶液定容至容量瓶刻度线,得到黄酮提取液。取1 mL提取液,按照制作黄酮标准曲线的操作步骤,分别测定不同品种香椿老叶的黄酮含量,并进行比较。
1.3.7 抗氧化活性测定
DPPH自由基清除率测定:参照王晓敏等[19]方法,首先吸取1.5 mL不同浓度的黄酮提取液(0.05、0.10、0.15、0.20、0.25 mg/mL)于试管中,向上述 10 个试管中分别加入1.5 mL浓度为0.1 mg/mL的DPPH溶液,于25℃避光反应30 min,最后用分光光度计于517 nm处测定溶液吸光度。阳性对照选取VC溶液。

式中:A0为蒸馏水+DPPH溶液的吸光度;A1为黄酮提取液+DPPH溶液的吸光度;A2为蒸馏水+黄酮提取液的吸光度。
ABTS+自由基清除率测定:参照李培源等[20]的方法,分别量取 1.5 mL 浓度分别为 0.1、0.5、1.0、1.5、2.0 mg/mL的黄酮提取液于试管中,取1.5 mL的ABTS溶液加入到上述溶液中,25℃避光反应6 min,于波长734 nm下测定其吸光度,其中对照溶液为1.5 mL黄酮提取液和1.5 mL ABTS溶液,空白溶液为1.5 mL蒸馏水和1.5 mL ABTS溶液。
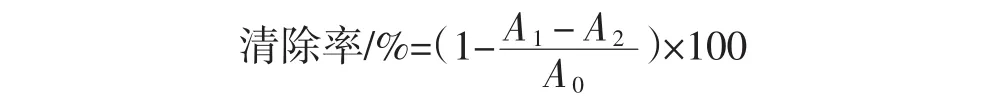
式中:A0为蒸馏水+ABTS溶液的吸光度;A1为黄酮提取液+ABTS溶液的吸光度;A2为黄酮提取液+蒸馏水的吸光度。
2 结果与分析
2.1 黄酮标准曲线
黄酮标准曲线见图1。

图1 黄酮标准曲线Fig.1 Standard curve of flavonoids
回归方程为y=10.033x-0.018 8,R2=0.994 8,根据回归方程计算香椿老叶的黄酮含量。
2.2 单因素试验结果
2.2.1 乙醇体积分数对黄酮提取率的影响
乙醇体积分数对黄酮提取率的影响见图2。
由图2可看出,当乙醇体积分数为40%~60%时,黄酮提取率随乙醇体积分数的增加而增大,在乙醇体积分数为60%时提取率达到最高,当乙醇体积分数超过60%后,提取率降低,这可能是由于过高体积分数的乙醇溶解出了香椿老叶内的其它物质,影响了黄酮的显色反应[21],因此,选择乙醇体积分数60%为最佳。

图2 乙醇体积分数对黄酮提取率的影响Fig.2 Effect of ethanol volume fraction on the extraction rate of flavonoids
2.2.2 料液比对黄酮提取率的影响
料液比对黄酮提取率的影响见图3。

图3 料液比对黄酮提取率的影响Fig.3 Influence of solid-liquid ratio on the extraction rate of flavonoids
由图3可看出,黄酮提取率在料液比为1∶20(g/mL)~1∶35(g/mL)范围内随溶剂体积增大而增大,但是在1∶30(g/mL)~1∶35(g/mL)范围内增长不明显,因此在节约试剂的原则下,选择料液比1∶30(g/mL)为最佳。
2.2.3 超声温度对黄酮提取率的影响
超声温度对黄酮提取率的影响见图4。
由图4可看出,当超声温度为40℃~50℃时,黄酮提取率随温度的升高而增大,在温度为50℃时提取率达到最高,当超声温度高于50℃时,黄酮提取率反而降低,这可能是由于温度过高,导致黄酮分解,从而使黄酮提取率降低[22]。因此,选择超声温度50℃为最佳。

图4 超声温度对黄酮提取率的影响Fig.4 Influence of ultrasonic temperature on the extraction rate of flavonoids
2.2.4 超声时间对黄酮提取率的影响
超声时间对黄酮提取率的影响见图5。

图5 超声时间对黄酮提取率的影响Fig.5 Influence of ultrasonic time on the extraction rate of flavonoids
由图5可看出,当超声时间在30 min~40 min范围内,黄酮提取率随时间的延长而增加,40 min时提取率达到最高,但是当超声时间超过40 min后,黄酮的提取率反而不断下降,这可能是由于长时间暴露在外面,黄酮类化合物被氧化分解[23],因此,选择超声时间40 min为最佳。
2.3 正交试验结果
依据2.2单因素试验结果,以黄酮提取率为考察指标,进行L9(34)正交试验,正交试验设计及结果见表2。

表2 L9(34)黄酮提取率正交试验结果Table 2L9(34)orthogonal experimental results of extraction rate of flavonoids

续表2 L9(34)黄酮提取率正交试验结果Continue table 2L9(34)orthogonal experimental results of extraction rate of flavonoids
由表2可看出4个因素对香椿老叶内黄酮提取率的影响大小为A(乙醇体积分数)>B(料液比)>D(超声温度)>C(超声时间),优化的提取工艺条件为A2B2C2D1。为了验证试验结果的可靠性,在最优条件下进行3次验证试验,所得的黄酮提取率分别为3.92%、3.99%、4.05%,均大于正交试验中任何一组的提取率,因此,确定黄酮最佳提取工艺为乙醇体积分数60%,料液比1∶30(g/mL),超声温度 40 ℃,超声时间 40 min。
2.4 黄酮含量比较
黄酮含量比较见图6。

图6 黄酮含量比较Fig.6 Comparison of flavonoid content
由图6可以看出,从10月到12月,5种香椿老叶的黄酮含量都有所增加,尤其是在10月至11月,山东临朐香椿的老叶中黄酮增长量较为显著,增长了2.98%,但是在11月至12月,临朐香椿老叶中黄酮含量增长较为缓慢,只增长了0.02%。在11月至12月,安徽太和的青油椿老叶中黄酮增长量较为明显,增长了1.09%,且在12月份,青油椿老叶中的黄酮含量最高,达到了6.45%。
2.5 抗氧化活性
2.5.1 DPPH自由基清除率结果比较
DPPH自由基清除率结果比较见图7。
通过图7可以得出随着5种香椿老叶黄酮提取液浓度的增加,DPPH自由基清除率都在增加,最后趋于平缓。并且可以看出VC的DPPH自由基清除率最高,5种香椿老叶中,青油椿清除自由基的能力最高,其次为临朐香椿,焦作香椿、黑油椿两种香椿自由基清除能力相差不多,西牟红椿的清除能力最低。由此可以得出:青油椿的抗氧化能力最高,这与不同香椿品种抗氧化物质含量比较的试验中,青油椿的含量最高这一结果相一致,再一次证明黄酮含量越高,自由基清除能力越高。

图7 DPPH自由基清除率比较Fig.7 Comparison of DPPH free radical scavenging rate
2.5.2 ABTS+自由基清除率结果比较
ABTS+自由基清除率结果比较见图8。

图8 ABTS+自由基清除率结果比较Fig.8 Comparison of ABTS+free radical scavenging rate
由图8可以得出随着5种香椿提取液浓度的增加,ABTS+自由基清除率都在增加,最后趋于平缓,且VC的ABTS+自由基的清除率最高,这与DPPH自由基清除率试验结果相似。在5种香椿老叶中,来自安徽太和的青油椿,对ABTS+自由基的清除率最高,即青油椿抗氧化能力最强。其余4种香椿的抗氧化能力相差不多。综上,随着黄酮浓度的增加,DPPH自由基清除率和ABTS+自由基清除率均随之增强,呈现一定的量效关系。并且来自安徽太和的青油椿抗氧化能力最高。
3 结论
本试验对香椿老叶中黄酮的最佳提取条件进行了研究,结果为乙醇体积分数60%,料液比1∶30(g/mL),超声温度40℃,超声时间40 min。在最佳提取条件下,分别对不同时期(10月、11月、12月)、不同品种(黑油椿、青油椿、焦作香椿、临朐香椿、西牟红椿)香椿老叶内黄酮含量进行比较,结果表明:从10月份到12月份,5种香椿老叶中的黄酮含量均有所增长,均在12月份达到最高含量,且在12月份,来自安徽太和的青油椿黄酮含量最高。黄酮含量比较显示:在10月至11月,山东临朐香椿的增长量较为显著,在11月至12月,安徽太和的青油椿黄酮增长量较为明显。抗氧化结果表明:随着黄酮浓度增加,DPPH自由基清除率和ABTS+自由基清除率也在逐步增大,具有一定的量效关系,且青油椿的抗氧化能力最高。
