外周动脉穿刺对造血干细胞采集的影响
2021-07-21田敏李向民徐冬梅孙岚岚白迎雪凌玥武晓玲
田敏 李向民 徐冬梅 孙岚岚 白迎雪 凌玥 武晓玲
(山东省千佛山医院,山东 济南 250014)
细胞因子动员的外周造血干细胞(Hematopoietic stem cell,HSC)的自体和异体移植越来越多地用于治疗血液系统疾病患者。据统计,2008-2016年我国共进行21 884例HSC移植,16 631例同种异体移植(76%)和5 253例自体移植(24%)[1]。2019年我国140家单位实施异基因HSC移植近万例[2]。使用基于离心的血液分离术收集HSC时,血细胞单采需要60~100 mL/min的连续血流量[3-4]。鉴于这种低流量的要求,外周静脉(Peripheral vein,PV)是最常见的血液通路类型[5]。但是当遇到血管充盈不佳、血流量不足时,机器会出现反复低压报警或管路凝血,严重影响采集效果。我院自2020年6月1日起,对周围血管条件不好、四肢静脉穿刺失败或无法满足血流量的患者选用外周动脉(Peripheral artery,PA)作为引血通路,静脉作为回血通路,满足了连续性离心式分离所需的血流量,解决了静脉作为采血通路血管压力低的问题,显著降低了报警次数,适用于HSC采集。目前关于不同类型血管通路的采集效率和质量的公开数据很少,本研究回顾性分析比较了PA穿刺和PV穿刺对HSC采集的影响,以期为临床提供借鉴,现报告如下。
1 资料与方法
1.1一般资料 本研究回顾性分析了2019-10月31日-2020年10月31日在我院血液科接受过HSC采集的自体或同种异体移植的所有成人患者和健康供体。
1.2资料收集 在病历中收集以下变量:年龄、性别、采集次数、不良反应(恶心、呕吐、心动过速、过敏等)发生情况、产品CD34+计数以及产品中性粒细胞百分率。在护理记录中收集血管通路类型、进液压力低报警次数、平均血液流速及穿刺次数。
1.3采集方法
1.3.1主要设备 COM.TEC血细胞分离机,一次性全封闭管路(P1YA,Fresenius 德国)和血液保存液500 mL袋(山东威高集团医用高分子制品股份有限公司,批号为:2005124)。
1.3.2采集过程 由经验丰富的护士确定采集血管通路。用18或20号针头穿刺。当难以使用静脉时,选择PA通路。血流速设置为40 mL/min ~60 L/min。产品质量通过CD 34+细胞计数和污染中性粒细胞的比例进行评估,通路有效性通过低压报警次数、平均血液流速和穿刺次数进行评估。
PA穿刺及护理方法:(1)穿刺方法:评估患者局部皮肤及动脉情况,动脉通路首选桡动脉,其次可选肱动脉、足背动脉等。常规消毒皮肤,戴手套,铺无菌巾。选择动脉搏动较强的一点,术者左手触摸动脉搏动,右手持动脉留置针与皮肤呈30°角进行穿刺,针头穿过动脉壁时有突破坚韧组织的穿透感,并有血液呈搏动状涌出,证明穿刺成功,将套管针放低,与皮肤呈10°角,再将动脉留置针向前推进1~2 mm,将外套管全部送入血管腔,退出针芯,敷贴固定好穿刺针,连接采集管路,开始采集。(2)采集过程中,全程监护。保持室内适宜的温、湿度,协助采集者取舒适体位,穿刺侧肢体适当制动。严密观察机器运转情况及供者的不适。与供者交谈或鼓励其采用看电视、听音乐等方式转移注意力,以减轻其焦虑、恐惧情绪。(3)采集过程中,关闭采集管路盐水滚夹,防止因动脉压力较大导致的回血。需暂停机器时,可打开采集管路盐水滚夹,盐水加压冲洗采集管路。(4)妥善固定管路,避免管路的扭曲、打折及脱落等。(5)拔针后延长按压时间,平均按压时间15~30 min,按压结束后观察穿刺部位,确定无渗血,给予伤口敷料覆盖。嘱采集者保持局部清洁、干燥,24 h后可取下敷料,再次观察穿刺处有无红肿热痛等不适,有问题及时对症处理。(6)需做二次采集时,可保留动脉管路,使用肝素盐水正压封管,连接肝素帽,以备下次采集使用。(7)如因穿刺失败或其他原因导致局部渗血、血肿应立即按压、冷敷,抬高患肢,必要时弹力绷带加压包扎止血。

2 结果
2.1采集者一般资料比较 2019年10月31日-2020年10月31日,22例患者和84位健康捐献者接受了共134次单采血液分离术以收集HSC。在这些患者中,HSC移植的适应症为淋巴瘤(n=18,16.98%)和骨髓瘤(n=4,3.77%)。88名采集者(83.02%)进行了PV穿刺,占134次采集过程的83.58%;18名采集者(16.98%)进行了PA穿刺,占134次采集过程的16.42%。异基因HSC移植的健康捐献者有14例(16.67%)需要进行PA穿刺,6例采用桡动脉,7例采用肱动脉,1例采用足背动脉进行穿刺。自体HSC移植的4名患者(18.18%)进行PA穿刺,2例采用桡动脉,2例采用肱动脉。自体HSC移植的22名患者中,4名患者(18.18%)在一次采集过程中收集了的一次移植所需的CD34+细胞总量(即CD34+>5×106/ kg)。其他患者需要多次采集,其中2次采集14例(63.64%),3次采集2例(9.09%),4次采集2例(9.09%)。同种异体HSC移植,95.24%(n=80)的供体一次即可获得所需数量的CD34+细胞。4例(4.76%)供体需要进行2次采集。与供体相比,自体采集的患者需要增加疗程次数和治疗的血量以获得目标剂量。见表1。

表1 采集者一般资料比较 例(%)
2.2血液分离术产品中的细胞含量比较 PV组产品中CD34+细胞比例为(0.38%±0.25%),PA组为(0.41%±0.19%)。见表2和表3。
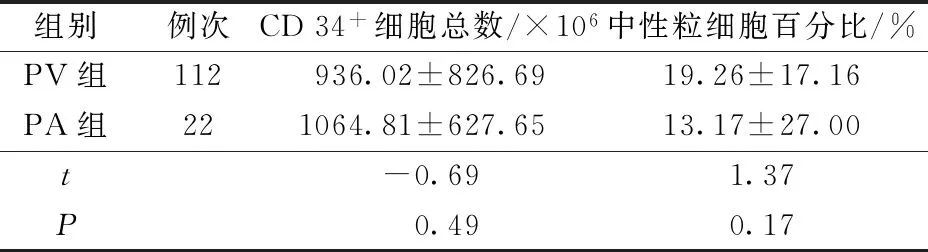
表2 两组产品CD 34+细胞数量和中性粒细胞百分率比较

表3 供体和自体产品CD 34+细胞数量对比
2.3不良事件发生情况比较 所有病例均采集顺利,未出现低血容量表现,无抽搐、手足麻木等低钙表现,无枸橼酸盐中毒等表现。
2.4采集过程中低压报警次数、平均血液流速及穿刺次数比较 见表4。

表4 两组采集过程中低压报警次数、平均血液流速及穿刺次数比较
3 讨论
良好的血管通路是HSC采集顺利完成的关键所在。建立顺畅的血管通路,采集过程中维持充足的血流量,可以使分离机不间断运转,避免因为血流量不足机器反复暂停而破坏白膜层的分层,可减少产品中红细胞的混入[6]。
在我国,HSC采集主要通过PV进行。但由于多次穿刺导致的血管硬化或血栓形成,PV可能变得难以穿刺。引血不足时机器发生报警,报警后分离机停止运转,无法采集干细胞。这时需让病人做松、握拳运动,或是在采血肢体上端系紧止血带,以此来增加血流压力这样既延长了采集时间,又给患者造成了心理压力,还易导致整个管道或分离器凝血堵塞而停机,使整个操作不能顺利进行,达不到治疗效果而需重新穿刺,增加患者痛苦,增加护士的工作量。
PV条件达不到采集要求时,常需通过中心静脉导管(Central venous catheter,CVC)进行采集。据文献报道,接受血液分离术的健康同种异体供体(尤其是女性)10%~30%可能需要实施CVC[3,7-8]。自体患者中需使用CVC进行采集的比例范围为35%~100%[8]。CVC的建立非常耗时,并且如果在不同的科室或医院中实施,可能会增加逻辑约束或延迟采集。Moreiras-Plaza等[9]指出,由于较低的压力和不稳定的血流,标准的中心静脉通路通常不足以进行单采血液穿刺术。Moreiras-Plaza和Padmanabhan等人报告了外周通路与流量相似的CVC通路相比[9-10],外周通路的单采率更高。这可能是由于CVC的再循环率所造成的。外周穿刺比CVC安全,并且感染风险比CVC低80%[11]。患者宁愿承受为数不多的几次疼痛,也不愿接受深静脉置管带来的恐惧感和经费开支。
动脉穿刺术是进行单采血液分离术的一种途径,但这种方法很少用,大约有0.4%是通过动脉穿刺术进行的[12-14]。PA穿刺的优点在于保证了充足的体外循环血流量,血流速度平稳,操作简单,且价格较为低廉。但对于PA采集的质量和效率鲜有报道。
CD 34+收集的效率是采集质量的重要方面之一。在本研究中,我们未观察到PV组和PA组之间有明显差异。并且通过PA通路采集更稳定、更快、更可靠。但是,由于回顾性收集数据,两组患者不同人群的样本量以及最终供体条件的异质性,本研究存在局限性。今后需要进行多中心前瞻性研究。
本研究回顾性分析比较了PA和PV通路对HSC采集的影响,就外周HSC产品的质量和安全性而言,PA组与PV组差异无统计学意义。为了避免在静脉通路困难的患者中使用CVC,可由受过专门培训的护士进行PA穿刺。在难以触及外周血管的个体中,在超声引导下进行PA穿刺可能是一个更好的选择[14-15]。
