1株具有抑菌和氨氮降解功能的海洋放线菌筛选与鉴定
2021-07-21汤曼利李舒馨陈莹莹王亚楠马桂珍暴增海
汤曼利,李舒馨,彭 云,陈莹莹,王亚楠,马桂珍,暴增海
( 1.江苏海洋大学 海洋生命与水产学院,江苏 连云港 222005; 2.河海大学 海洋学院海洋生物系,江苏 南京 210098 )
随着水产养殖产业集约化程度越来越高,水体中的污染物包括氨氮、亚硝态氮等化学污染物和弧菌等病原微生物的大量积累给产业造成了巨大损失,制约了水产养殖业的发展[1-2]。氨氮等化学污染物的增加引起养殖水体日渐富营养化,养殖水质恶化造成水中有害菌孳生,导致养殖病害频发;由弧菌引起的疾病流行面积广、发病率高,给养殖业造成了巨大危害。目前我国水产养殖业普遍使用化学法净化水体,水产病害的防治主要依赖抗生素,但长期施用抗生素会导致细菌耐药性的产生、对非靶生物产生毒害、破坏微生态平衡和对水产品消费者造成健康威胁等问题[3-4],而利用微生物治理养殖水体中的污染物能够弥补化学治理的不足,具有安全、无污染、可持续等优点,是发展无抗、健康养殖的有效手段和发展趋势。
近年来,海洋微生物的抑菌作用及其代谢产物研究在国内外引起广泛重视。日本对海洋微生物进行了广泛研究,发现约有27%的海洋微生物具有抗菌活性,其中放线菌产生的活性次生代谢产物约占目前已发现微生物活性次生代谢产物的50%,海洋放线菌中的链霉菌、小单胞菌等可对副溶血弧菌(Vibrioparahaemolyticus)、哈维氏弧菌(V.harveyi)、鳗弧菌(V.anguillarum)、溶藻弧菌(V.alginolyticus)、鲨鱼弧菌(V.carchariae)、霍乱弧菌(V.cholerae)等多种弧菌具有较强抑制作用[5-13]。海洋放线菌作为产新型抑菌活性物质的潜在来源,筛选海洋抑菌放线菌具有重要意义。从海洋中寻找具有拮抗弧菌作用的新型放线菌成为国内外的研究热点[14-16]。除了抑制弧菌等病原菌,海洋放线菌也可以利用环境所提供的营养物质(污染物)生长繁殖,发挥净化水质的作用[17-18]。开发利用海洋放线菌资源对调整和改善养殖生态环境、促进水生动物健康生长、实现水产养殖业持续发展发挥了重要作用[19-20]。
为获得高效抑制弧菌并降解氨氮的多功能放线菌菌株,本试验从37株海洋放线菌中筛选对弧菌具有抑菌活性并能降解氨氮的优良放线菌菌株,并对菌株进行种类鉴定,旨在为养殖水体污染物的治理提供优良菌株。
1 材料与方法
1.1 试验材料
1.1.1 供试海洋放线菌
37株海洋放线菌菌株,由本实验室在连云港海域中分离纯化并保存。
1.1.2 供试病原菌
副溶血弧菌、创伤弧菌(V.vulnificus)、嗜水气单胞菌(Aeromonashydrophila)由扬州大学动物科学与技术学院水产病害实验室提供,本实验室保藏;阴沟肠杆菌(Enterobactercloacae)、弗氏柠檬酸杆菌(Citrobacterfreundii)、大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)、角斑病菌(Pseudomonassyringae)、青枯病菌(Ralstoniasolanacearum)、白色念珠菌(Moniliaalbican)为本实验室保藏。
1.1.3 培养基
(1)放线菌活化培养基:高氏Ⅰ号培养基;
(2)放线菌发酵培养基:高氏Ⅰ号液体培养基;
(3)副溶血弧菌、创伤弧菌、嗜水气单胞菌、阴沟肠杆菌、弗氏柠檬酸杆菌活化培养基:2216E培养基;
(4)白色念珠菌活化培养基:PDA培养基;
(5)大肠杆菌、角斑病菌、青枯病菌、金黄色葡萄球菌活化培养基:牛肉膏蛋白胨培养基。
(6)氨氮降解菌筛选培养基[21]:葡萄糖5.0 g,(NH4)2SO40.05 g(氨氮质量浓度约为50 mg/L),NaCl 1.0 g,K2HPO40.5 g,MgSO4·7H2O 0.25 g,水1000 mL,pH 7.2。
1.2 海洋放线菌不同菌株无菌发酵液抑菌作用的测定
将供试37个放线菌菌株在高氏Ⅰ号培养基斜面上活化5 d,用无菌水洗下菌苔,制成5×106cfu/mL的菌悬液,按18%的接种量接入装有60 mL高氏Ⅰ号液体培养基的250 mL三角瓶内,于28 ℃、180 r/min条件下振荡培养7 d。发酵液于4 ℃、5000 r/min离心15 min,上清液用孔径0.22 μm的细菌过滤器过滤除菌,得到无菌发酵液。
以副溶血弧菌、创伤弧菌为指示菌,采用牛津杯法测定不同菌株无菌发酵液的抑菌活性[22]。将在2216E培养基斜面上培养24 h的指示菌分别用无菌水洗下,制备成5×106cfu/mL的菌悬液,取0.1 mL菌悬液涂布于2216E培养基平板上,制成含菌平板,每个含菌平板上等距离放置4个牛津杯,
每个牛津杯分别注入不同放线菌菌株的无菌发酵液200 μL,28 ℃条件下培养24 h,测量抑菌圈直径,比较不同菌株无菌发酵液的抑菌活性。每菌株3个平行。
1.3 具有较强抑菌作用放线菌抑菌谱的测定
采用牛津杯法测定1.2中筛选出的抑制弧菌作用较强的放线菌菌株无菌发酵液对10种病原菌的抑菌作用[23]。
1.4 具有较强抑菌作用放线菌菌株氨氮降解率的测定
1.4.1 氨氮标准工作曲线的制作
称取235.8 mg (NH4)2SO4溶于水,定容至100 mL,制成氨氮质量浓度为500 mg/L的氨氮贮备溶液,取氨氮贮备溶液进行稀释,制成氨氮质量浓度分别为5、10、15、20、25、30、35、40、45、50 mg/L的氨氮标准溶液,取不同质量浓度的氨氮标准液100 μL,分别加入溶液A和溶液B各5 mL,充分混合后,放入37 ℃水浴显色20 min,取出后冷却至室温,在637 nm下测定其吸光值(D637)。以氨氮质量浓度为横坐标,D637为纵坐标,计算回归方程,绘制标准曲线。
溶液A的配制:称取0.3622 g含2个结晶水的亚硝基铁氰化钠,溶于水并定容至25 mL,配制成质量分数为1.25%亚硝基铁氰化钠溶液,用棕色试剂瓶4 ℃保存。称取5.00 g苯酚,溶于400 mL水,加入2.0 mL配制好的亚硝基铁氰化钠溶液,定容至500 mL,为溶液A,用棕色试剂瓶4 ℃保存。
溶液B的配制:称取2.50 g NaOH、2.0 g柠檬酸三钠和3.5 mL NaClO溶于400 mL水中,定容至500 mL,为溶液B,用棕色试剂瓶4 ℃保存。
1.4.2 氨氮降解率的测定
将筛选出的抑制弧菌作用较强的放线菌菌株在高氏Ⅰ号培养基斜面上活化培养5 d,用氨氮降解菌筛选培养基洗下菌苔,制备成5×108cfu/mL菌悬液,按5%的接种量接入装有60 mL氨氮降解菌筛选培养基的250 mL三角瓶中,每个菌株接种3瓶,为3个平行,于28 ℃、180 r/min条件下振荡培养7 d。发酵液于4 ℃、5000 r/min条件下离心20 min,采用靛酚蓝分光光度法[24-25]测定不同菌株的上清液的D637,根据标准曲线计算不同菌株发酵液中的氨氮质量浓度,以未接种的筛选培养基中为对照,计算不同菌株的氨氮降解率(RD,%)。
RD=(ρ0-ρ1)/ρ0×100%
式中,ρ0为对照氨氮质量浓度(mg/L),ρ1为处理氨氮质量浓度(mg/L)。
1.5 兼具抑弧菌和氨氮降解功能的海洋放线菌的种类鉴定
1.5.1 形态学观察
将筛选出的兼具抑弧菌和氨氮降解功能的海洋放线菌菌株接种于高氏Ⅰ号平板培养基上,28 ℃培养7 d,观察记录培养基上菌落形态、颜色变化。
采用插片法,在高氏Ⅰ号培养基上划线接种放线菌菌株,插入灭菌的盖玻片,28 ℃分别培养1、3、5、7 d后,在显微镜下观察插片上的气生菌丝及孢子丝形态特征。
1.5.2 生理生化特性
采用细菌微量生化鉴定管进行生理生化特性试验[26]。
1.5.3 16S rDNA序列分析
用细菌基因组DNA快速抽提试剂盒提取放线菌菌株的基因组DNA作为模板,用细菌16S rDNA通用引物进行PCR扩增[27],上引物为27F:5′-AGAGTTTGATCATGGCTCAG-3′,下引物为1492R:5′-ACGGTTACCTTACCTTGTTACGAC TT-3′。PCR扩增体系(25 μL):2×San Taq PCR Mix 12.5 μL,上游引物27F(10 μmol/L)和下游引物1492R(10 μmol/L)各1 μL,DNA模板1 μL,ddH2O 9.5 μL。PCR扩增条件:94 ℃预变性4 min;94 ℃变性50 s,52 ℃退火50 s,72 ℃延伸1.5 min,循环数35;72 ℃延伸10 min;4 ℃保存[28]。PCR产物经1.0%的琼脂糖凝胶电泳检测回收纯化,送生工生物工程(上海)股份有限公司测序,所得的16S rDNA序列拼接完整后与GenBank数据库中已知序列进行BLAST比对,采用DNAMAN 4.0软件构建F28菌株的系统发育树。
2 结果与分析
2.1 海洋放线菌无菌发酵液的抑菌作用的测定
37株供试放线菌中有23株的无菌发酵液对副溶血弧菌具有抑制作用,其中F28、ZF-1、F9、F4、X3-X4-3、X1-6、B1-1菌株的抑菌圈直径大于20 mm,F28和ZF-1的抑菌作用最强,抑菌圈直径分别为(31.57±0.63) mm和(30.27±0.45) mm,与其他菌株具有显著差异;16株放线菌对创伤弧菌具有明显的抑制作用,其中F28、F9、X3-X4-3菌株抑菌圈直径大于15 mm,抑菌圈直径分别为(18.93±0.92) mm、(17.83±0.96) mm和(15.23±0.96) mm,F28和F9与其他菌株均具有显著差异(表1、图1和图2)。

表1 不同海洋放线菌对2种弧菌的抑制作用(抑菌圈直径) mm
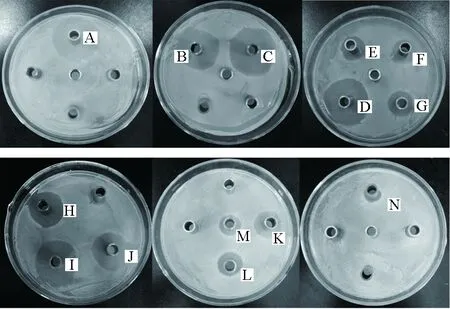
图1 不同海洋放线菌无菌发酵液对副溶血弧菌的抑制作用Fig.1 Inhibitory effect of sterile fermentation broth of different marine actinomycetes on V. parahaemolyticusA.ZF-1; B.F4; C.F28; D.F9; E.8-1; F.C31; G.C42; H.B1-1; I.X3-X4-3; J.X1-6; K.S2-1; L.14-27; M.F5; N.14-14.
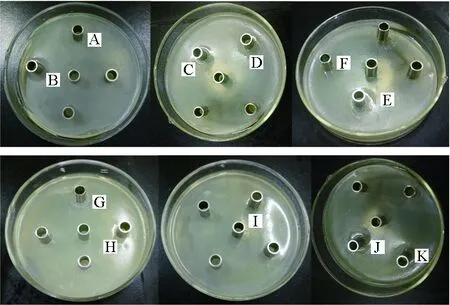
图2 不同海洋放线菌无菌发酵液对创伤弧菌的抑制作用Fig.2 Inhibitory effect of sterile fermentation broth of different marine actinomycetes on V. vulnificusA.F28; B.F4; C.X3-X4-3; D.X1-6; E.F9; F.C:B1-1; G.C42; H.B1-1; I.S2-1;J.8-1;K.C31.
2.2 具有较强抑菌作用放线菌抑菌谱的测定
采用牛津杯法测定8株抑菌作用较强的海洋放线菌菌株无菌发酵液对10种病原菌的抑菌作用,结果显示:菌株F28和F9抑菌作用强,抑菌谱广,对10种病原菌均具有较强抑菌活性,抑菌圈直径均大于14 mm,分别对3种和5种病原菌抑菌圈直径达20 mm,对副溶血弧菌的抑菌活性最高,抑菌圈直径分别达(31.57±0.63) mm和(27.13±0.97) mm;菌株ZF-1对9种病原菌有抑菌活性,其中对副溶血弧菌抑制效果最好,抑菌圈直径达(30.27±0.67) mm。菌株F4、XL-7、S2-1、X3-X4-3对5种病原菌有抑菌活性;菌株14-27对4种病原菌有抑菌活性(表2、图3)。

表2 海洋放线菌不同菌株对10种病原菌的抑菌作用(抑菌圈直径) mm
2.3 具有较强抑菌作用放线菌氨氮降解率的测定
2.3.1 氨氮标准工作曲线
将配制好的含有不同氨氮质量浓度的标准液在637 nm下进行比色,测定吸光值,以氨氮质量浓度为横坐标,以D637为纵坐标,制作氨氮标准工作曲线。在设置质量浓度范围内(图4),随着氨氮质量浓度的增加D637逐渐增大,呈正相关,计算回归方程,工作曲线方程为:y=0.0038+0.0155x,r2=0.9967,线性相关性较好,可以用于菌株发酵液中氨氮质量浓度的测定。
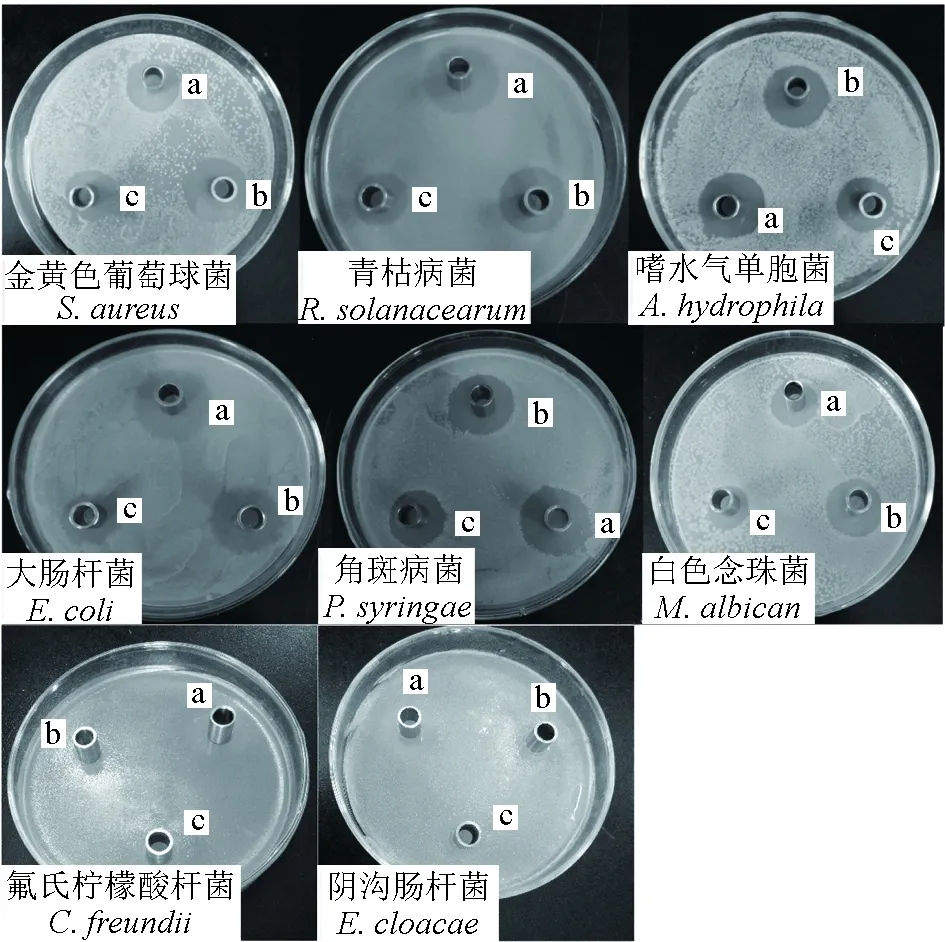
图3 3株放线菌菌株无菌发酵液对不同病原菌的抑制作用Fig.3 Inhibitory effect of sterile fermentation broth of three strains of actinomycetes on different pathogensa.F28; b.F9; c.ZF-1.
2.3.2 具有较强抑菌作用放线菌氨氮降解率的测定
不同放线菌菌株在氨氮降解菌发酵培养基中发酵7 d,采用靛酚蓝分光光度法测定不同菌株发酵液的氨氮质量浓度,计算氨氮降解率(表3)。不同菌株发酵液中氨氮质量浓度明显下降,8个菌株发酵液的氨氮质量浓度均低于接种前培养基的初始氨氮质量浓度(47.78±0.21) mg/L,其中7株放线菌的氨氮降解量大于20 mg/L,降解率大于40%,菌株14-27、菌株F28的氨氮降解率最高,分别为49.88%和46.86%,二者无显著性差异,而与其他菌株差异显著。
综合抑菌试验和氨氮降解试验结果,菌株F28具有较强的抑菌及降解氨氮作用,故选择菌株F28进行种类鉴定。
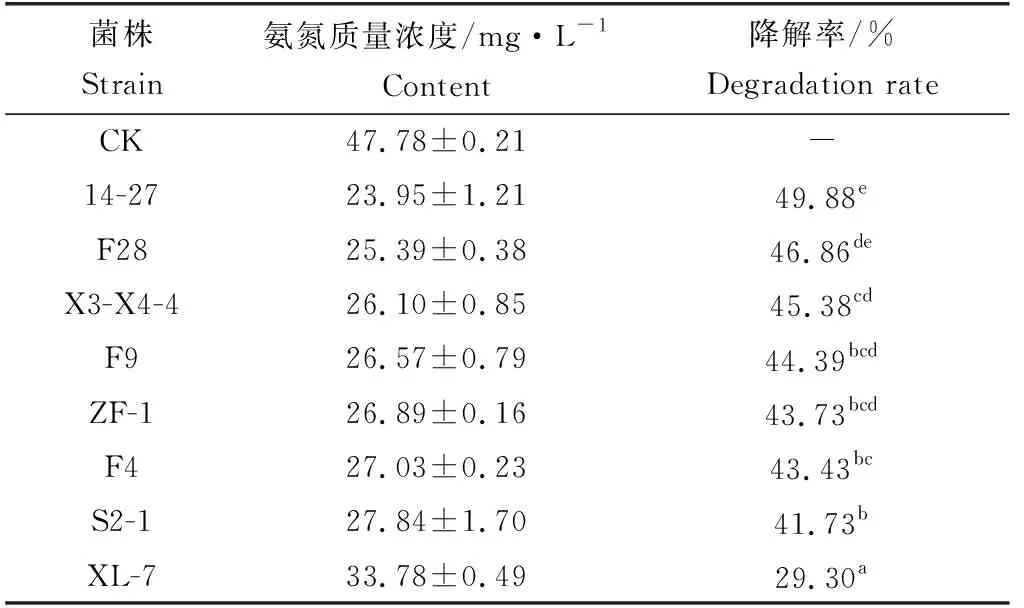
表3 8株海洋放线菌的氨氮降解率
2.4 兼具抑弧菌和氨氮降解功能的F28菌株的种类鉴定
2.4.1 形态学观察
菌株F28在高氏Ⅰ号培养基上初期菌落颜色为白色,5 d后变为淡黄色,干燥致密,菌落边缘呈锯齿状向外辐射。采用插片法,在显微镜下观察,F28的气生菌丝生长旺盛、分支多;孢子丝为直线形和波曲形;孢子表面光滑呈椭圆形(图5)。
2.4.2 生理生化特性
菌株F28滴加指示剂后鼠李糖、葡萄糖生化鉴定管颜色变为黄色,为阳性,说明该菌具有分解葡萄糖和鼠李糖的能力,不能利用肌醇、山梨醇、甘露醇、阿拉伯糖、蔗糖、麦芽糖、果糖、半乳糖作为碳源;尿素酶试验呈阳性,表明菌株F28具有将尿素分解产生氨的能力;苯丙氨酸脱氨酶、赖氨酸脱羧酶、精氨酸水解酶、氧化酶、硫化氢试验为阴性;半固体琼脂试验为阳性,表明菌株F28具有运动性(表4)。
根据形态学观察以及生理生化特性试验结果,查阅《伯杰细菌鉴定手册》和《链霉菌鉴定手册》等[29-30]相关文献,认为放线菌F28菌株符合链霉菌科链霉菌属(Streptomyces)的特征。
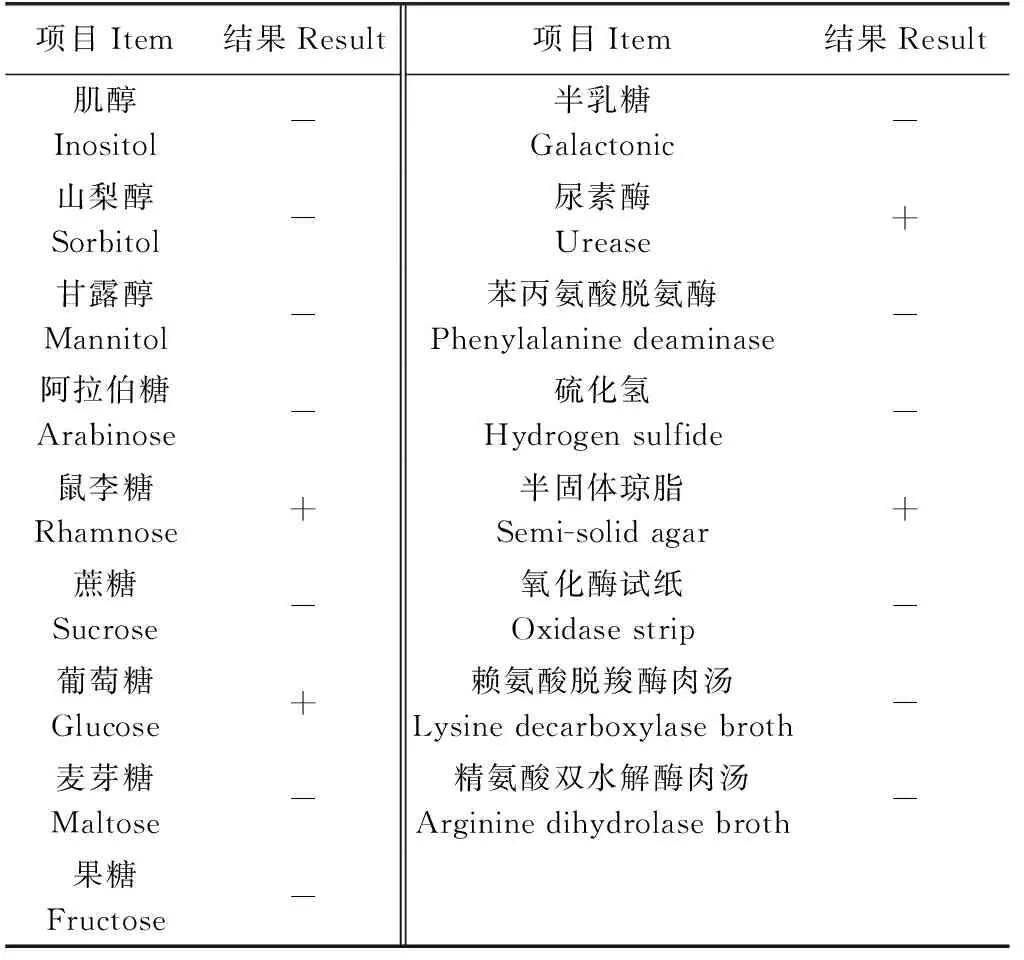
表4 菌株F28的生理生化特性
2.4.3 菌株F28的16S rDNA序列分析
菌株F28的16S rDNA序列扩增产物经1.0%琼脂糖凝胶电泳检测,得到单一条带。将纯化的PCR产物送生工生物工程(上海)股份有限公司测序,应用DNAMAN 4.0对序列测定双反应结果进行拼接,得到菌株F28的16S rDNA核苷酸序列,全长为1433 bp,将序列上传至GenBank数据库,获得登录号为MN647548。用Clustal X与数据库进行BLAST比对,菌株F28与梅久兰链霉菌(S.mediolani)相似性为99.86%。选取同属内同源性较高的不同菌株的16S rDNA序列,采用MEGA软件构建系统发育树,菌株F28与梅久兰链霉菌NR_112465.1聚为一支(图6)。
结合形态学观察与生理生化特性试验测定结果,认为菌株F28为链霉菌属的梅久兰链霉菌。
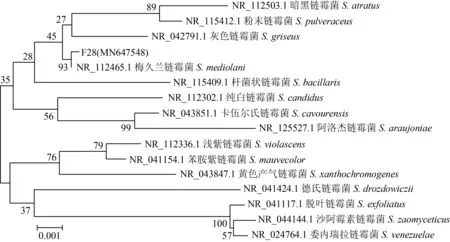
图6 F28菌株16S rDNA序列系统发育树Fig.6 Phylogenetic tree of 16S rDNA sequence of strain F28
3 讨 论
3.1 放线菌在水产养殖废水治理中的应用
目前水产养殖中用于治理水体污染物和弧菌病害的微生物主要有乳酸菌[31-32]、芽孢杆菌(Bacillus)[33]、交替单胞菌(Alteromonas)[34]、普罗威登斯菌(Providencia)[35]等细菌,而近年来,海洋放线菌用于养殖水体污染物的治理引起人们的关注。You等[12]研究表明,海洋放线菌能在养殖池水中抑制弧菌菌膜的形成并产生抗菌类物质,从而治疗和预防病原性弧菌引起的对虾病害;赵淑江等[5]从南麂岛附近的海域中分离筛选出对多种弧菌均有较强抑制作用的多株放线菌,其中放线菌NJR0956对副溶血弧菌抑菌圈直径达30 mm;李侠等[6]利用琼脂块法,测定了4株放线菌的抗菌谱,其中放线菌DJG10对鲨鱼弧菌抑制作用较强,抑菌圈直径达14.6 mm。相比于赵淑江等[5-6]分离的拮抗海洋放线菌,本试验分离的海洋放线菌F28抑菌效果更强,抑菌谱更广。王华等[36]研究表明,将放线菌与枯草芽孢杆菌(B.subtilis)以1∶1的接种比例接入水体中后,水体中氨氮、亚硝态氮的去除率达到最大,分别为69.2%和59.9%;王俊华等[17]在研究中发现,放线菌5406可以有效去除皂河黑臭水体中的氨氮、正磷酸盐等污染物;王梦亮等[18]发现,光合细菌、放线菌、枯草芽孢杆菌混合培养能有效去除养殖水体中的高含量有机氮,表明海洋放线菌在水产养殖中具有抑菌和治理水体污染的作用。现有研究主要针对抑菌或降解污染物的单一功能的放线菌菌株筛选和利用,具有抑菌和降解氨氮复合作用的海洋放线菌菌株研究较少,筛选具有抑菌和降解氨氮的复合功能的海洋放线菌菌株对于开发微生态制剂具有重要意义。
3.2 梅久兰链霉菌的研究现状
目前有关梅久兰链霉菌的研究较少。解玉红等[37]分离得到1株将纤维素降解为乙醇的梅久兰链霉菌K7-2;暴增海等[38]筛选到1株对多种植物病原真菌具有强抗菌作用的梅久兰链霉菌ZW-1;Jiménez等[39]从高等植物烟草红豆杉的根系中分离得到1株梅久兰链霉菌AC37,其代谢产物为(-)-8-O-甲基四霉素,对多种病原菌有较强抑制作用。有关梅久兰链霉菌对水产病原菌的抑菌作用和氨氮降解作用尚未见报道。
本试验筛选到的梅久兰链霉菌F28对弧菌和多种病原菌具有较强抑制作用,同时具有降解氨氮作用,表现出良好的开发应用前景。今后将进一步开展该菌株的抑菌作用机理、发酵条件优化以及在水产养殖中的应用效果及安全性评价等研究,为该菌株的开发应用提供理论依据。
4 结 论
37株海洋放线菌菌株中有15株对副溶血弧菌和创伤弧菌均具有抑制作用,其中菌株F28的抑菌作用最强,对副溶血弧菌和创伤弧菌的抑菌圈直径分别为(31.57±0.63) mm和(18.93±0.92) mm,在初始氨氮质量浓度为50 mg/L时对氨氮的降解率为46.86%,初步鉴定菌株F28为梅久兰链霉菌。
