渔用口服疫苗递送系统的研究进展
2021-07-21袁高亮孔祥会
袁高亮,朱 雷,孔祥会
( 河南师范大学 水产学院,河南 新乡 453007 )
随着全球集约化、工厂化养殖程度的不断提高,鱼类病害也急剧增加,每年因水产养殖病害问题而造成的直接经济损失超过百亿元,给各国水产养殖业健康发展带来巨大威胁。疫苗能够有效地提高水产动物的免疫力,不但能预防水产动物疾病大规模暴发,而且还能减少化学类药物的使用和降低对环境的污染,对于助推水产养殖业绿色和可持续发展具有重要意义[1-2]。免疫接种疫苗是防治鱼病非常有效的措施,其中渔用口服疫苗具有成本低、易接种、适用于不同规格的水产动物等优点,一直是国内外水产疫苗的研究热点[3]。然而,由于渔用口服疫苗易在胃、肠道中受到胃酸和消化酶作用而降解,免疫原性遭到严重破坏,保护率达不到预期效果[4]。因此,如何将口服疫苗安全高效地递送到目的部位,使其在体内保持较长时间且不被降解,从而有利于诱发机体的免疫应答反应,并达到增强免疫的效果,已成为口服疫苗研发的关键。
安全高效的递送系统是渔用口服疫苗发挥功能的基础和保障,疫苗递送系统是一类借助载体的疫苗导入系统,疫苗递送系统可将抗原安全递送到后肠而不受消化系统的破坏,使其吸收后被免疫细胞识别并诱发免疫应答反应,是渔用口服疫苗发挥功能的保障。目前研究较多的疫苗递送系统主要包括两大类:化学载体递送系统和生物载体递送系统。其中,化学载体递送系统种类主要包括天然高分子聚合物和合成高分子聚合物,天然高分子聚合物又包括海藻酸盐、壳聚糖[5]与脂质体等;而合成高分子聚合物主要包括聚乳酸羟基乙酸共聚物(PLGA)和聚乳酸聚乙二醇共聚物(PELA)等。生物载体递送系统种类包括细菌、真菌、昆虫与植物等,其中,细菌主要有大肠杆菌(Escherichiacoli)、乳酸杆菌(Lactobacillus)和枯草芽孢杆菌(Bacillussubtilis)等,应用较多的昆虫载体包括甜菜夜蛾和家蚕等,植物载体包括藻类、烟草和水稻等。疫苗递送技术研发为口服疫苗的发展提供了有力的技术支撑,从而加快渔用疫苗的推广和应用,对于水产健康养殖和可持续发展具有重要意义。笔者主要从渔用口服疫苗递送系统的概况与种类两个方面对近年来渔用口服疫苗递送系统的相关研究进展进行综述,以期为进一步研究新型高效的渔用口服疫苗递送系统提供参考依据。
1 渔用口服疫苗递送系统的概况
从动物福利、方便程度、成本节省等角度考虑,口服接种都是水产动物比较理想的免疫接种方式。早在1942年,Duff[6]就成功研发了杀鲑气单胞菌(Aeromonassalmonicida)的灭活口服疫苗,拉开了口服疫苗防控水产动物疾病的序幕。但相比较人用和兽用的口服疫苗研究,渔用口服疫苗的发展较为缓慢。20世纪末期,研究人员尝试开发递送渔用口服疫苗的载体,以确保疫苗到达后肠,提高免疫保护率[7]。随着工业的发展和制备工艺的创新,化学递送载体在人类生物制品制备领域的研发和应用逐渐成熟,有效地避免了口服疫苗在胃或前肠被降解,同时也增强了疫苗有效成分的递呈作用。1995年Boudinot等[8]开展了聚乳酸—羟基乙酸共聚物纳米微球递送渔用口服疫苗的研究,这是合成高分子聚合物作为水产疫苗递送载体的首次尝试,2年后,天然高分子聚合物海藻酸盐也被用作水产动物口服疫苗的递送载体,以保护疫苗不被消化道降解[9]。进入21世纪后,随着水产动物免疫学和基因工程技术的发展,生物载体也逐渐用在渔用口服疫苗的生产和递送中。其中,植物载体最早在2005年应用于水产口服疫苗,Companjen等[10]将马铃薯作为表达和递送载体,成功表达了绿色荧光蛋白和大肠杆菌不耐热肠毒素B亚单位融合蛋白,用该递送载体口服免疫鲤鱼(Cyprinuscarpio),能引起特异性免疫反应。2007年,首次报道了草鱼(Ctenopharyngodonidellus)呼肠孤病毒内衣壳非融合蛋白VP6和增强型绿色荧光蛋白在杆状病毒/甜菜夜蛾细胞中的表达,为昆虫载体的研发应用提供了技术支撑[11]。近年来,随着人们对鱼体免疫系统尤其是肠黏膜免疫的深入了解以及生物工程技术的快速发展,越来越多不同类型的递送载体在渔用口服疫苗上应用[12-13]。目前研究较多的渔用口服疫苗递送载体主要包括天然高分子聚合物、合成高分子聚合物、细菌(益生菌)、真菌、病毒/昆虫与植物等,且不同种类的递送载体各有优缺点(表1)。
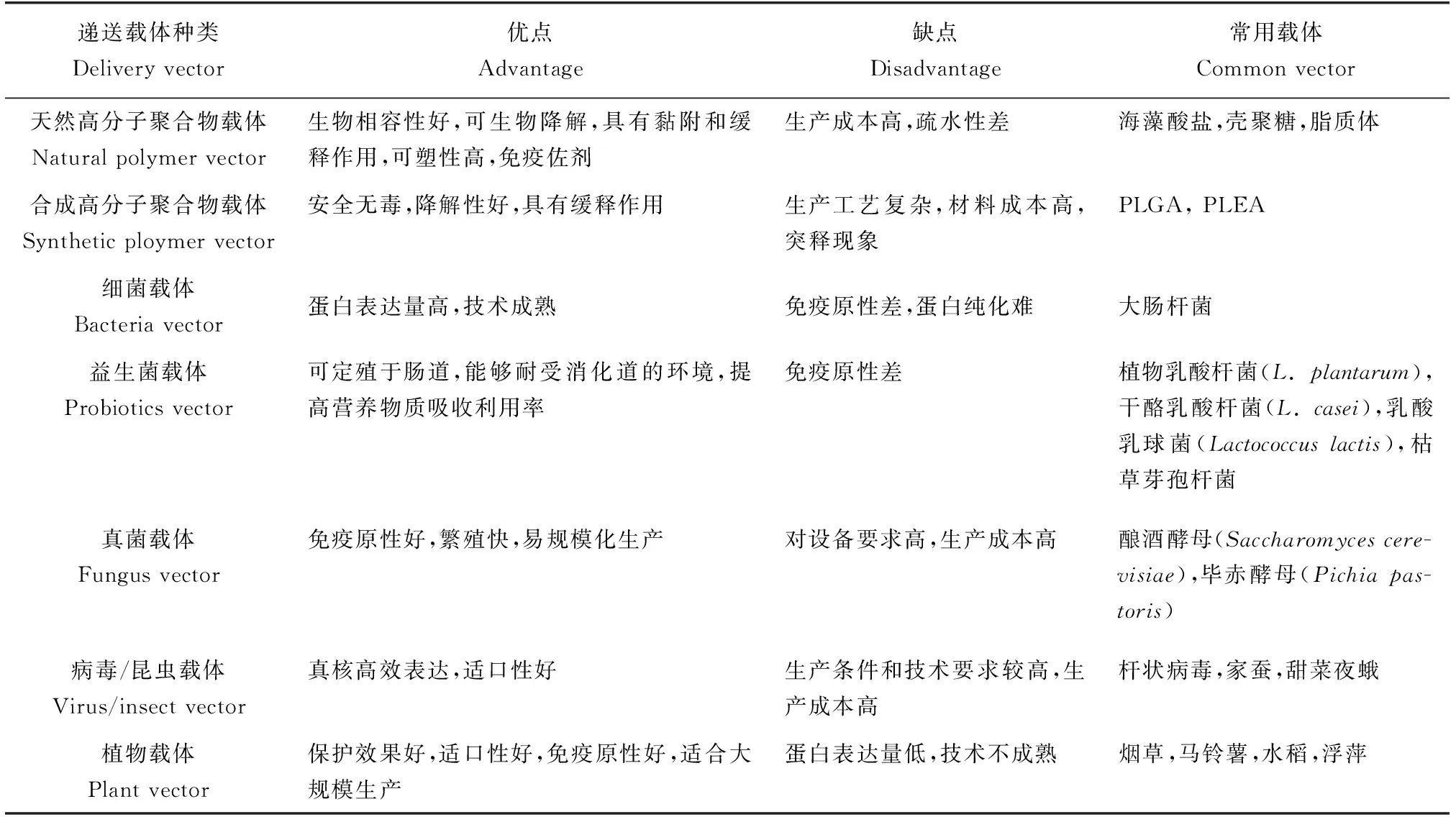
表1 不同类型渔用口服疫苗递送载体的优缺点比较
2 渔用口服疫苗递送系统的种类
2.1 化学载体递送系统
化学载体递送系统主要依赖可生物降解微球(微囊)的作用,其原理在于微囊降解速度缓慢,使口服疫苗避免胃酸和消化酶的破坏,减少接种次数,增强免疫应答[14]。随着新型材料的发现和微囊包封工艺的不断创新和成熟,渔用微囊口服疫苗已经在实验室内取得了较好的免疫效果,微囊分为天然高分子聚合物和合成高分子聚合物两种[15]。
2.1.1 天然高分子聚合物载体
海藻酸盐[16]、壳聚糖与脂质体等天然高分子聚合物均是口服疫苗递送载体的合适选择。其中,海藻酸盐、壳聚糖是受关注度最高的阴离子型和阳离子型天然高分子聚合物[17-18],其优点包括价格低、无毒、可生物降解、生物相容性好等。通过天然高分子聚合物对疫苗进行吸附、包裹或键合,不仅可以避免胃酸和消化酶对抗原的破坏,而且有利于控制疫苗的释放速度[19]。但天然高分子聚合物也有缺点,比如包封时会有污染物存在,且疏水性差,同批间的质量不均一等[20]。
近年来,天然高分子聚合物已应用在传染性造血组织坏死病病毒、鱼类淋巴囊肿病毒、传染性胰腺坏死病毒、嗜水气单胞菌(A.hydrophila)、杀鲑气单胞菌、海豚链球菌(Streptococcusiniae)等病原的口服疫苗包封[21-27]。Ballesteros等[21]研制了虹鳟(Oncorhynchusmykiss)的微囊化传染性造血组织坏死病病毒疫苗,有效避免了疫苗在胃肠内的降解,且免疫后虹鳟体内IgM、IFN-1和Mx-1等相关免疫基因的表达出现明显上调,免疫组相对存活率提高至56%。用海藻酸钠将灭活嗜水气单胞菌疫苗包裹后口服免疫异育银鲫(Carassiusauratusgibelio),结果显示,口服微囊化疫苗的相对存活率为61.1%,高于对照组的50%[22]。经修饰的杀鲑气单胞菌重组蛋白包埋在海藻酸盐中,口服藻酸盐疫苗后可明显提高鲫鱼(Carassiusauartus)血清的抗体效价[23]。Tian等[24]制备了鱼类淋巴囊肿病毒的微囊疫苗,证明海藻酸盐是口服疫苗的良好递送载体,在保护疫苗不被破坏的同时,也能引起鱼体的免疫反应。此外,也有同时用两种包封材料作为递送系统的,如选用广泛用于控制口服疫苗释放的海藻酸盐和壳聚糖作为海豚链球菌口服疫苗的复合递送载体,优化了制备微球和包封的条件,使包封率达到92.38%,并在体内和体外对疫苗稳定性和安全性进行了评价[25]。Halimi等[26]采用电离层凝胶化将海藻酸盐和壳聚糖混合后包封格式乳球菌(L.garvieae)和海豚链球菌疫苗,免疫虹鳟后,两种疫苗的免疫保护率分别达到66.67%和76.67%,均比非包封疫苗对照组高。然而,用海藻酸钠包封的鲤春病毒血症病毒DNA疫苗未达到预期保护率,与对照组相比甚至加速了鲤鱼死亡,分析原因可能是海藻酸盐的接种剂量或接种程序不适宜[27]。
天然高分子聚合物适合作为口服疫苗的递送系统,在口服过程中可以起到保护疫苗和缓释作用,并且将不同材料联合使用效果将会更好。但是,不同口服疫苗所需包封基质应针对鱼的种类和特定病原体进行相应调整,且接种次数和剂量仍需进一步研究。
2.1.2 合成高分子聚合物载体
目前,研究较多的合成高分子聚合物主要有聚乳酸—羟基乙酸共聚物和聚乳酸—聚乙二醇共聚物等。高铭蔚等[28]用聚乳酸—羟基乙酸共聚物包裹无乳链球菌(S.agalactiae)灭活疫苗免疫尼罗罗非鱼(Oreochromisniloticus),其产生的抗体可在高水平维持较长时间。Kole等[29]同样用聚乳酸—羟基乙酸共聚物作为递送系统对灭活病毒性出血性败血症病毒疫苗进行包封,试验中先将两个试验组的褐牙鲆(Paralichthysolivaceus)进行浸泡接种,两周后再用同等剂量的疫苗分别进行了浸泡接种和口服接种,结果显示,免疫组血清、皮肤黏液和肠道黏液中特异性抗体滴度在免疫后均升高,且相关免疫基因的表达水平也显著上调,攻毒后相对存活率浸泡/口服组为73.3%,高于浸泡/浸泡组的60%。Ma等[30]初步评价了壳聚糖和聚乳酸—羟基乙酸共聚物递送载体对海豚链球菌疫苗的保护效果,口服微囊疫苗组的罗非鱼脾脏和肾脏中部分细胞因子(IL-1β, TNF-α, CC1和 CC2)基因表达水平显著上调,且不同免疫剂量的相对保护率为41.67%~95.83%。以上研究结果表明,聚乳酸—羟基乙酸共聚物对口服疫苗可起到缓释作用,并具有较好免疫效果。
化学载体递送系统可保护抗原成分免受消化液破坏,并能产生较好免疫效果,但也存在一些问题。首先,包封材料大多价格昂贵,且关键配方和工艺参数均可影响口服疫苗的保护效果[31];其次,渔用口服疫苗化学载体的研究不够深入,主要借鉴畜禽的剂量和种类,但由于水生生物肠道黏膜免疫系统的特殊性,往往达不到理想的效果。这些均需在以后的研究中加以优化,研发出高效、便捷、易于推广的渔用疫苗化学载体递送系统。
2.2 生物载体递送系统
生物载体递送系统是指能保护和增强疫苗摄入,且具有生物活性的载体,多指天然的生物饵料或益生菌,此类载体大多兼具高效表达外源蛋白的功能。生物载体递送系统相比其他递送系统具有双重优势,不仅抗原呈递的有效性较高,且能表达外源抗原,简化了疫苗制备和使用程序,但通过生物载体表达的蛋白一般效率不高。因此,筛选高效表达的生物载体是未来研究的重点。目前,细菌、真菌、病毒、昆虫和植物[32]等已陆续被选用为生物载体。
2.2.1 细菌载体
大肠杆菌、枯草芽孢杆菌、乳酸乳球菌等是生产亚单位疫苗中最广泛的蛋白表达和传递系统,其中益生菌也常作为饵料添加剂应用于水产养殖业,并且已被证实能起到很好地防治疾病和提高免疫力的作用[33]。来自水产动物肠道的一些益生菌能定殖于肠道,一次接种便可长期免疫,且益生菌可改善鱼体消化功能,提高其生长效率,从而获得较好的经济效益,相比其他细菌,更适合作为渔用口服疫苗的递送载体。
大肠杆菌作为经典的原核表达系统,在重组亚单位疫苗的研发和生产中应用较多,其中Daniel等[34]用大肠杆菌成功表达了病毒性神经坏死病毒的衣壳蛋白,结果显示,口服免疫组的鱼血清中特异性抗体滴度显著上调,免疫保护率达100%。此外,草鱼口服含有草鱼呼肠孤病毒VP5或VP7蛋白的灭活大肠杆菌,对草鱼也具有很好的保护作用[35]。
乳酸菌安全无毒,环境胁迫抗逆性高,其表面表达的一些抗原可作为天然的免疫佐剂。此外,乳酸菌的外源基因容量大,部分种类可定殖于肠道,是一种理想的基因工程口服疫苗的载体,目前乳酸杆菌属和乳球菌属作为疫苗传递系统的相关研究最多[36-38]。Cui等[39]选用植物乳酸杆菌制备并递送鲤春病毒血症病毒疫苗与锦鲤疱疹病毒疫苗,经口服免疫鲤鱼和锦鲤(C.carpiokoi)后,可改善鱼体消化功能,激发鱼体产生特异性抗体,且免疫组的免疫保护率分别为71%和53%。还有学者分别将维氏气单胞菌(A.veronii)外膜蛋白AI(OmpAI)和W(OmpW)在干酪乳酸杆菌中表达,并以口服的形式免疫鲤鱼,结果免疫组保护率为40%~66.7%[40-41]。另外,Zhao等[42]将牙鲆弹状病毒的糖蛋白成功表达于乳酸乳球菌细胞表面,实现了对牙鲆弹状病毒较强的免疫保护作用,免疫保护率达60.7%。综上可知,目前乳酸菌作为口服疫苗递送系统,针对细菌或病毒等不同类型病原均适用,但免疫保护率相比注射疫苗较低,其具体免疫程序仍需进一步研究。
此外,也有枯草芽孢杆菌被用作口服疫苗递送载体的研究,如将草鱼呼肠孤病毒S6编码的外衣壳蛋白VP4与枯草芽孢杆菌的衣壳蛋白CotC基因融合,制备成口服疫苗,用该疫苗免疫草鱼,发现可在草鱼肠道引发先天性和特异性免疫,且免疫保护率达到57%[43]。Yao等[44]用枯草芽孢杆菌制备的无乳链球菌疫苗,对罗非鱼进行口服免疫,ELISA检测显示免疫的鱼血清中有特异性抗体,攻毒后免疫保护率达到41.7%。
以上研究表明,细菌(尤其是益生菌)不仅可以促进鱼体消化,且能引发先天性和适应性免疫,适用于口服疫苗递送系统。但是免疫保护率相对较低,针对不同病原体没有具体的免疫程序,且具体的免疫机制研究较少,需进一步研究。
2.2.2 真菌载体
相比具有原核表达系统的细菌,酵母菌等真菌的真核表达系统所表达的外源蛋白免疫原性更好,更容易激发机体的免疫反应。酵母具有繁殖快、适口性好、易于进行基因操作等优点,其作为渔用口服疫苗的载体,不仅改善了一般口服疫苗适口性差的缺点,而且也延长了疫苗在水产动物体内产生免疫力的持续时间。目前,酵母已被证明可以表达外源蛋白并将其安全递送到多个物种的黏膜免疫系统[45-49]。水产上用于口服疫苗递送系统的酵母主要有酿酒酵母和毕赤酵母。有研究证明,鲫鱼口服含绿色荧光蛋白载体的酿酒酵母可以在后肠高效表达绿色荧光蛋白,随后以卵清蛋白为免疫原,构建含不同表达载体(在肠道上皮细胞中表达和在酵母细胞中表达)的重组酿酒酵母,结果检测到所有口服免疫组均有特异性血清抗体,且前者比后者引起的免疫反应更强[50]。研究结果表明,酿酒酵母可作为口服疫苗的载体,为口服疫苗的安全递送提供了新的思路。Han等[51]初步评价了用重组酿酒酵母制备的嗜水气单胞菌口服疫苗对鲫鱼的保护效果,通过免疫组织化学检测到鲫肠道黏膜表达抗原蛋白基因,且特异性抗体显著增加,攻毒后累计死亡率为46.7%,相比对照组有了明显的下降。Cho等[52]用重组酿酒酵母表达的神经坏死病毒的衣壳蛋白作为疫苗口服灌喂七带石斑鱼(Epinephelusseptemfasciatus),攻毒后重组酵母破碎组和重组酵母非破碎组免疫保护率分别为96.5%和75%,结果表明,以酵母作为生产和递送载体,经口服免疫后对石斑鱼保护效果较好,并且重组酵母的状态对免疫效果有一定的影响。此外,也有尝试用毕赤酵母作为口服疫苗的递送载体,将含有绿色荧光蛋白的毕赤酵母饲喂鲤鱼和虹鳟,经检测,鲤鱼在口服24 h后,前肠和中肠有绿色荧光,虹鳟在口服仅6 h后前肠、中肠和后肠均可检测到绿色荧光,表明利用毕赤酵母作为递送载体,均可将抗原完整地传递到不同鱼肠黏膜上皮细胞[53]。综上所述,酵母表达和递送系统操作简单,易于大规模生产,相比原核表达系统递送的疫苗性质更稳定,免疫原性更高,适于作为口服疫苗的传递系统,而且酵母又是天然的饲料添加剂,具有适应各种鱼类消化道环境的特性,有助于在水产养殖中开发和应用。
2.2.3 病毒/昆虫载体
杆状病毒/昆虫细胞表达系统经过近30年的发展已成为重组蛋白生产的重要平台,也是口服疫苗的主要递送系统之一。目前已广泛应用于人用疫苗和兽用疫苗生产上,但在渔用疫苗上还处于实验室研究阶段。杆状病毒可单独作为递送载体,直接进入哺乳动物和鱼类细胞。Li等[54]利用杆状病毒作为递送载体制备鲤疱疹病毒疫苗,经注射和口服对异育银鲫进行免疫,结果口服免疫组的相对保护率为59.3%,注射免疫组的相对保护率为80%。昆虫也可单独作为口服疫苗的递送系统[55-56]。目前研究较多的是利用杆状病毒作为载体导入昆虫体内表达抗原蛋白,制成冻干粉口服免疫鱼类,例如,将含有草鱼呼肠孤病毒VP6的重组杆状病毒导入蚕中,在120 h后将其制成冻干粉口服疫苗,当饲喂含1%、5%、10%的冻干粉饲料时,可检测到草鱼血清中有VP6的特异性抗体[57]。综上所述,杆状病毒、昆虫及杆状病毒/昆虫细胞表达系统均可作为口服疫苗递送系统进一步开发利用,但由于生产条件和技术要求较高,会导致生产成本增加,影响渔用口服疫苗的推广使用。
2.2.4 植物载体
随着交叉学科的应用,尤其是近年来分子免疫学和基因工程技术的发展,在过去的10年中,利用植物作为抗原生产系统受到了广泛的关注。植物载体的优点在于易于规模化生产、成本低等,其已成为国际上新型高技术疫苗研究的趋势[58]。目前,利用转基因植物生产渔用疫苗已有报道[59]。转基因植物疫苗通常指用一种或多种病原的保护性蛋白整合进植物表达载体,使其在可食性植物中表达,使水产动物摄食时获得免疫。植物细胞是天然的生物胶囊,作为递送系统可减少口服疫苗在水产动物消化道内的降解,并且具有抗原活性高,无需纯化蛋白可直接使用等优点[60]。在畜禽方面,Aleksey等[61-62]将目标肽(禽流感病毒H5N1的M2e肽)与不同载体蛋白融合在浮萍中获得了较高水平的表达,口服免疫小鼠后检测出其体内出现特异性抗体。该研究结果证明了禽流感病毒M2e在核转化浮萍中表达的可行性,为开发基于浮萍表达递送系统的渔用口服疫苗提供参考。 Seong等[63]将神经坏死病毒的衣壳蛋白在烟草叶绿体中成功表达,对小鼠和斑马鱼进行口服免疫,随后在小鼠和斑马鱼体中检测出特异性抗体。利用水稻愈伤组织制备和递送的条石鲷虹彩病毒和草鱼呼肠孤病毒口服疫苗,可成功诱导黏膜免疫[64-65]。以上研究表明,以植物为表达系统生产和递送渔用口服疫苗具有可行性,且植物表达递送系统相对其他递送系统生产条件最简单,能最大程度降低成本,操作方便,尤其针对草食性鱼类无需加工可直接口服免疫,为进一步推动口服疫苗的应用提供了强有力的技术支撑,是目前国内外研究的热点之一,但利用植物表达递送系统进行渔用疫苗的导入和应用仍需深入研究。
3 总结与展望
水产动物疾病的频发已成为水产动物健康养殖和可持续发展的瓶颈,由于水产动物所处环境的特殊性,采用常规的注射接种免疫较为繁琐且成本较高,口服免疫是一种较为方便的免疫方式。渔用口服疫苗在水产养殖中有着广阔的应用前景,口服疫苗的应用受接种对象规格大小、接种时间和次数等限制较少。利用口服疫苗对水产动物进行免疫不仅有效避免了由于注射引起的机体应激反应和机械损伤,而且可以减少人力和物力的投入,降低养殖成本,在养殖生产中易于推广和应用。但其缺点也较为明显:易受消化液的破坏,抗原免疫性下降,免疫保护率低等。口服疫苗递送载体的应用可减少疫苗在胃肠道的降解,并且使抗原物质能够缓慢而持久地释放,以便达到更好的免疫效果。虽然目前递送载体的种类较多,但大多处于研发的初级阶段,尚不能满足实际应用需求。因此,今后渔用口服疫苗的研究重点应是研发价格低廉、保护效果好的递送载体以及不同载体的联合使用。此外,口服免疫时合理的免疫剂量、适宜的免疫时间及次数等仍需要进一步优化,以提高疫苗免疫保护率,从而防控鱼类疾病发生,确保水产动物健康养殖和可持续发展。
